Оглавление:
Химическая кинетика и химическое равновесие
Задача № 1. Написать математическое выражение скорости прямой и обратной реакций:
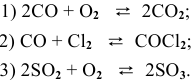
Пример 59
Для реакции 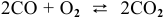 согласно закону действия масс выражения скоростей реакции следующие:
согласно закону действия масс выражения скоростей реакции следующие:
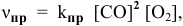
где 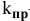 — константа скорости прямой реакции;
— константа скорости прямой реакции;
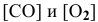 — соответственно концентрации
— соответственно концентрации 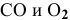 ;
;
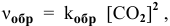
где 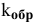 — константа скорости обратной реакции;
— константа скорости обратной реакции;
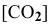 — концентрация
— концентрация 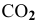 .
.
Задача 43
Определить начальную скорость реакции с константой скорости прямой реакции к в растворе, полученном смешением 2 л 0,6 М раствора 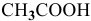 и 3 л 1 М раствора
и 3 л 1 М раствора 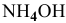 .
.
Решение:
Уравнение химической реакции, происходящей в смеси двух растворов, следующее:
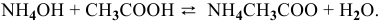
Согласно закону действия масс выражение скорости химической реакции
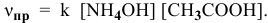
Для определения скорости реакции необходимо знать величину концентраций веществ 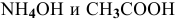 в момент их смешения. Для этого определим объем смеси двух растворов:
в момент их смешения. Для этого определим объем смеси двух растворов:
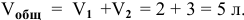
Зная, что в исходном растворе уксусной кислоты содержится 0,6-2 = = 1,2 моль 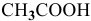 , находим ее концентрацию в смеси:
, находим ее концентрацию в смеси:
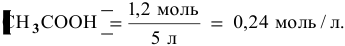
В исходном растворе гидроксида аммония содержится 1-3=3 моль 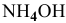 , значит, концентрация его в смеси
, значит, концентрация его в смеси
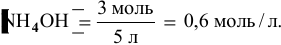
Определяем начальную скорость реакции:
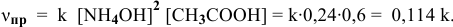
Задача 44
Как изменится скорость прямой реакции
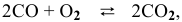
если давление увеличить в 3 раза?
Решение:
Предположим, что в начальный момент до повышения давления концентрации реагирующих веществ следующие:
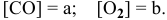
Скорость реакции, определяемая по закону действия масс, до повышения давления равна:
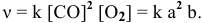
Согласно уравнению Менделеева-Клапейрона 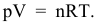 Повышение давления в 3 раза приводит к повышению концентрации каждого компонента в 3 раза.
Повышение давления в 3 раза приводит к повышению концентрации каждого компонента в 3 раза.
Таким образом, после повышения давления концентрации реагирующих веществ станут равными:
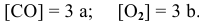
Скорость реакции после повышения давления
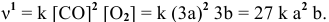
Повышение скорости реакции будет следующим:
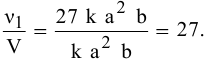
При повышении давления в 3 раза скорость прямой реакции увеличивается в 27 раз.
Задача 45
Во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 90°С? Температурный коэффициент реакции у равен 2,5.
Решение:
Согласно правилу Вант-Гоффа
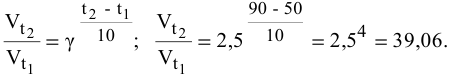
Задача 46
Константа скорости реакции разложения HI равна 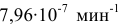 при 280°С и
при 280°С и 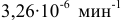 при 300°С. Определить энергию активации, константу скорости при 310 °C и температурный коэффициент скорости реакции.
при 300°С. Определить энергию активации, константу скорости при 310 °C и температурный коэффициент скорости реакции.
Решение:
Воспользуемся формулой, являющейся производной уравнения Аррениуса:
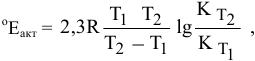
где

Теперь, зная энергию активации, можно рассчитать константу скорости реакции при 310 °C:
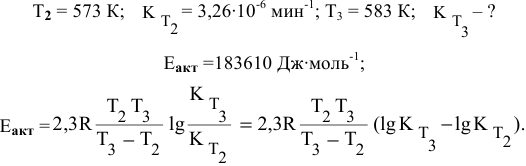
Отсюда
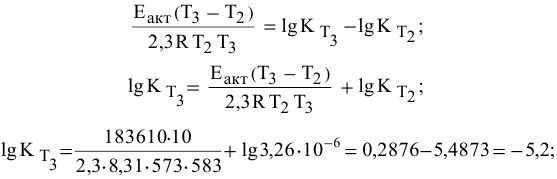
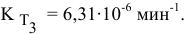
Определяем температурный коэффициент по следующей формуле:
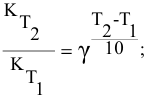
Отсюда
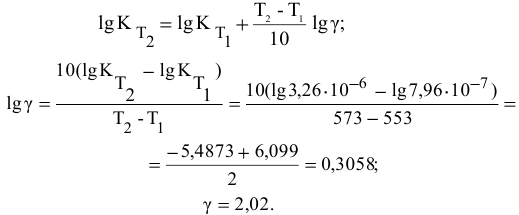
Задача 47
Написать математические выражения констант равновесия следующих реакций:
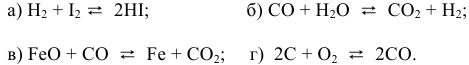
Решение:
а) Для гомогенной реакции 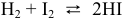
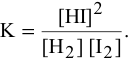
б) Для гетерогенной реакции 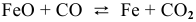
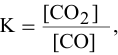
так как концентрации твердых веществ не входят в выражение константы равновесия.
Задача 48
В состоянии равновесия системы 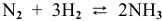 при определенной температуре концентрации участвующих в равновесии веществ следующие:
при определенной температуре концентрации участвующих в равновесии веществ следующие: 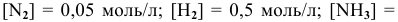 =0,04 моль/л. Рассчитать константу равновесия этой реакции.
=0,04 моль/л. Рассчитать константу равновесия этой реакции.
Решение:
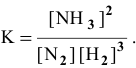
Подставим в выражение константы равновесия значения равновесных концентрации:
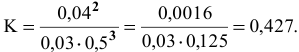
Задача 49
Константа равновесия реакции 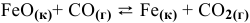 при 1000 °C равна 0,5. Исходные концентрации
при 1000 °C равна 0,5. Исходные концентрации 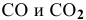 равны соответственно 0,05 моль/л и 0,01 моль/л. Рассчитать их концентрации в состоянии равновесия.
равны соответственно 0,05 моль/л и 0,01 моль/л. Рассчитать их концентрации в состоянии равновесия.
Решение:
Предположим, что в ходе реакции до момента установления состояния химического равновесия концентрация СО уменьшается на X моль/л. Тогда в состоянии химического равновесия концентрации 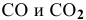 будут следующими:
будут следующими:
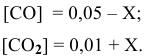
Математическое выражение константы равновесия данной реакции:
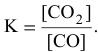
Отсюда находим значение X:
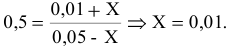
В состоянии равновесия значения концентрации будут следующими:
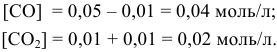
Задача 50
Для реакции 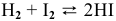 рассчитать константу равновесия в стандартных условиях.
рассчитать константу равновесия в стандартных условиях.
Решение:
Между энергией Гиббса и константой равновесия существует следующая взаимосвязь:
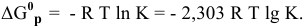
Рассчитываем вначале значение 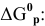
м
Находим значение константы равновесия реакции в стандартных условиях 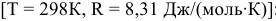 :
:

Задача 51
В каком направлении сместится равновесие следующих химических реакций:

если увеличить температуру?
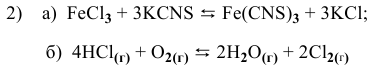
если увеличить концентрацию 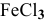 для реакции а и уменьшить концентрацию
для реакции а и уменьшить концентрацию 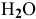 для реакции б?
для реакции б?
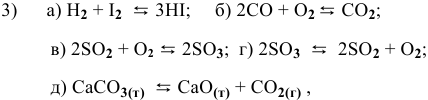
если увеличить давление?
Решение:
Воспользуемся принципом Ле Шателье.
1) Увеличение температуры смещает химическое равновесие в направлении эндотермической реакции, а уменьшение температуры — в направлении экзотермической реакции.
Для реакции 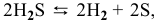 являющейся эндотермической
являющейся эндотермической 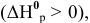 увеличение температуры смещает равновесие в сторону прямой реакции
увеличение температуры смещает равновесие в сторону прямой реакции 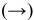 .
.
2) Увеличение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, уменьшающей концентрацию этого вещества.
Уменьшение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, увеличивающей концентрацию этого вещества.
Для реакции 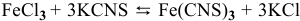 увеличение концентрации
увеличение концентрации 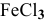 , являющегося реактивом, смещает равновесие в сторону реакции, уменьшающей его концентрацию, т.е. в прямом направлении
, являющегося реактивом, смещает равновесие в сторону реакции, уменьшающей его концентрацию, т.е. в прямом направлении 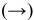 .
.
3) Увеличение давления смещает химическое равновесие в направлении реакции, вызывающей уменьшение объема системы, т.е. в сторону реакции с уменьшением числа газообразных молекул.
Для реакции 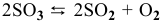 увеличение давления смещает равновесие в сторону обратной реакции
увеличение давления смещает равновесие в сторону обратной реакции  , так как число молекул исходных веществ (2 молекулы
, так как число молекул исходных веществ (2 молекулы 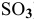 ) меньше, чем число молекул продуктов реакции (2 молекулы
) меньше, чем число молекул продуктов реакции (2 молекулы 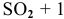 молекула
молекула 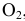 , итого 3 молекулы).
, итого 3 молекулы).
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

