Оглавление:
Химические свойства металлов
Задача 81
Написать уравнения реакций окисления следующих щелочных металлов: 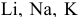 — в атмосфере воздуха при обычной и высокой температурах.
— в атмосфере воздуха при обычной и высокой температурах.
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
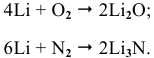
При высоких температурах вместо оксида лития образуется пероксид лития:
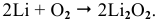
Натрий: а) при обычной температуре —
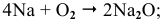
б) при высоких температурах —
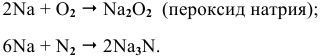
Калий: а) при обычной температуре — 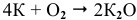 ;
;
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:

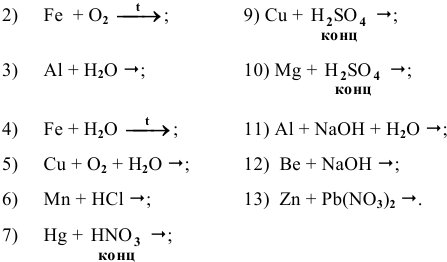
Решение:
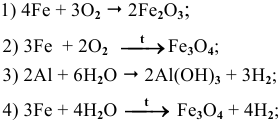
5) Электрохимическая коррозия меди с кислородной деполяризацией:
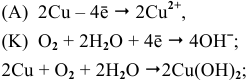

Задача 83
С какими из следующих веществ может реагировать ртуть: 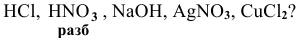
Решение:
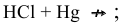
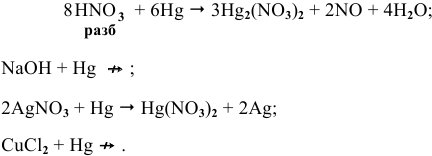
Задача 84
Среди металлов: 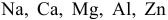 — найти наиболее и наименее сильный восстановитель:
— найти наиболее и наименее сильный восстановитель:
а) в водных средах;
б) в неводных средах.
Решение:
В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала. Для изучаемых металлов величины стандартных электродных потенциалов следующие:
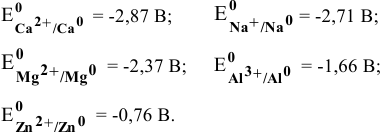
Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
Величины энергий ионизации изучаемых металлов находим в справочнике:
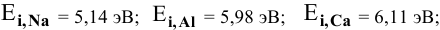
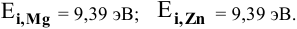
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
Составить и уравнять с помощью электронного баланса ОВ реакции.
Решение:
Ниже приводятся уравнения уже составленных и уравненных реакций:

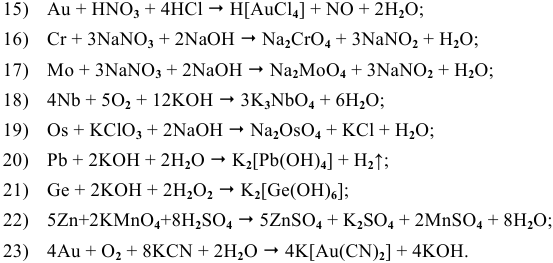
Задача 86
Каким методом может быть получен металлический магний?
Решение:
Магний — это очень активный металл, его электродный потенциал
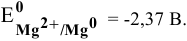
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава 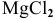 :
:
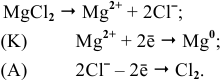
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
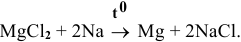
Докажем возможность использования Na:
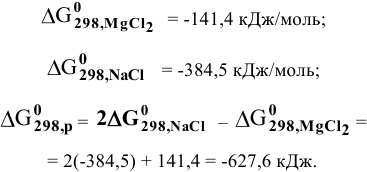
Так как 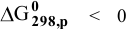 , то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из
, то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из 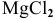 .
.
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
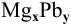 — формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
— формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
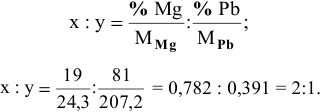
Таким образом, формула интерметаллического соединения — 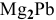 .
.
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной 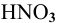 . Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка
. Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка 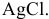 . Масса осадка равна 0,199 г. Каково содержание серебра в монете?
. Масса осадка равна 0,199 г. Каково содержание серебра в монете?
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
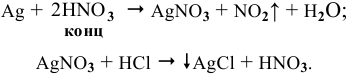
Согласно уравнениям этих двух реакций, 1 моль 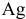 образует 1 моль
образует 1 моль 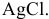 .
.
Рассчитаем массу серебра, соответствующую 0,199 г 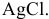 :
:
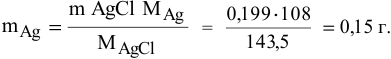
Вычислим процентное содержание серебра в монете:
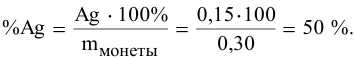
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Задачи с решениями на электролиз растворов |
| Задачи с решениями на коррозию металлов |
| Задачи с решениями на обзор химических свойств d-металлов |
| Задачи с решениями на обзор свойств р-элементов |

