Оглавление:
Задачи повышенной трудности. Электролитическая диссоциация. Буферные растворы. Гидролиз
Задача 136
Рассчитать pH растворов 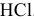 до концентраций С от
до концентраций С от 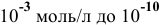 моль/л. Построить диаграмму рН-С.
моль/л. Построить диаграмму рН-С.
Решение:
Условием задачи определены низкие концентрации, при которых степень диссоциации равна 1 или близка к ней. Для значительных концентраций кислоты потребовалось бы учитывать степень диссоциации а. Для концентрации от 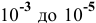 моль/л расчет pH раствора производится следующим образом:
моль/л расчет pH раствора производится следующим образом:
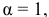
следовательно, 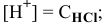
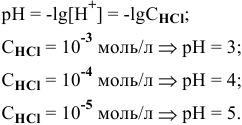
Зависимость pH-С линейная.
Во всех этих случаях не учитывалась концентрация ионов водорода, образованных в результате диссоциации воды, так как она незначительна.
При более низких концентрациях кислоты, когда концентрация ионов водорода, образованных в результате диссоциации кислоты, становится близкой к концентрации ионов водорода, образованных в результате диссоциации воды, необходимо считаться с процессом диссоциации воды:
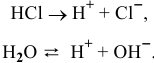
Пусть X — концентрация ионов  ,
,
У — концентрация ионов 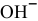 ,
,
тогда 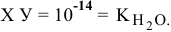
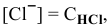 , так как
, так как 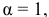 .
.
Так как раствор электронейтрален, то
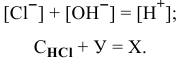
Имеем систему двух уравнений:
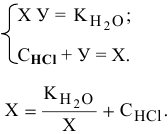
Получаем уравнение II порядка: 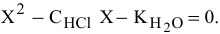 Решаем его, причем, в нашем случае имеет физический смысл положительный корень:
Решаем его, причем, в нашем случае имеет физический смысл положительный корень:
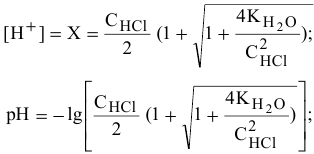
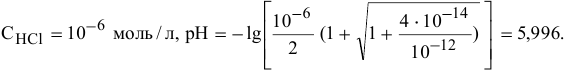
Для концентрации 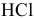 , равной
, равной 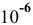 моль/л, диссоциация воды еще незначительно сказывается на значении pH, хотя уже ниже на 0,004 единицы, что свидетельствует о незначительном вкладе концентрацию ионов
моль/л, диссоциация воды еще незначительно сказывается на значении pH, хотя уже ниже на 0,004 единицы, что свидетельствует о незначительном вкладе концентрацию ионов 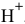 .
.
диссоциации воды, повышающей
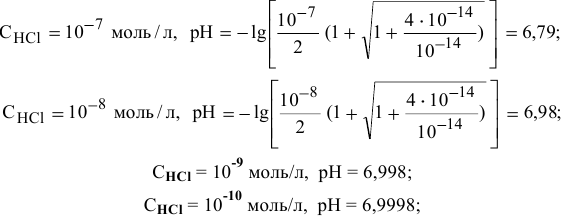
Диаграмма 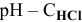 приведена на рис.11.
приведена на рис.11.
Задача 137
Рассчитать pH растворов 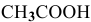 для концентраций С от 1 моль/л до
для концентраций С от 1 моль/л до 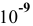 моль/л. Построить диаграмму рН-С.
моль/л. Построить диаграмму рН-С.
Решение:
Условиями задачи определен высший предел концентраций, при котором степень диссоциации уксусной кислоты имеет очень низкую величину:
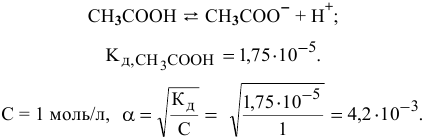
В этом случае пользуемся для расчетов выражением константы диссоциации:
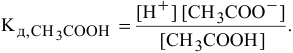
Причем, в связи с малой величиной степени диссоциации доля продиссоциированных молекул из всех имеющихся в растворе молекул ничтожна, поэтому вместо равновесной концентрации в выражении константы диссоциации можно брать исходную концентрацию 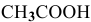 .
.
Так как 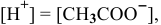 ,
,
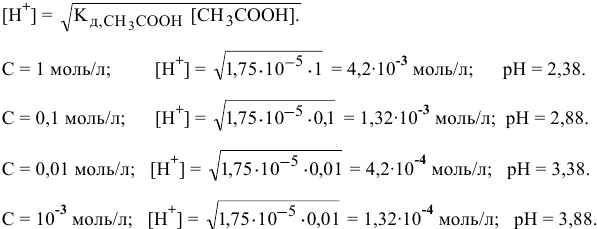
Уже при концентрации 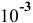 моль/л доля продиссоциированных молекул становится высокой:
моль/л доля продиссоциированных молекул становится высокой:
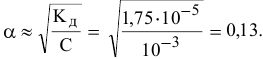
А значит, требуется, начиная с концентрации 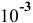 моль/л и ниже, в расчетную формулу подставлять только значения равновесных концентраций:
моль/л и ниже, в расчетную формулу подставлять только значения равновесных концентраций:
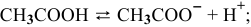
равновесные концентрации: (С-Х) моль/л, X моль/л, X моль/л.
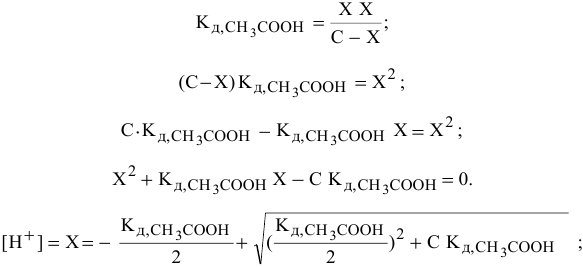

Уже при концентрации уксусной кислоты, равной 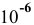 моль/л, степень электролитической диссоциации становится близкой к 1, значит, можно уже производить расчет pH по следующей формуле:
моль/л, степень электролитической диссоциации становится близкой к 1, значит, можно уже производить расчет pH по следующей формуле:
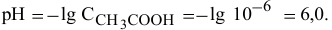
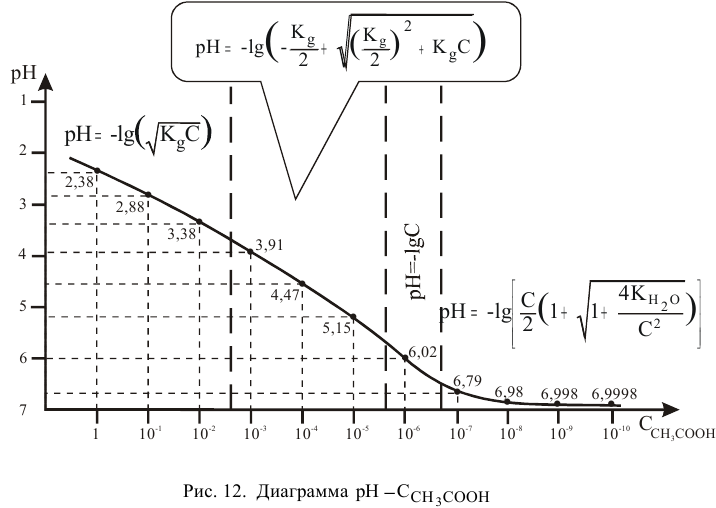
Диаграмма 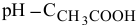 приведена на рис. 12.
приведена на рис. 12.
Но, как это было показано в предыдущей задаче, при концентрациях кислоты 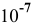 моль/л и ниже необходимо учитывать диссоциацию воды, тогда аналогично раствору
моль/л и ниже необходимо учитывать диссоциацию воды, тогда аналогично раствору 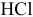 значения pH будут следующие:
значения pH будут следующие:
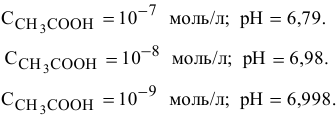
Задача 138
Показать, что раствор  , взятых в эквимолярных количествах, является буферным раствором, pH которого практически не меняется при его разбавлении, а также при добавлении к нему незначительного количества кислоты или щелочи. Рассчитать pH раствора, содержащего 1 моль/л
, взятых в эквимолярных количествах, является буферным раствором, pH которого практически не меняется при его разбавлении, а также при добавлении к нему незначительного количества кислоты или щелочи. Рассчитать pH раствора, содержащего 1 моль/л 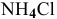 и 1 моль/ л
и 1 моль/ л 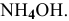 .
.
Решение:
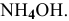 — слабый электролит:
— слабый электролит:

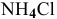 — сильный электролит:
— сильный электролит:
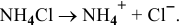
Предположим, что 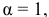 тогда
тогда 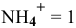 моль/л.
моль/л.
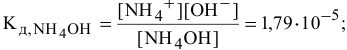
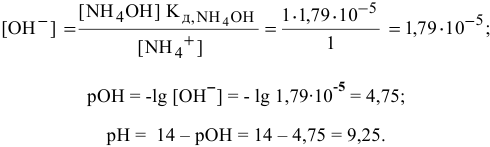
Предположим, что буферный раствор 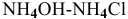 разбавили в 2 раза, тогда:
разбавили в 2 раза, тогда:
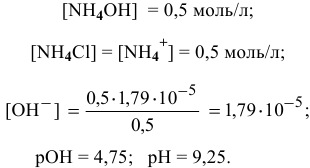
При разбавлении буферного раствора pH не меняется.
Добавим в 1 л буферного раствора 10 мл 1 М раствора 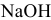 :
:
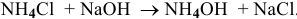
Это приведет к увеличению концентрации 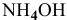 на 0,01 моль/л и уменьшению концентрации
на 0,01 моль/л и уменьшению концентрации 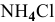 на 0,01 моль/л. Концентрации станут приблизительно следующими:
на 0,01 моль/л. Концентрации станут приблизительно следующими:
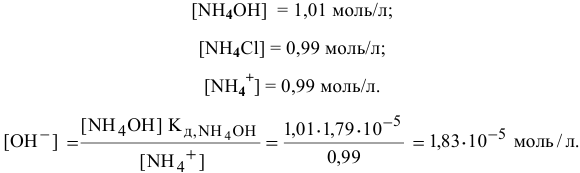
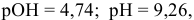
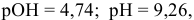 т.е. практически не изменился.
т.е. практически не изменился.
Можно показать, что добавление 10 мл щелочи в 1 л воды изменит pH с 7 приблизительно до 12.
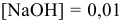 моль/л (не учитывая увеличения объема при добавлении к 1 л 10 мл);
моль/л (не учитывая увеличения объема при добавлении к 1 л 10 мл);
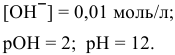
Добавим в 1 л буферного раствора 10 мл 1 М раствора 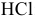 :
:
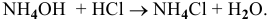
Это приведет к увеличению концентрации 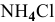 на 0,01 моль/л и уменьшению концентрации
на 0,01 моль/л и уменьшению концентрации 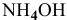 на 0,01 моль/л. Концентрации станут приблизительно следующими:
на 0,01 моль/л. Концентрации станут приблизительно следующими:
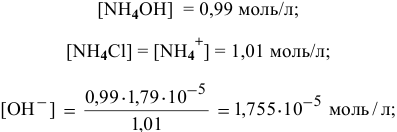
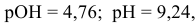 , т.е. практически не изменился.
, т.е. практически не изменился.
Задача 546.46
Подобрать наиболее подходящий индикатор для реакции нейтрализации 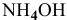 сильной кислотой.
сильной кислотой.
Решение:
Необходимо построить кривую титрования, т.е. установить зависимость pH от количества кислоты, добавленной для нейтрализации 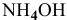 . Концентрация может быть выражена в процентах от всего количества кислоты, необходимой для полной нейтрализации
. Концентрация может быть выражена в процентах от всего количества кислоты, необходимой для полной нейтрализации 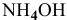 ,
,
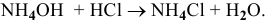
Найдем некоторые точки на кривой. Предположим, что исходный раствор 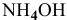 0,1 молярный и что при нейтрализации
0,1 молярный и что при нейтрализации 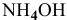 кислотой объем не меняется.
кислотой объем не меняется.
Точка 1. Исходный раствор 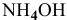
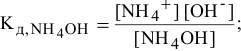
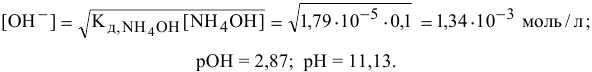
Точка 2. Добавлено 10 % НС1 от всего количества для полной нейтрализации, это приводит к следующему:

Точка 3. Добавлено 20 %  :
:
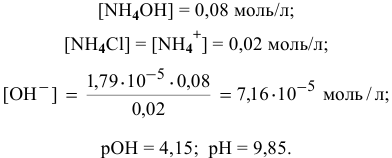
Точка 4. Добавлено 30 % 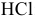 :
:
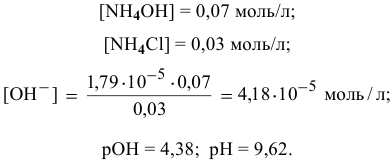
Точка 5. Добавлено 40 % 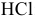 :
:
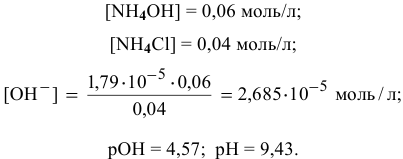
Точка 6. Добавлено 50 % 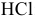 :
:
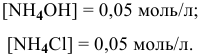
В предыдущей задаче расчет pH буферного раствора 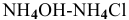 с эквимолярными количествами
с эквимолярными количествами 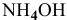 и
и 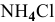 дал следующий результат:
дал следующий результат:
pH = 9,25.
Точка 7. Добавлено 60 % 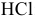 :
:
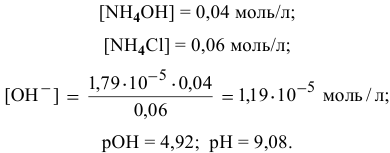
Точка 8. Добавлено 70 % 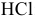 :
:
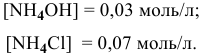
В данном случае концентрация 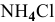 становится высокой, поэтому необходимо учитывать гидролиз соли
становится высокой, поэтому необходимо учитывать гидролиз соли 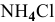 , образованной сильной кислотой и слабым основанием:
, образованной сильной кислотой и слабым основанием:
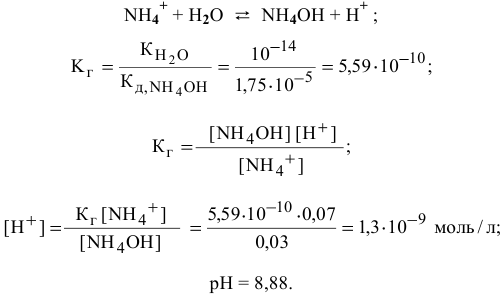
Точка 9. Добавлено 80 % 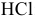 :
:
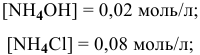
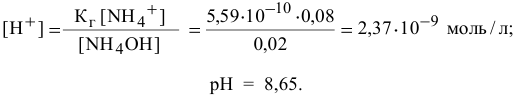
Точка 10. Добавлено 90 % 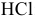 :
:
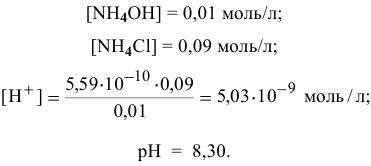
Точка 11. Добавлено 99 % 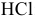 :
:
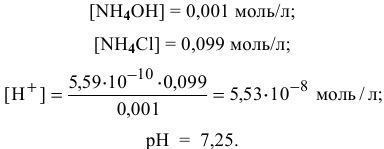
Точка 12. Добавлено 100 % 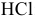 :
:
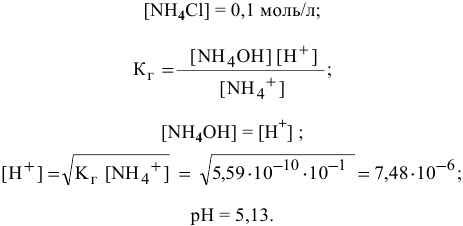
Точка 13. Добавлено 101 % 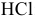 :
:
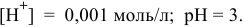
Точка 14. Добавлено 110 % 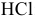 :
:
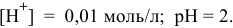
Кривая титрования показана на рис. 13.
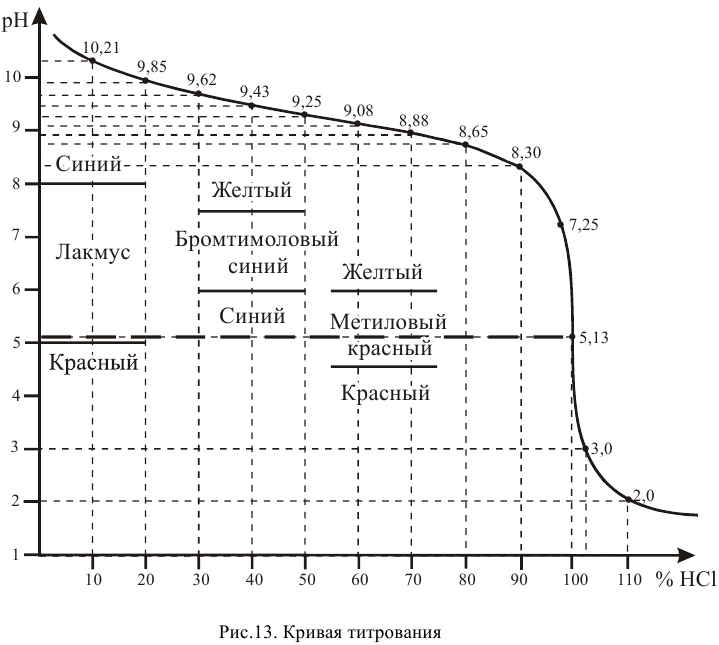
Эквивалентная точка нейтрализации при pH = 5,13.
Для того, чтобы была максимальная точность при нейтрализации, необходимо подобрать такой индикатор, у которого переход окраски происходит при pH порядка 5.
В таблице индикаторов находим наиболее подходящие индикаторы:
лакмус — pH интервала перехода окраски 5,0…8,0;
бромтимоловый синий — pH интервала перехода окраски 6,0…7,6;
метиловый красный — pH интервала перехода окраски 4,4…6,2.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Задачи по элементам аналитической химии |
| Задачи по элементам органической химии |
| Задачи с решениями на произведение растворимости |
| Задачи с решениями на окислительно-восстановительные процессы |

