Оглавление:
Элементы аналитической химии
Пример 126
Как приготовить 0,5 л 10 %-ного раствора азотной кислоты (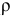 = 1,056 г/мл) из 40 %-ного раствора
= 1,056 г/мл) из 40 %-ного раствора 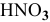 (
(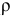 = 1,25 г/мл).
= 1,25 г/мл).
Решение:
По формуле
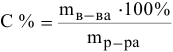
определим массу 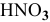 в 0,5 л 10 %-ного раствора:
в 0,5 л 10 %-ного раствора:
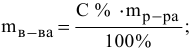
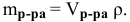
Подставив значения С %, 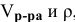 , получим: 10%0,5-103 мл • 1,056 г/мл „
, получим: 10%0,5-103 мл • 1,056 г/мл „
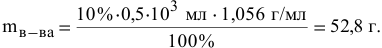
Определяем по той же формуле, в каком объеме 40 %-ного раствора будет содержаться 52,8 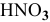 г :
г :
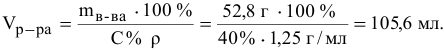
При помощи мерного цилиндра или бюретки отмеряем 105,6 мл 40 %-ного раствора азотной кислоты и разбавляем до 500 мл дистиллированной водой.
Пример 127
Приготовить 2 л 0,1 н раствора серной кислоты исходя из 98%-ного раствора 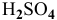 (р = 1,84 г/мл).
(р = 1,84 г/мл).
Решение:
По формуле расчета нормальной концентрации раствора определяем значение массы 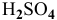 , содержащейся в 2 л 0,1 н раствора:
, содержащейся в 2 л 0,1 н раствора:
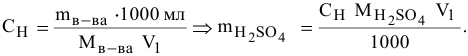
Подставляем значение массы 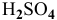 в формулу для расчета процентной концентрации, введя индекс
в формулу для расчета процентной концентрации, введя индекс 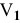 0,1 н раствора и
0,1 н раствора и 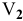 — для 98 %-ного раствора:
— для 98 %-ного раствора:
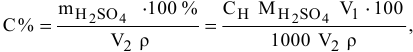
отсюда
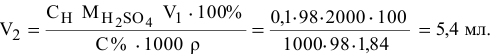
Задача № 2. Определить pH раствора вещества, используемого для анализа.
Пример 128
Найти pH 0,1 М раствора уксусной кислоты.
Решение:
Уксусная кислота диссоциирует по схеме:
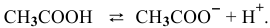
Константа равновесия этого процесса равна 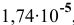 , следовательно, уксусная кислота — слабый электролит. Концентрация ионов водорода определяется по формуле
, следовательно, уксусная кислота — слабый электролит. Концентрация ионов водорода определяется по формуле 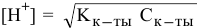 [см.раздел 9, задача № 6]. А так как
[см.раздел 9, задача № 6]. А так как 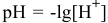 , то, подставив значение
, то, подставив значение 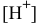 , получим формулу для расчета водородного показателя:
, получим формулу для расчета водородного показателя:
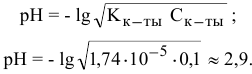
Пример 129
Определить pH 0,01 н раствора 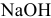 .
.
Решение:
Так как едкий натр — сильный электролит, происходит полный распад его на ионы. Из одного моль 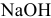 образуется один моль ионов
образуется один моль ионов 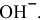 :
:
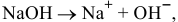
тогда из 0,01 моль 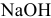 образуется 0,01 моль
образуется 0,01 моль 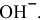 . Следовательно, [
. Следовательно, [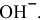 ] =
] = 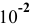 моль/л, а согласно ионному произведению воды
моль/л, а согласно ионному произведению воды
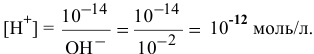
Водородный показатель данного раствора равен: 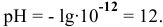
Среда щелочная.
Пример 130
Выпадает ли осадок 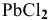 при смешивании равных объемов 0,1 М растворов
при смешивании равных объемов 0,1 М растворов 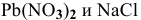 ?
?
Решение:
Согласно одному из правил произведения растворимости осадок малорастворимого электролита образуется лишь в том случае, если произведение концентраций его ионов в растворе превышает его произведение растворимости (ПР) при данной температуре.
Вначале определим концентрации ионов 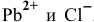 . После смешивания равных объемов концентрация каждого из веществ уменьшится вдвое по сравнению с исходным раствором:
. После смешивания равных объемов концентрация каждого из веществ уменьшится вдвое по сравнению с исходным раствором: 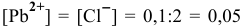 моль/л. Вычислим произведение концентраций ионов, присутствующих в растворе:
моль/л. Вычислим произведение концентраций ионов, присутствующих в растворе:
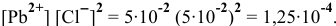
Полученное произведение концентраций ионов меньше, чем 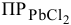 =
=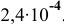 .
.
Следовательно, раствор не насыщен и осадок выпадать не будет.
Пример 131
Образуется ли осадок 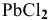 при смешении равных объемов 0,1 М раствора
при смешении равных объемов 0,1 М раствора 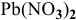 и 1 М раствора
и 1 М раствора 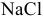 ?
?
Решение:
После смешения концентрация каждого вещества уменьшается вдвое:
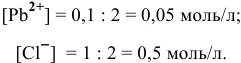
Находим ионное произведение для 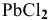 :
:
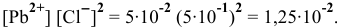
Так как 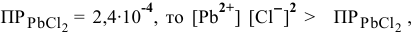 , следовательно, раствор пересыщен и осадок выпадает.
, следовательно, раствор пересыщен и осадок выпадает.
Пример 132
Как перевести в раствор: а) ион 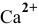 из осадка
из осадка 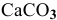 ; б) ион
; б) ион 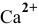 из осадка
из осадка 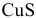 ; в) ионы
; в) ионы 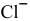 из осадка
из осадка 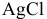 ?
?
Решение:
Согласно второму правилу произведения растворимости осадок растворяется в тех случаях, когда в растворе над осадком произведение концентраций свободных ионов становится меньше соответствующего произведения растворимости.
а) Выразим 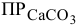 через произведение концентраций ионов:
через произведение концентраций ионов:
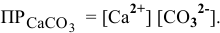
Чтобы связать ион 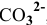 , можно приливать к осадку раствор сильной кислоты:
, можно приливать к осадку раствор сильной кислоты:
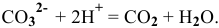
Образующийся диоксид углерода удаляется из сферы реакции. Так как величина ПР постоянна, то концентрация иона 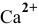 в растворе над осадком будет все время увеличиваться до тех пор, пока не разрушатся все ионы
в растворе над осадком будет все время увеличиваться до тех пор, пока не разрушатся все ионы 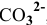 , а осадок
, а осадок 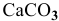 перейдет в раствор.
перейдет в раствор.
б) Сульфиды металлов, не растворимые ни в воде, ни в минеральных кислотах, растворяются за счет окислительно-восстановительных реакций. Так, для растворения осадка 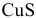 для которого
для которого 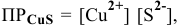 , необходимо окислить
, необходимо окислить 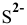 до элементарной серы, не растворимой в воде и поэтому выходящей из сферы реакции. С уменьшением концентрации
до элементарной серы, не растворимой в воде и поэтому выходящей из сферы реакции. С уменьшением концентрации 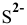 будет повышаться концентрация ионов
будет повышаться концентрация ионов 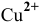 до тех пор, пока осадок растворится. Одной из окислительно-восстановительных реакций может быть окисление перманганатом в кислой среде:
до тех пор, пока осадок растворится. Одной из окислительно-восстановительных реакций может быть окисление перманганатом в кислой среде:
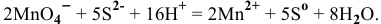
в) Для переведения осадка AgCl в раствор уменьшения произведения концентрации 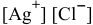 добиваются путем комплексообразования:
добиваются путем комплексообразования:
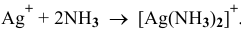
Таким образом, выпавший осадок переходит в раствор, но не в виде исходных ионов, а в виде комплексных ионов.
Задача № 4. Определить концентрацию раствора, на титрование которого пошел определенный объем раствора известной концентрации.
Пример 133
Определить концентрацию и титр раствора серной кислоты, если на нейтрализацию 11,25 мл ее израсходовано 10,00 мл 0,1234 н раствора едкого натра.
Решение:
Для вычисления нормальной концентрации раствора кислоты используем равенство
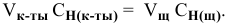
Отсюда
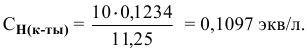
По нормальности можно определить титр раствора 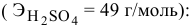
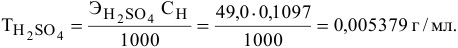
Пример 134
Навеска 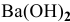 растворена в мерной колбе емкостью 250 мл, раствор разбавлен до метки водой. На титрование 20,00 мл полученного раствора израсходовано 22,40 мл 0,09884 н раствора
растворена в мерной колбе емкостью 250 мл, раствор разбавлен до метки водой. На титрование 20,00 мл полученного раствора израсходовано 22,40 мл 0,09884 н раствора 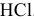 . Определить массу
. Определить массу 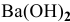 в навеске.
в навеске.
Решение:
Аналогично предыдущему примеру вначале определяем нормальность раствора 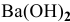 :
:
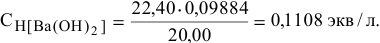
По нормальности находим титр раствора 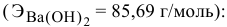
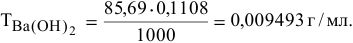
В 250 мл такого раствора содержится 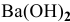 :
:
Задача № 5.
Указать наиболее специфичные качественные реакции для открытия следующих ионов из растворов: 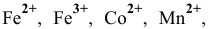
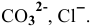
Решение:
1) Ионы 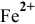 с раствором гексацианоферрат(Ш) калия в солянокислой среде образуют осадок турнбулевой сини:
с раствором гексацианоферрат(Ш) калия в солянокислой среде образуют осадок турнбулевой сини:
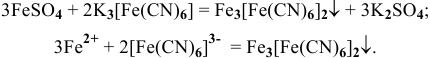
2) Частной реакцией на ионы 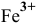 является реакция взаимодействия с раствором гексацианоферрата калия (II) в кислой среде, сопровождающаяся образованием темно-синего осадка «берлинской лазури»:
является реакция взаимодействия с раствором гексацианоферрата калия (II) в кислой среде, сопровождающаяся образованием темно-синего осадка «берлинской лазури»:
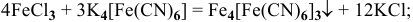
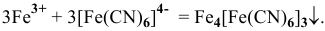
3) Для открытия ионов 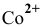 к раствору приливают насыщенный раствор роданида аммония и несколько капель изоамилового спирта. После взбалтывания слой изоамилового спирта окрашивается в синий цвет вследствие образования комплексного соединения:
к раствору приливают насыщенный раствор роданида аммония и несколько капель изоамилового спирта. После взбалтывания слой изоамилового спирта окрашивается в синий цвет вследствие образования комплексного соединения:
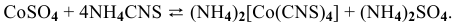
4) Ионы 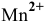 при нагревании с порошком диоксида свинца в присутствии концентрированной азотной кислоты дают малиново-красную окраску за счет образования марганцевой кислоты:
при нагревании с порошком диоксида свинца в присутствии концентрированной азотной кислоты дают малиново-красную окраску за счет образования марганцевой кислоты:
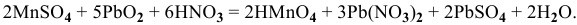
5) При добавлении к раствору, содержащему анионы 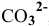 , раствора сильной кислоты наблюдается выделение пузырьков бесцветного газа
, раствора сильной кислоты наблюдается выделение пузырьков бесцветного газа 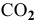 :
:
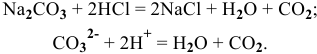
6) Реактивом на ионы 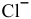 является раствор нитрата серебра, дающий с ионами
является раствор нитрата серебра, дающий с ионами 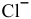 белый аморфный осадок хлорида серебра:
белый аморфный осадок хлорида серебра:
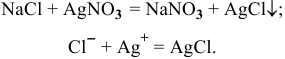
При добавлении к осадку водного раствора аммиака происходит его растворение за счет комплексообразования:
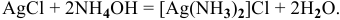
При последующем подкислении исследуемого раствора азотной кислотой комплекс разрушается и снова выпадает белый осадок:
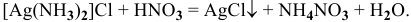
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

