Пример №1-5.
Часто примером задач, для решения которых применяется понятие молярной массы эквивалента, является задача о растворении металла в кислоте. Проанализируем эту ситуацию более детально, выбрав в качестве исходных реагентов неизвестный металл и соляную кислоту (выбор соляной кислоты в качестве исходного реагента не является принципиальным — все кислоты могут быть представлены единой формулой — 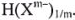
В общем виде эта реакция может быть записана в виде:
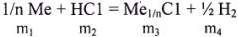
где  — массы соответствующих исходных веществ и продуктов реакции.
— массы соответствующих исходных веществ и продуктов реакции.
Очевидно, что задача о растворении металла в кислоте имеет различные формулировки в зависимости от выбранных исходных данных. Приведем тексты всех возможных вариантов.
а) 9,81 г неизвестного металла Me растворено в соляной кислоте. При этом израсходовано 10,95 г 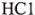 (в пересчете на 100 % кислоту). Определите неизвестный металл Me (даны т, и т2).
(в пересчете на 100 % кислоту). Определите неизвестный металл Me (даны т, и т2).
б) 9,81 г неизвестного металла Me растворено в соляной кислоте. При этом образовалось 20,46 г хлорида этого металла. Определите неизвестный металл Me (даны  ).
).
в) 9,81 г неизвестного металла Me растворено в соляной кислоте. При этом выделилось 3,36 л газа (при нормальных условиях — н. у.). Определите неизвестный металл Me (даны 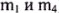 ).
).
г) При растворении образца неизвестного металла Me было израсходовано 10,95 г 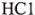 (в пересчете на 100% кислоту). При этом образовалось 20,46 г хлорида металла Me. Определите неизвестный металл Me (даны
(в пересчете на 100% кислоту). При этом образовалось 20,46 г хлорида металла Me. Определите неизвестный металл Me (даны 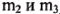 ).
).
д) При растворении образца неизвестного металла Me образовалось 20,46 г хлорида металла Me и выделилось 3,36 л газа (н. у.). Определите неизвестный металл Me (даны 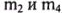 ).
).
Решение:
а) В соответствии с уравнением реакции Э(Ме) взаимодействует с Э(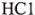 ) = 36,5 г/моль. По условию задачи
) = 36,5 г/моль. По условию задачи 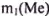 = 9,81 г реагирует с
= 9,81 г реагирует с  = 10,95 г. Это позволяет составить пропорцию:
= 10,95 г. Это позволяет составить пропорцию:
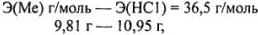
решая которую находим Э(Ме) = 32,7 г/моль.
Анализ приводит к единственному решению 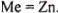
Этот пример взят со страницы решения задач по химии с примерами:
Возможно эти примеры вам будут полезны:

