Оглавление:
Вычисление равновесных концентраций по величине константы
Пример 5.15.
Вычислить равновесные концентрации частиц в растворе, содержащем 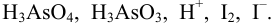 Считать, что
Считать, что 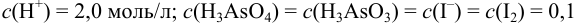 моль/л.
моль/л.
(Ионную силу не учитывать).
Решение:
В растворе присутствуют две пары: 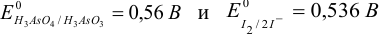 / Их сравнение позволяет предположить реакцию
/ Их сравнение позволяет предположить реакцию
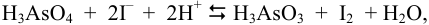
для которой 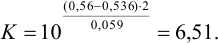
Величина  , реакция протекает в прямом направлении, причем дополнительное смещение равновесия происходит из-за избытка (по условию) ионов И’ по отношению к стехиометрическому. Для расчета равновесных концентраций необходимо воспользоваться выражением константы равновесия через равновесные концентрации:
, реакция протекает в прямом направлении, причем дополнительное смещение равновесия происходит из-за избытка (по условию) ионов И’ по отношению к стехиометрическому. Для расчета равновесных концентраций необходимо воспользоваться выражением константы равновесия через равновесные концентрации:
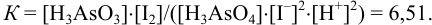
Обозначим исходные и равновесные концентрации (в недостатке  ).
).
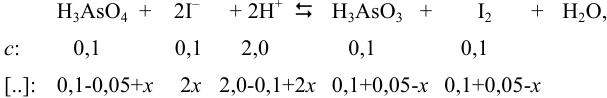
Подставляя в выражение для константы равновесия обозначенные равновесные концентрации, получаем:
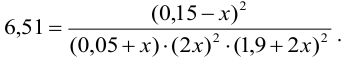
Решая уравнение методом подстановки, находим 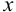 = 0,038.
= 0,038.
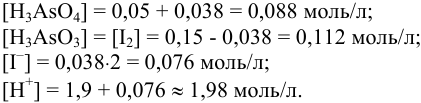
Пример 5.16.*
Вычислить равновесные концентрации ионов 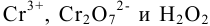 в растворе, содержащем 0,2 моль
в растворе, содержащем 0,2 моль 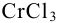 и 0,3 моль
и 0,3 моль 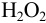 в 1 литре, считая, что pH поддерживается равным 1.
в 1 литре, считая, что pH поддерживается равным 1.
Решение:
Рассматривая полуреакции и 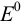 :
:
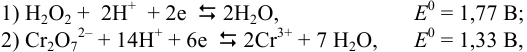
предполагаем протекание реакции 3 ) — окисления ионов хрома (III). Константа равновесия этой реакции (n = 6):
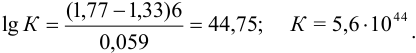
Обозначим исходные и равновесные концентрации для участников реакции:
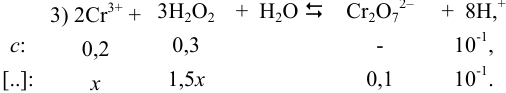
Подставляем соответствующие величины в выражение для К и находим равновесные концентрации:
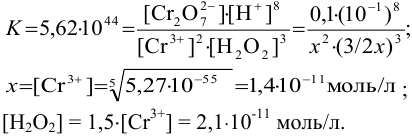
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

