Оглавление:
Вычисление растворимости веществ в окислительно-восстановительной реакции
Пример 5.17.
Вычислить растворимость железа (г/л) в 0,500 М уксусной кислоте.
Решение.
Сравнение стандартных потенциалов пар 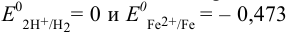 , а также вычисленная по ступенчатым константам общая константа равновесия:
, а также вычисленная по ступенчатым константам общая константа равновесия:
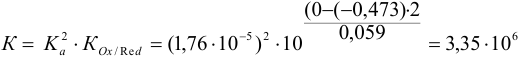
указывают на протекание прямой реакции:
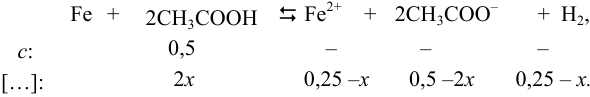
С учетом высокого значения 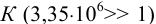 , предполагается низкое значение
, предполагается низкое значение 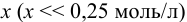 .
.
Растворимость 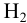 при 25°С составляет
при 25°С составляет 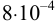 моль/л, поэтому в выражение константы подставляем эту величину равновесной концентрации
моль/л, поэтому в выражение константы подставляем эту величину равновесной концентрации 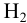 , а не завышенное значение 0,25 моль/л.
, а не завышенное значение 0,25 моль/л.
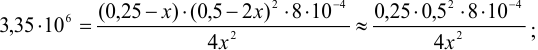
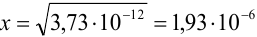 (действительно,
(действительно, 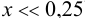 ). Растворимость железа равна 0,25 моль/л или 0,25-56 = 14 г/л.
). Растворимость железа равна 0,25 моль/л или 0,25-56 = 14 г/л.
Пример 5.18.
Вычислить растворимость сульфида никеля в 2М 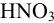 .
.
Решение:
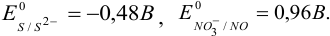
Реакцию растворения 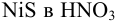 (реакция 3) можно представить как сумму двух процессов:
(реакция 3) можно представить как сумму двух процессов:
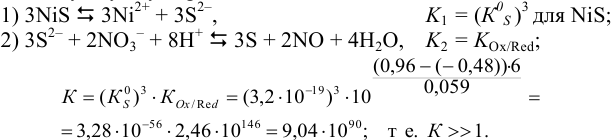
Введем обозначения исходных и равновесных концентраций частиц в растворе. Сравнение стехиометрических соотношений ионов 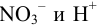 и их исходных концентраций показывает, что ионы
и их исходных концентраций показывает, что ионы 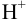 взяты в недостатке. Поэтому, с учетом стехиометрических соотношений, выразим убыль концентрации взятых частиц (ионов кислоты) и добавление продуктов реакции через исходную концентрацию ионов
взяты в недостатке. Поэтому, с учетом стехиометрических соотношений, выразим убыль концентрации взятых частиц (ионов кислоты) и добавление продуктов реакции через исходную концентрацию ионов 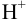 . За
. За 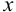 обозначим концентрацию одной частицы, расходующейся или образующейся вследствие частичной обратимости реакции (для общего случая взаимодействия). Учитывая, что растворимость NO при
обозначим концентрацию одной частицы, расходующейся или образующейся вследствие частичной обратимости реакции (для общего случая взаимодействия). Учитывая, что растворимость NO при 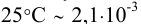 моль/л, что меньше его концентрации 0,5 моль/л (4/8), способной образоваться по данной реакции (из-за необратимости реакции х мало), в расчетах используем именно величину растворимости
моль/л, что меньше его концентрации 0,5 моль/л (4/8), способной образоваться по данной реакции (из-за необратимости реакции х мало), в расчетах используем именно величину растворимости 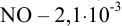 моль/л.
моль/л.
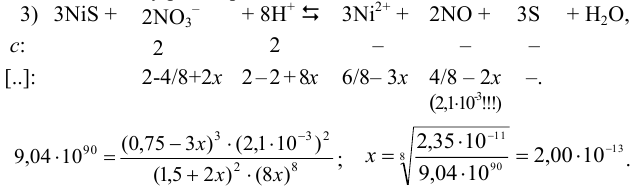
Следовательно, растворимость 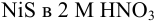 составляет:
составляет:
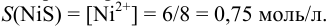
Для данной реакции, протекающей необратимо, расчет можно было провести сразу по концентрации компонента, взятого в недостатке. Подробная же запись для вычисления х сделана, чтобы показать, как провести такой расчет в любом случае с 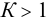 .
.
Пример 5.19.*
Вычислить растворимость 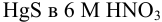 .
.
Решение:
Для уравнения реакции:
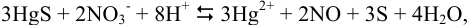
рассуждая как в примере 5.16 с той же 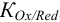 , получаем существенное отличие в величине общей константы равновесия из-за различия в величинах
, получаем существенное отличие в величине общей константы равновесия из-за различия в величинах 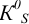 для
для 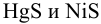 .
.
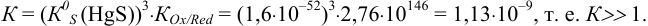
В этом случае за х обозначим концентрацию одной образующейся частицы в ходе реакции с 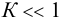 . Равновесные концентрации ионов в левой части уравнения выразим как разности исходных и образующихся, с учетом стехиометрических коэффициентов:
. Равновесные концентрации ионов в левой части уравнения выразим как разности исходных и образующихся, с учетом стехиометрических коэффициентов:
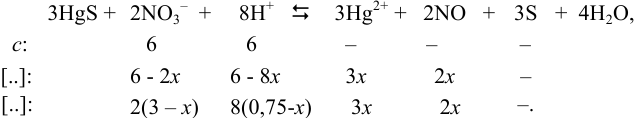
Подставляем равновесные концентрации в выражение для константы и решаем уравнение:
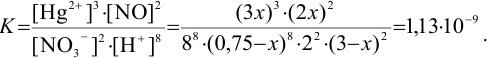
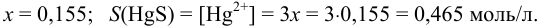
При этом 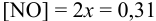 моль/л, что больше
моль/л, что больше 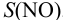 , составляющей 2,1-10 3 моль/л. Следовательно, расчет необходимо повторить с
, составляющей 2,1-10 3 моль/л. Следовательно, расчет необходимо повторить с 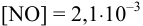 моль/л (справочные данные по растворимости NO):
моль/л (справочные данные по растворимости NO):
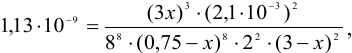
откуда: 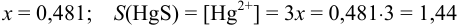 .
.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

