Оглавление:
Влияние образования малорастворимых соединений на потенциал
Пусть окисленная форма образует осадок с анионом А:
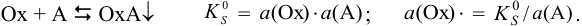
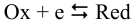 и полная полуреакция:
и полная полуреакция: 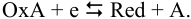
После подстановки и преобразования получаем уравнение Нериста вида: 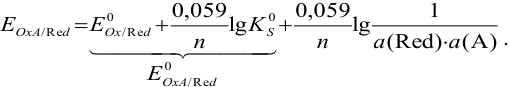
Аналогично, если восстановленная форма малорастворима:
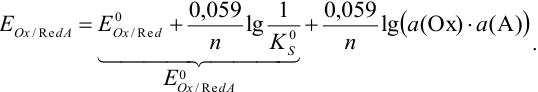
Пример 5.10.
Как изменится потенциал пары 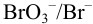 , если в раствор ввести
, если в раствор ввести 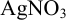 ? Ионную силу не учитывать.
? Ионную силу не учитывать.
Решение:
В этом случае в осадок связывается восстановленная форма по реакции :

Для полуреакции 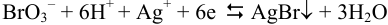 уравнение Нернста имеет вид уравнения (5.9).
уравнение Нернста имеет вид уравнения (5.9).
С учетом 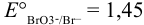 В вычисляем
В вычисляем 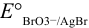 :
:
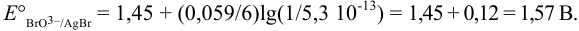
Следовательно, окислительно-восстановительный потенциал пары увеличивается при связывании в малорастворимое соединение восстановленной формы, при этом возрастает сила окислителя.
Пример 5.11.
Определите 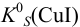 , если известны потенциалы изр:
, если известны потенциалы изр: 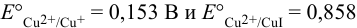 В.
В.
Решение:
По условию очевидно, что восстановленная форма первой пары образует малорастворимое соединение 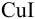 . Используя формулу (5.10), рассчитываем
. Используя формулу (5.10), рассчитываем 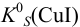 :
:
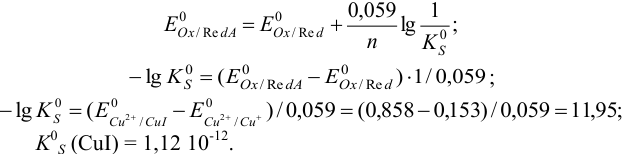
Пример 5.12.*
К 10,0 мл 0,010 M раствора 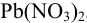 , содержащего также
, содержащего также 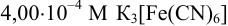 , добавили некоторый объем 0,0340 М раствора
, добавили некоторый объем 0,0340 М раствора 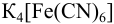 . Количество добавленного
. Количество добавленного 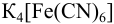 меньше стехиометрического в реакции взаимодействия с ионами свинца. Потенциал платинового электрода, погруженного в полученный раствор, равен 0,705 В (по отношению к с.в.э.). Вычислите а) равновесную концентрацию ионов
меньше стехиометрического в реакции взаимодействия с ионами свинца. Потенциал платинового электрода, погруженного в полученный раствор, равен 0,705 В (по отношению к с.в.э.). Вычислите а) равновесную концентрацию ионов 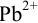 в полученном растворе (с учетом ионной силы, соответствующей 0,1 М
в полученном растворе (с учетом ионной силы, соответствующей 0,1 М 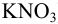 );
);
б) величину потенциала платинового электрода в растворе при стехиометрическом количестве добавленного 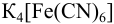 .
.
Для справки: 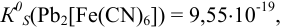
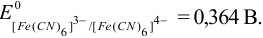
Решение:
Реакция взаимодействия:
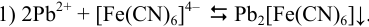
Вычисленные по уравнению 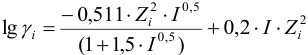
коэффициенты активности составляют: 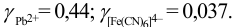
Равновесный потенциал платинового электрода для полуреакции:
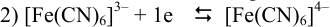
определяется по уравнению Нернста вида:
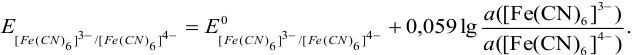
а) при количестве 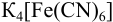 , меньшем стехиометрического по реакции осаждения 1), в растворе остаются ионы
, меньшем стехиометрического по реакции осаждения 1), в растворе остаются ионы 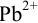 , в присутствии которых:
, в присутствии которых:
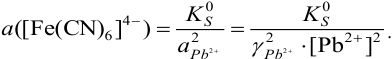
То есть в присутствии ионов  равновесный потенциал платинового электрода фактически определяется полуреакцией:
равновесный потенциал платинового электрода фактически определяется полуреакцией:
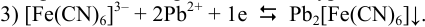
После подстановки в уравнение Нернста выражения для  получаем уравнение вида (5.10). Решаем его, подставляя имеющиеся данные:
получаем уравнение вида (5.10). Решаем его, подставляя имеющиеся данные:
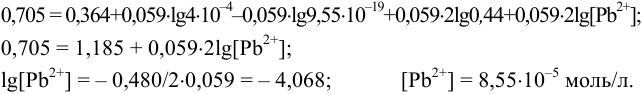
б) при стехиометрическом количестве добавленного осадителя в реакции 1) концентрация [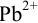 ] будет определяться растворимостью
] будет определяться растворимостью 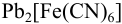 :
:
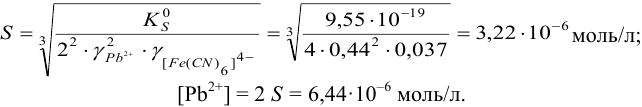
Тогда равновесный потенциал платинового редокс-электрода будет равен:
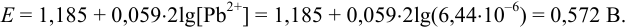
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

