Оглавление:
Влияние конкурирующих реакций на растворимость
Ионы осадка могут вступать в реакции с компонентами раствора. Общая растворимость осадка в этих случаях складывается из всех форм, которые образует катион и анион. Наибольшее практическое значение имеет учет влияния комплексообразования катиона и протонирования аниона слабой кислоты, входящих в состав малорастворимого электролита.
Если pH при растворении создается и поддерживается буферным раствором, то предварительно следует вычислить 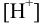 соответственно конкретным условиям, а затем рассчитывать молярную долю свободных ионов и проводить расчет растворимости по выражению (6.3).
соответственно конкретным условиям, а затем рассчитывать молярную долю свободных ионов и проводить расчет растворимости по выражению (6.3).
Однако для малорастворимых электролитов, способных растворяться в кислотах или основаниях определенной концентрации, расходующихся в ходе реакции растворения, расчет растворимости следует проводить по общей константе равновесия реакции растворения (примеры 6.16-6.17; см. также главы 2 и 5, примеры 5.15-5.17).
При растворении осадков в воде в ряде случаев следует рассматривать в качестве конкурирующих реакции гидролиза, которые для катиона могут сопровождаться образованием гидроксоком-плексов, а для аниона слабой кислоты — протонированием. В этом случае в практических расчетах принимают следующее основное допущение: при низкой растворимости соли (низкой концентрации гидролизующихся частиц) среда раствора определяется диссоциацией воды и близка к нейтральной, т.е. 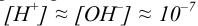 моль/л (пример 6.18).
моль/л (пример 6.18).
Обычно при наличии конкурирующих реакций не учитывают влияние ионной силы (глава 2, раздел 2.2).
Пример 6.14.
Рассчитать растворимость 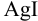 в 1,0 М растворе аммиака.
в 1,0 М растворе аммиака.
Решение:
В насыщенном растворе 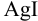 в присутствии
в присутствии  , наряду с основной реакцией:
, наряду с основной реакцией:

протекают конкурирующие реакции 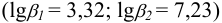 :
:
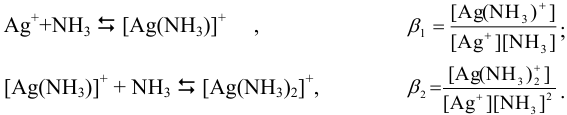
Растворимость 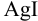 определяется общей концентрацией ионов серебра в растворе:
определяется общей концентрацией ионов серебра в растворе:
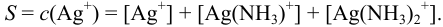
По формуле (2.8) (см. пример 2.6) вычисляем молярную долю ионов 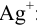 :
:
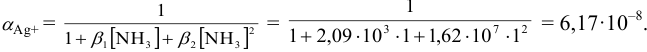
Пренебрегая ионной силой, по формуле (6.3) 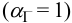 вычисляем
вычисляем 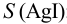 :
:
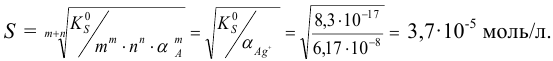
Проведенные расчеты показывают, что связывание катиона в растворе в комплекс приводит к повышению растворимости малорастворимого электролита.
Пример 6.15.
Рассчитать растворимость 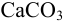 при pH 5,0.
при pH 5,0.
Решение:
В данном примере pH задано в явном виде, причем подразумевается поддерживание pH буферным раствором.
В растворе 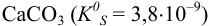 наряду с основной реакцией
наряду с основной реакцией
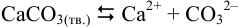
протекают побочные реакции связывания ионов 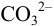 ионами водорода в
ионами водорода в 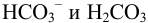 (разд. 2.2). Молярную долю
(разд. 2.2). Молярную долю 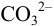 находим по выражению (2.5):
находим по выражению (2.5):
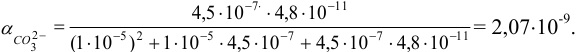
Растворимость вычисляем по формуле (6.3) при 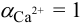 :
:
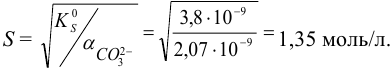
Протонирование аниона слабой кислоты повышает растворимость подобных малорастворимых электролитов.
Пример 6.16.
Вычислите массу 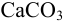 , способного раствориться в 50 мл 2,0 М уксусной кислоты.
, способного раствориться в 50 мл 2,0 М уксусной кислоты.
Решение:
В данном примере pH в ходе растворения не задано в явном виде и не поддерживается постоянным из-за расхода 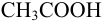 :
:
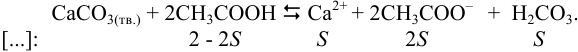
Общая константа равновесия реакции (см. раздел 2.3, пример 2.7(б)): 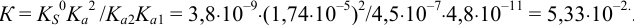
. Подставляем в выражение константы реакции равновесные концентрации и находим растворимость S, решая квадратное уравнение:
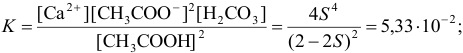
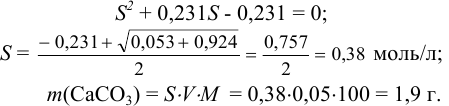
Подобным образом рассчитывается растворимость малорастворимых гидроксидов в кислотах. Обратной задачей является нахождение концентрации кислоты в растворе для растворения определенного количества осадка (пример 6.17).
Пример 6.17.
Какую концентрацию муравьиной кислоты следует создать в растворе, чтобы в 100 мл растворилось 0,2137 г 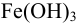 ?
?
Решение:
Растворение 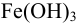 в муравьиной кислоте приводит к образованию ионов
в муравьиной кислоте приводит к образованию ионов 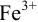 в растворе. По их концентрации можно судить о растворимости
в растворе. По их концентрации можно судить о растворимости 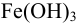 в указанных условиях:
в указанных условиях:
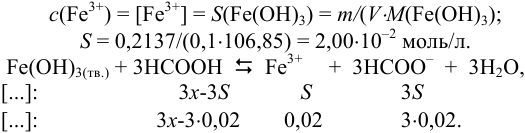
Вычисляем общую константу равновесия для реакции растворения К (раздел 2.3), подставляем в неё выражения равновесных концентраций и решаем полученное уравнение относительно 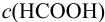 , обозначая ее через Зх:
, обозначая ее через Зх:
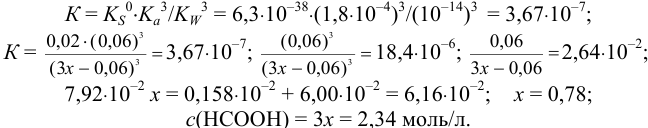
Пример 6.18.*
Вычислить растворимость сульфида ртути(1) в воде с учетом гидролиза.
Решение:
Основная реакция при растворении:

В общем случае, в побочных реакциях гидролиза могут участвовать и катион, и анион. Однако сравнение констант гидролиза по первой ступени показывает, что гидролизом ионов 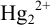 можно пренебречь и учитывать только протонирование аниона ионами водорода из воды:
можно пренебречь и учитывать только протонирование аниона ионами водорода из воды:
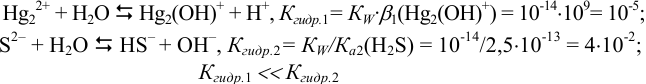
Допускаем, что 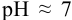 создается только диссоциацией воды, поскольку низкая концентрация подвергающихся гидролизу ионов
создается только диссоциацией воды, поскольку низкая концентрация подвергающихся гидролизу ионов 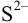 мало повлияет на среду раствора. Найдем долю свободных ионов
мало повлияет на среду раствора. Найдем долю свободных ионов 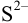 с учетом формулы (2.5) (для
с учетом формулы (2.5) (для 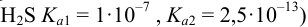 .
.
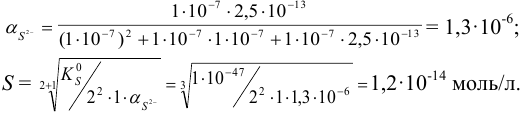
Без учета гидролиза растворимость  была бы ниже:
была бы ниже:
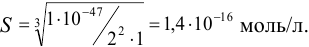
Следовательно, в результате гидролиза ионов осадка повышается его растворимость.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

