Оглавление:
Вклад молекулярной растворимости в общую растворимость
Если при растворении осадка общий процесс является суммой равновесий 2 и 3:
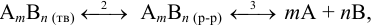
то общая растворимость малорастворимого электролита 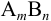 складывается из ионной и молекулярной растворимостей.
складывается из ионной и молекулярной растворимостей.
Молекулярная растворимость  — это составляющая растворимости, обусловленная наличием в растворе недиссоциированных (нейтральных) молекул. Константа
— это составляющая растворимости, обусловленная наличием в растворе недиссоциированных (нейтральных) молекул. Константа  равновесия (2) может быть легко вычислена из произведения растворимости
равновесия (2) может быть легко вычислена из произведения растворимости 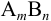 , табличных констант устойчивости комплексов и констант ионизации кислот (в соответствии с природой
, табличных констант устойчивости комплексов и констант ионизации кислот (в соответствии с природой 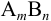 в растворе). В общем виде для равновесия (2):
в растворе). В общем виде для равновесия (2):
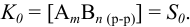
Например, для малорастворимого комплексного соединения АВ при ионной силе, близкой к нулю, справедливо:
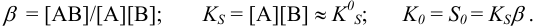
Аналогично, для малорастворимых кислот типа НА:
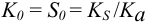
Общая растворимость (без учета сложной ассоциации ионов, в отсутствие побочных реакций и избытка одноименных ионов) для осадка типа АВ:
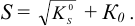
Для сильных электролитов 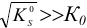 а для очень слабых
а для очень слабых 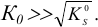 Подробнее о молекулярной растворимости — в рекомендованной литературе.
Подробнее о молекулярной растворимости — в рекомендованной литературе.
Пример 6.19.
Оценить вклад молекулярной растворимости в общую растворимость 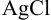 .
.
Решение:
В насыщенном растворе 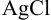 устанавливаются равновесия:
устанавливаются равновесия:
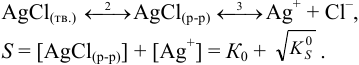
По формуле 6.10 находим :
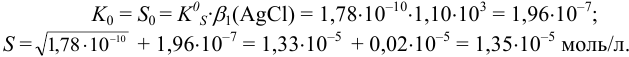
В данном случае молекулярной растворимостью можно пренебречь, т. к. она составляет всего 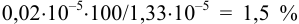 от ионной растворимости.
от ионной растворимости.
Пример 6.20.*
Вычислите: 1) концентрацию 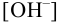 , при которой растворимость
, при которой растворимость 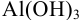 в его насыщенном растворе минимальна, и величину минимальной растворимости
в его насыщенном растворе минимальна, и величину минимальной растворимости 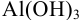 ; 2) растворимость
; 2) растворимость 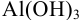 в 0,100 М КОН; 3) объем 1,00 М КОН, необходимый для полного растворения 1,00 г
в 0,100 М КОН; 3) объем 1,00 М КОН, необходимый для полного растворения 1,00 г 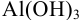 , суспендированного в 100 мл воды.
, суспендированного в 100 мл воды.
Решение:
1. Для осадка 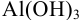 , образующего с реагентом ОН- разные комплексные формы, растворимость определяется суммарной концентрацией всех форм (уравнение материального баланса):
, образующего с реагентом ОН- разные комплексные формы, растворимость определяется суммарной концентрацией всех форм (уравнение материального баланса):
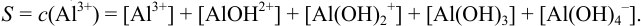
Для последовательных реакций комплексообразования выражения констант:
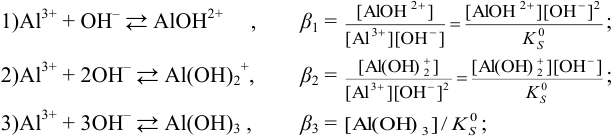
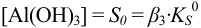 — собственная или молекулярная растворимость;
— собственная или молекулярная растворимость;
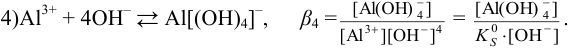
Подставляя вместо равновесных концентраций их значения из выражений констант в уравнение для растворимости, получаем:
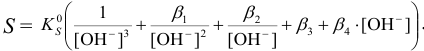
Наименьшая растворимость 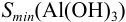 будет наблюдаться при pH, когда преобладает недиссоциированная форма
будет наблюдаться при pH, когда преобладает недиссоциированная форма 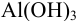 , т. е.
, т. е. 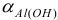 . должна быть максимальной. Тогда из выражения для молярной доли
. должна быть максимальной. Тогда из выражения для молярной доли 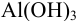 :
:
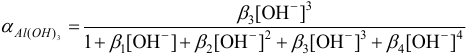
нужное значение 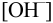 можно найти, приравнивая к нулю
можно найти, приравнивая к нулю 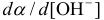 .
.
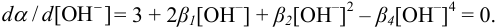
Используя справочные значения констант при решении последнего уравнения, получаем: 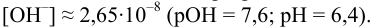
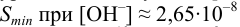 находим из уравнения (6.9):
находим из уравнения (6.9):
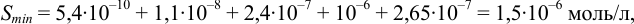
(основной вклад в растворимость дают три последних слагаемых).
2. В присутствии избытка щелочи 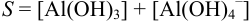 . Первое слагаемое
. Первое слагаемое 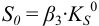 — мало и
— мало и
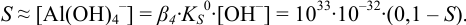
Отсюда 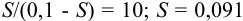 моль/л. (Коэффициенты активности однозарядных анионов близки
моль/л. (Коэффициенты активности однозарядных анионов близки 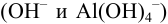 , ионную силу можно не учитывать).
, ионную силу можно не учитывать).
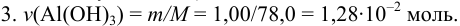
Для реакции: 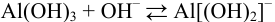
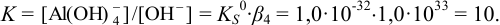
Объем  для растворения
для растворения 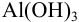 складывается из
складывается из 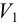 для перевода в раствор и
для перевода в раствор и 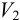 для обеспечения данной концентрации.
для обеспечения данной концентрации.
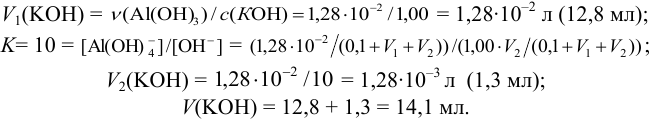
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

