Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)
Уравнение состояния идеального газа — это зависимость между параметрами идеального газа — давлением 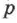 , объёмом
, объёмом 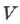 и абсолютной температурой
и абсолютной температурой 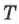 , определяющими его состояние:
, определяющими его состояние:
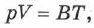
где 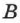 зависит от массы газа
зависит от массы газа 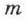 и его молекулярной массы
и его молекулярной массы 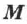 . В таком виде уравнение впервые получено в 1834 г. французским учёным Б. П. Э. Клапейроном.
. В таком виде уравнение впервые получено в 1834 г. французским учёным Б. П. Э. Клапейроном.
В 1874 г. Д. И. Менделеев вывел уравнение состояния для одного моля идеального газа: 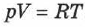 , где
, где 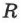 — универсальная газовая постоянная. Если молярная масса газа —
— универсальная газовая постоянная. Если молярная масса газа — 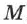 , то:
, то:
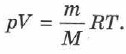
Уравнение состояния в форме (2.14) называется уравнением Менделеева — Клапейрона. Оно объединяет газовые законы Гей-Люссака, Бойля — Мариотта, Авогадро, Шарля.
Уравнение состояния (2.14) может быть получено из зависимости давления от температуры 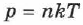 (2.12), если в неё подставить концентрацию молекул
(2.12), если в неё подставить концентрацию молекул 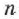 из выражения
из выражения
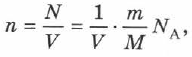
где 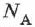 — постоянная Авогадро,
— постоянная Авогадро, 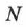 — число молекул в теле.
— число молекул в теле.
В результате получим:
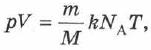
где 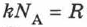 — универсальная газовая постоянная, равная
— универсальная газовая постоянная, равная 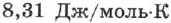 ;
; 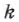 — постоянная Больцмана, равная
— постоянная Больцмана, равная 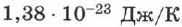 . Заменив в (2.16)
. Заменив в (2.16) 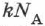 на
на 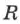 , получаем уравнение состояния в виде (2.14). Отношение уравнений (2.14) или (2.13) при двух наборах параметров
, получаем уравнение состояния в виде (2.14). Отношение уравнений (2.14) или (2.13) при двух наборах параметров 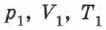 и
и 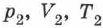 даёт:
даёт: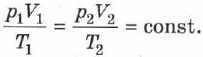
Эта лекция взята со страницы лекций по всем темам предмета физика:
Возможно эти страницы вам будут полезны:
| Шкала абсолютных температур в физике |
| Абсолютная температура в физике |
| Закон Бойля — Мариотта в физике |
| Закон Шарля в физике |

