Оглавление:





Углерод и его свойства
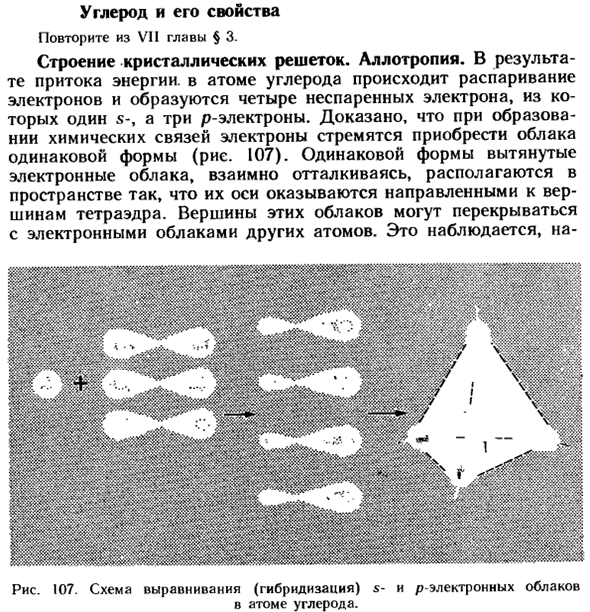
- Углерод и его свойства Повторите из главы VII § 3. Структура кристалла lattice. Allotropy. As в результате притока энергии происходит спаривание электронов с атомами углерода, образуя 4 неспаренных электрона.1 из них-s-Электрон, а 3 — p-electron.
- It доказано, что при образовании химических связей электроны стремятся приобретать облака одинаковой формы(рис.107).Вытянутые электронные облака одинаковой формы, отталкиваясь друг от друга, располагаются в пространстве так, что их ось направлена к вершинам тетраэдра. Вершины этих облаков могут перекрываться с электронными облаками других атомов.
Это наблюдается Рисунок 107. Людмила Фирмаль
Схема выравнивания s-электронного облака и P-электронного облака (гибридизация) Внутри атома углерода. Например, молекула метана с тетраэдрической структурой (рис.108).Если вершины этих облаков перекрываются с такими же облаками других атомов углерода, между ними возникает ковалентная связь под углом 109 ° 28/, образуя атомно-кристаллическую решетку, характерную для алмаза (рис. 59, I, P. см. 130).
Графит характеризуется кристаллическими решетками различной формы (см. рис.57, I, стр. 129).Это происходит за счет образования связи ковалентных связей между атомами углерода, в которой участвуют только 120 валентных электронов, направленных под углом 3°, а 4-й участвует в самосвязывании. Этот электрон более подвижен, и это связано с проводимостью графита.
Углерод в природе свободен и bound. In в свободной форме углерод встречается в виде графита и отдельных кристаллов алмаза. Графит очень распространен, но алмазы очень редки. Углеродные соединения очень распространены. Все живые организмы, а также уголь, торф, нефть и др., содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор, доломит, окись углерода (IV) и др.).
Мы получили ваши отзывы. Графит и алмазы добываются из недр земной коры. Он также может быть получен искусственно. Микрокристаллический графит представляет собой кусок charcoal. To получают древесный уголь, древесину нагревают без воздуха (пиролиз). в результате ее разложения образуется уголь, который является горючим газом, содержащим метан и другие продукты. Физические характеристики.
Алмаз и графит — это 2 аллотропных варианта углерода. Структура кристаллической решетки уже изучена. Особая твердость алмаза обусловлена тем, что в его кристаллической решетке каждый атом углерода связан с 4 другими атомами, расположенными равноудаленно ковалентной связью. Эти связи одинаково прочны во всех отношениях directions. In графит, расстояние между атомами в разных плоскостях намного больше, чем расстояние между атомами в одной плоскости.
Это объясняет резкое различие между физическими свойствами графита и физическими свойствами алмазов (таблица 56). Вопрос в том, как доказать, что графит и алмазы состоят из одного и того же элемента. Это видно при сжигании обоих веществ. Последствия горения、 Рисунок 108.Гибридное электронное облако атома углерода перекрывается с S-электронным облаком атома водорода молекулы метана.
Делокализация образования Таблица 56.Физические свойства алмазов и графита. Алмаз графит Это очень твердый, прозрачный, бесцветный и свободный электрон, благодаря которому ток flows. It легко расслаивается на отдельные мелкие plates. It имеет непрозрачный, серый металлический блеск. Также было доказано, что при определенных условиях алмаз может превратиться в графит, а графит может превратиться в графит. diamond.
- So например, если алмаз нагреть выше 1000°С без контакта с воздухом, он постепенно превратится в графит. Напротив, в присутствии катализатора, когда графит нагревают до 104°с под давлением 3000 МПа, он превращается в графит. Именно так производятся искусственные алмазы. Адсорбция. После нагревания, не касаясь воздуха, древесный уголь сохраняет тонкую пористую структуру древесины (рис. 109), и поверхность становится очень большой.
По этой причине существуют особые свойства, которые можно испытать. Изменение цвета происходит, когда вы кладете кусок угля в колбу, заполненную коричневым газом (оксид азота (IV)).То же самое можно наблюдать, если встряхнуть лакмусовый раствор или чернила вместе с угольным порошком.
Затем, когда колба нагревается с углем, цвет появится снова. Людмила Фирмаль
Эти эксперименты показывают, что в нормальных условиях уголь поглощает различные газы и растворенные вещества. Чем больше относительная масса газа, тем легче он усваивается. При нагревании происходит обратный процесс. Поглощение газов и растворенных веществ углем и другими твердыми веществами на его поверхности называется адсорбцией, а выделение этих поглощенных веществ называется десорбцией.
Чем больше пористость угля, тем больше его площадь поверхности и тем лучше adsorption. To создавая большую пористость, уголь перегревают, пропуская водяной пар. Этот процесс удаляет остатки пищи. Рисунок 110.Использование углерода: / — Производство искусственных алмазов; 2-в медицине; s-входит в состав крема обувного. 4-адсорбент; 5-наличие сахара. 6-черная краска; 7-спирт; 8-синтетический бензин; 9-резина; в J0 является карбид кальция.
Пиролиз угля и чистые поры. Получить активированный уголь. Поэтому характерным свойством древесного угля является его способность адсорбироваться и десорбироваться. Химическое свойство. В нормальных условиях алмазы, графит и углерод химически инертны в угле.
Но при высоких температурах эти вещества становятся активными. По величине электроотрицательности элементов (I, с. 123) углерод в химической реакции может проявлять как восстановительные, так и окислительные свойства. Типичные реакции с участием углерода показаны в таблице 57. Углеродные соединения, содержащие металлы, называются карбидами.
Они образуются при нагревании соответствующего металла углеродом, без контакта с воздухом. Таблица 57 Химические свойства углерода Восстановительное окисление О6 +4 −2 С + 02 =С02+ 402 kJГ4г10 6 4-2-22С+ 02-«-2С0(неполное сгорание)0″2 −2 + 4-2 ° с + 2Cu0- ^ С02 + 2Cu я-0, 4 + 1С4-2НАСН,-метана, л, 0,+2-12С+Са^Сас2 кавер-группа г-*-1 0 0 + 3- 4ЗС+4Л1-карбида алюминия А14С3 углерода водорода и соединения, образовавшиеся, но это органической химии в курс считать. Самый простой представитель-метан. Использование углерода схематично показано на рисунке 110. Вопрос 3-8 (стр. 76).
Смотрите также:
| Минеральные удобрения | Оксид углерода (II) |
| Положение углерода и кремния в периодической системе, строение их атомов | Оксид углерода (IV) |

