Оглавление:




Термодинамический процесс.
- Термодинамический процесс Основные термодинамические параметры состояний p, v и T однородных тел зависят друг от друга и связаны между собой определенными математическими уравнениями вида: Ф (Р, V, Т)= 0 Это называется уравнением состояния в термодинамике. Если известно уравнение состояния, то достаточно знать состояние простейшей системы-однородное, постоянное
по времени, массе, составу (состоит из 1 фазы и не изменяется химически). 3 независимых переменных:^ Р = / я(<т в); в = Ф2(р, т); т = / а(у, п). изменяется и ее состояние. Совокупность изменений состояния термодинамической системы при переходе из одного равновесного состояния в другое называется
При изменении внешних условий, в которых находится термодинамическая система Людмила Фирмаль
термодинамическим процессом. Под равновесным состоянием тела понимаются давление, температура, удельный объем и все другие физические свойства во всех точках объема тела. Процесс изменения состояния системы будет находиться в равновесном и неравновесном состоянии. Если прогрессирующий процесс проходит через состояние равновесия, он называется равновесием. В термодинамике
мы в основном рассматриваем равновесные состояния и равновесные процессы, которые изменяют состояние термодинамических систем. Только равновесное состояние может быть описано количественно с помощью уравнения состояния. Простейшим уравнением состояния являются уравнения Клапейрона, Клапейрона-Менделеева, Ван-дер-Ваальса и др. Эти уравнения подробно рассматриваются в следующих главах. Равновесный процесс может осуществляться с бесконечно
- медленными изменениями внешних условий или с бесконечно малыми изменениями параметров, характеризующих состояние системы по сравнению со значениями самих параметров. Седативный, неравновесный, действительный процесс приближается к равновесию лишь в некоторой степени и не совпадает точно. Дисбаланс фактического процесса определяется, прежде всего, тем,
что он протекает с конечной скоростью под воздействием внешних условий, и равновесное состояние не успевает установиться внутри рабочего тела. или при его быстром сжатии температура и давление в разных точках объема рабочей жидкости не совпадают. То есть он переходит в неравновесное состояние, и процесс становится
Например, при быстром расширении газа в цилиндре под поршнем Людмила Фирмаль
неравновесным. С математической точки зрения уравнение состояния F (p, v, T)= 0 в 3-осевой системе координат p, v и T представляет собой поверхность, называемую термодинамической поверхностью. Можно представить равновесные процессы, изменяющие состояние термодинамической системы graphically. In дело в том, что любое равновесное состояние представлено точкой
на поверхности, а непрерывные изменения этих точек и состояний представлены на термодинамической плоскости кривой, представляющей собой графическое изображение равновесного процесса. Поскольку трудно использовать 3-осевую систему координат, обработка изображений используется путем проецирования декартовой плоскости, а не самой кривой. Когда
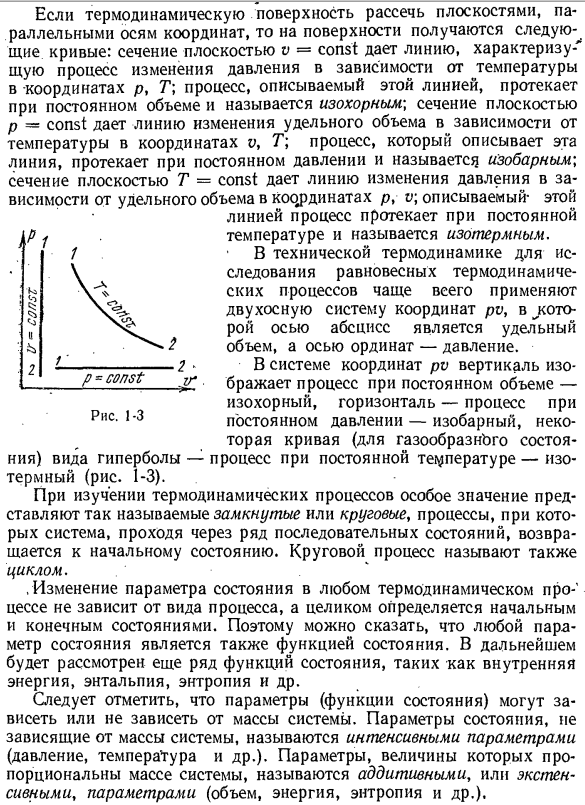
термодинамическая поверхность разделена плоскостью, параллельной координатным осям, на поверхности получаются следующие кривые: сечение плоскости v = const дает линию, характеризующую процесс изменения давления в соответствии с температурой координаты p, T; процесс, описываемый в этой линии, протекает в постоянном, называемом изотермическим объеме
сечение плоскости V = const дает линию изменения определенного объема в зависимости от температуры координат u, G. процесс, описываемый этой линией, осуществляется при постоянном давлении и называется изобарическим. Поперечное сечение плоскости T = const дает линию изменения давления в соответствии с удельным объемом координаты p, v\, описываемой этим Процесс осуществляется линией при постоянной температуре и называется
внешним. В технической термодинамике 2-осевая система координат pv чаще всего используется для изучения равновесной термодинамики processes. In в этом случае горизонтальная ось-это удельный объем, а вертикальная ось-давление. • * в системе координат pv вертикальная-объем, горизонтальная-процесс при постоянном давлении-изобарный, удельная кривая в виде гиперолы (газообразного состояния) — процесс при постоянной температуре
изотермический (рис.1-3). При изучении термодинамических процессов особенно важен так называемый замкнутый или циклический процесс, процесс прохождения системы через ряд последовательных состояний, возвращения в исходное состояние.
Процесс циркуляции также называют циклом. 。Изменение параметров состояния в термодинамическом процессе не зависит от вида процесса, а полностью определяется начальным и конечным состоянием. Поэтому мы можем сказать, что параметр состояния также является состоянием function. In в будущем это будет
рассмотрено Многие функции состояния, такие как внутренняя энергия, энтальпия, энтропия Обратите внимание, что параметр (функция состояния) может зависеть или не зависеть от массы системы. Параметр состояния системы, не зависящий от массы, называется параметром концентрации (давление, температура и т. д.). Параметры, значения которых пропорциональны массе системы, называются аддитивными или расширенными параметрами (объем, энергия, энтропия и др.). МИП ! II иа п ^ константный гг Рисунок 1-3
Смотрите также:
Решение задач по термодинамике
| Основные термодинамические параметры состояния. | Теплота и работа. |
| Термодинамический процесс. | Термодинамическое равновесие. |

