Оглавление:

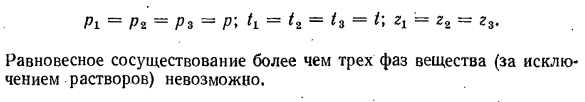




Термодинамические диаграммы
- Термодинамическая диаграмма Фаза rT-d и a g r a m m a. In в технике очень часто возникают вопросы, в которых необходимо рассмотреть процесс перехода вещества из твердого состояния в жидкое, из твердого состояния в газообразное и из жидкого состояния в газообразное. Из экспериментов известно, что вещества существуют в твердом, жидком и газообразном состоянии, которые в зависимости
от давления и температуры могут одновременно достигать 2 или 3 состояний. Переход вещества из твердого состояния в жидкое называется плавлением, или сублимацией из жидкого состояния в газообразное. Обратный процесс называется затвердеванием, или кристаллизацией, обратной сублимацией, конденсацией. Переход от одной фазы к другой
сублимацией из твердого состояния в газ Людмила Фирмаль
называется фазовым переходом、 Или обращение. Переход вещества при заданном давлении из одной Фазы в другую происходит при заданной температуре. Равновесное состояние фазы вещества, которое может превращать одно вещество в другое, называется фазовым равновесием. Полезно графически представить состояние равновесия фазы в диаграмме PT, Где фазовый переход представлен
точкой. Если кривая p = p (T) создана на диаграмме PT, то точки фазового равновесия размещаются на этих кривых, и вся фигура называется диаграммой фазы. В дополнение к диаграммам RT, термодинамика рассматривает pvt Ts, iTt is и другие диаграммы. Точки На диаграмме PT с обеих сторон фазовой кривой соответствуют
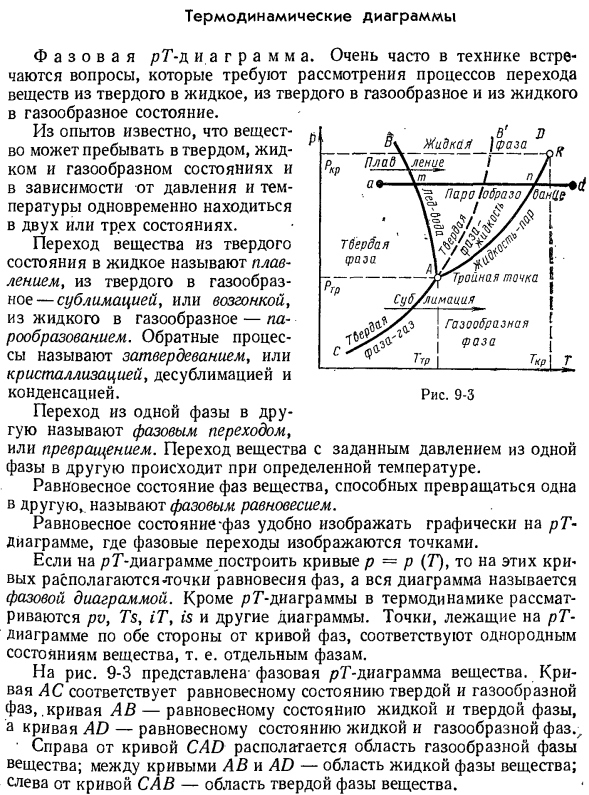
- однородному состоянию материала, то есть отдельным фазам. Рисунок 9-3 фаза фаза вещества? Показывает Т-образную диаграмму. Кривая AC соответствует состоянию равновесия твердой фазы и газовой фазы, кривая AB соответствует состоянию равновесия жидкой фазы и газовой фазы, а кривая AD соответствует состоянию равновесия жидкой фазы и газовой фазы. Кривая между A B и AD
представляет собой область жидкой фазы вещества. представляет собой область твердой фазы вещества. \ F03C На рисунке 9-3 кривая AD представляет зависимость между давлением и температурой во время фазового перехода от жидкости к пару:/(Гп).Эта кривая заканчивается в критической точке/ g. At при
Левая сторона кривой кабины Людмила Фирмаль
давлении выше критической точки не происходит фазового перехода из жидкого состояния в газообразное. Это объясняется тем, что при таких давлениях нет принципиальной разницы между жидкостями и газами. когда тепло удаляется из жидкости при p = const, жидкость становится твердой при определенной температуре. Эта температура называется температурой замерзания или плавления, а количество
тепла, отводимого в этом процессе, называется теплотой плавления. Во время плавления вещество находится в 2 stages. In на рисунке кривая AB представляет собой зависимость между давлением и температурой при фазовом переходе от твердого состояния к жидкому p = /(Tnn). В изобарном процессе a-d нагрев твердых тел представлен формулой a-t line. At точка м, наблюдается твердый
процесс плавления. Нагрев жидкости представлен линией tp, в ее конечной точке происходит процесс испарения(точка p).Нагревательный газ (пар) представлен линией технологического процесса n-D. So, процесс нагрева a-m, t-p, n-d происходит в веществе, состоящем из 1 фазы, а процесс плавления(точка t) и испарения (точка p) осуществляются в веществе, состоящем из 2 фаз. Точка d соответствует однофазному состоянию материала или перегретому
steam. As как видно из рисунка, при изменении давления изменяется положение точек типа. 9-3. Если давление рабочей жидкости ниже давления точки А, то твердое тело обходит жидкость и переходит непосредственно в газообразное состояние. То есть наблюдается явление сублимации. Кривая переменного тока (кривая сублимации)представляет собой зависимость между давлением
и температурой при фазовом переходе из твердого состояния в газообразное p = /(Gsubl).Этот переход происходит за счет подвода тепла, называемого сублимационным теплом. Точка кривой AS соответствует двухфазной системе твердого пара (например, насыщенного водяного пара на поверхности льда). В каждой точке β-кривой любого фазового равновесия AB, AD и AC находятся
в равновесии с двумя фазами. Кривая фазового равновесия делит всю плоскость фигуры pT на кристаллическую, жидкую и паровую фазы, где материал полностью находится в 1 фазе. На пересечении 3-фазной кривой равновесия (точка а) все 3 фазы материала находятся в равновесии. Точка, в которой 3 фазы вещества находятся в равновесии, называется тройной точкой. Значение давления
и температуры в Тройной точке может быть определено аналитически из состояния равновесия трех фаз. Пи = ПЗ-ПС = П \ Тл = Т2 = Т3 = Т \ З. Ы. = З2-Р3 Равновесное сосуществование 3 и более фаз вещества (за исключением растворов) невозможно. Каждое вещество тройной точки имеет свои уникальные параметры. Например, для воды: pA = = 0.00611 бар, cm = 0.001 Мб! КГУ ^•= 0,01°С Положения и типы кривых A B, AD и L C на рисунке зависят от природы каждого
вещества и устанавливаются эмпирически. На рис. 9-3 показана диаграмма RG аномального материала-кривые фазового перехода AB, AD и AC в воде имеют вид plotted. In эта фигура, кривая AB наклонена к left. As давление повышается, температура фазового перехода (затвердевания) снижается. Подробности об аномалиях воды объясняются в специальных курсах по термодинамике и физике.
Для»нормальных» чистых веществ кривая АВ наклонена вправо (пунктирная линия) — по мере увеличения давления температура фазового перехода (затвердевания) возрастает. Фазовый переход и А Р М м-м a. In дополнение к диаграмме фазы PT, под-диаграмма фазы очень важна. Рассмотрим фазовую диаграмму обычной материи, в которой область фазового равновесия (без соблюдения масштаба) представлена областью. Мы показываем такую фигуру
на диаграмме. 9-4.Область I диаграммы на рисунке представляет собой твердую фазу, область II представляет собой двухфазную систему, состоящую из жидкой фазы и твердой фазы, область III представляет собой жидкую фазу, область IV представляет собой область жидкой фазы и газовой фазы, область V представляет собой газовое состояние тела, а область VI-область твердой и газовой фазы.
Кривая I (D определяет количество сухого насыщенного пара, соответствующего равновесию 3 фаз (или соответствует тройной точке диаграммы Р).Точка k является критической точкой. По мере увеличения кривой, из соображений Ak и Dk Рисунки 9-4 По мере повышения температуры количество кипящей жидкости
увеличивается, что уменьшает количество сухой насыщенной жидкости. steam. At критическая точка&, оба тома будут одинаковыми. Когда фазовый переход из твердого состояния в жидкое или газообразное и из жидкого в газообразное происходит при постоянном давлении, температура не изменяется. Общий вид Изотерм в области жидкого и газообразного состояний показан на рисунке. 4-3. TS-A и A g r a m m a. диаграмма Ts широко
используется для термодинамического анализа многих технологических процессов и циклов. Это позволяет проверить изменение температуры рабочей жидкости и найти количество тепла, участвующего в процессе. Недостатком данной схемы является то, что при определении количества тепла Лот нуждается в измерении соответствующей площади, что затрудняет определение
необходимых значений. На диаграмме Ts значения определенной энтропии s строятся по абсциссе, а абсолютная температура T — по ординате. Кривая кипящей жидкости (граничная кривая жидкости) и кривая сухого насыщенного пара (граничная кривая пара) нанесены на Ts diagram. In кроме того, изобарные линии, изобарные линии применяются к фигуре! Линия постоянной сухости. Общий вид диаграммы G нормального вещества показан на рисунке. 9-5.На Граничной кривой жидкости Ak находится точка спекания
жидкости, а на Граничной кривой пара Ck-точка сухого насыщенного пара. Площадь / представляет собой твердую фазу、 Область / / — состояние равновесия твердой и жидкой фаз, область III-жидкая фаза, область IV-состояние равновесия жидкой фазы и газовой фазы, область V-газовая фаза, а область VI-состояние равновесия твердой и газовой фаз. Линия BC определяет температуру тройной точки S,
или температуру всех 3 фаз в равновесии. На диаграмме 7s обратимый адиабатический или изоэнтропический процесс представлен вертикальной линией (s = const), в то время как изотермический процесс представлен горизонтальной линией(T = const). Общая форма изобарической линии П (С, Т)= const может быть
установлено путем анализа формулы (6-45) (ДТ / ДП) П = Т / СР. Где (ДТ / DS) в р-угловой коэффициент линии изобарического (ТГА). (ДТ! Ds)p> 0, поэтому угловой коэффициент всегда равен positive. In область 2-фазового состояния вещества, изобарная линия совпадает с изотермой и является горизонтальной line. In область газового состояния вещества, изобарная линия поднимается слева направо
и представляет собой выпуклую кривую по направлению к горизонтальной оси. Чем выше давление, тем выше соответствующая изобарная линия. Угловой коэффициент конформного угла v (s, T)=const по формуле (6-45) равен (dT / ds) v = T / cv. Поскольку она всегда (dT / ds) v> 0, изолиния представляет собой восходящую кривую, более крутую, чем Изобарная линия. Поскольку угловой коэффициент изотермии равен i (s, T)= const (dT / ds) i <0, то изотермия будет представлять собой нисходящую кривую.
. Если кривая p = p (T) создана на диаграмме PT, то точки фазового равновесия размещаются на этих кривых, и вся фигура называется диаграммой фазы. В дополнение к диаграммам RT, термодинамика рассматривает pvt Ts, iTt is и другие диаграммы. Точки На диаграмме PT с обеих сторон фазовой кривой соответствуют однородному состоянию материала, то есть отдельным фазам. Рисунок 9-3 фаза фаза вещества? Показывает Т-образную диаграмму.
Кривая AC соответствует состоянию равновесия твердой фазы и газовой фазы, кривая AB соответствует состоянию равновесия жидкой фазы и газовой фазы, а кривая AD соответствует состоянию равновесия жидкой фазы и газовой фазы. Кривая между A B и AD представляет собой область жидкой фазы вещества. Левая сторона кривой кабины представляет собой область твердой фазы вещества. \ F03C На рисунке 9-3 кривая AD представляет зависимость между
давлением и температурой во время фазового перехода от жидкости к пару:/(Гп).Эта кривая заканчивается в критической точке/ g. At при давлении выше критической точки не происходит фазового перехода из жидкого состояния в газообразное. Это объясняется тем, что при таких давлениях нет принципиальной разницы между жидкостями и газами. когда тепло удаляется из жидкости при p = const, жидкость становится твердой при определенной температуре. Эта температура называется температурой замерзания или плавления, а количество тепла, отводимого в этом процессе, называется теплотой плавления.
Во время плавления вещество находится в 2 stages. In на рисунке кривая AB представляет собой зависимость между давлением и температурой при фазовом переходе от твердого состояния к жидкому p = /(Tnn). В изобарном процессе a-d нагрев твердых тел представлен формулой a-t line. At точка м, наблюдается твердый процесс плавления. Нагрев жидкости представлен линией tp, в ее конечной точке происходит процесс испарения(точка p).Нагревательный газ (пар) представлен линией технологического
процесса n-D. So, процесс нагрева a-m, t-p, n-d происходит в веществе, состоящем из 1 фазы, а процесс плавления(точка t) и испарения (точка p) осуществляются в веществе, состоящем из 2 фаз. Точка d соответствует однофазному состоянию материала или перегретому steam. As как видно из рисунка, при изменении давления изменяется положение точек типа. 9-3. Если давление рабочей жидкости ниже давления точки А, то твердое тело обходит жидкость и переходит
непосредственно в газообразное состояние. То есть наблюдается явление сублимации. Кривая переменного тока (кривая сублимации)представляет собой зависимость между давлением и температурой при фазовом переходе из твердого состояния в газообразное p = /(Gsubl).Этот переход происходит за счет подвода тепла, называемого сублимационным теплом. Точка кривой AS соответствует двухфазной системе твердого пара (например, насыщенного водяного пара на поверхности льда). В каждой точке β-
кривой любого фазового равновесия AB, AD и AC находятся в равновесии с двумя фазами. Кривая фазового равновесия делит всю плоскость фигуры pT на кристаллическую, жидкую и паровую фазы, где материал полностью находится в 1 фазе. На пересечении 3-фазной кривой равновесия (точка а) все 3 фазы материала находятся в равновесии. Точка, в которой 3 фазы вещества находятся в равновесии, называется тройной точкой. Значение давления и температуры в Тройной точке может быть определено аналитически из состояния равновесия трех фаз. Пи = ПЗ-ПС = П \ Тл = Т2 = Т3 = Т \ З. Ы. = З2-Р3 Равновесное сосуществование 3 и более фаз вещества (за исключением растворов) невозможно. Каждое вещество тройной точки имеет свои уникальные параметры. Например, для воды: pA = = 0.00611 бар, cm = 0.001 Мб! КГУ ^•= 0,01°С Положения
и типы кривых A B, AD и L C на рисунке зависят от природы каждого вещества и устанавливаются эмпирически. На рис. 9-3 показана диаграмма RG аномального материала-кривые фазового перехода AB, AD и AC в воде имеют вид plotted. In эта фигура, кривая AB наклонена к left. As давление повышается, температура фазового перехода (затвердевания) снижается. Подробности об аномалиях воды объясняются в специальных курсах по термодинамике и физике.
Для»нормальных» чистых веществ кривая АВ наклонена вправо (пунктирная линия) — по мере увеличения давления температура фазового перехода (затвердевания) возрастает. Фазовый переход и А Р М м-м a. In дополнение к диаграмме фазы PT, под-диаграмма фазы очень важна. Рассмотрим фазовую диаграмму обычной материи, в которой область фазового равновесия (без соблюдения масштаба) представлена областью. Мы показываем такую фигуру на диаграмме. 9-4.Область I диаграммы на рисунке представляет собой твердую фазу, область II представляет собой двухфазную
систему, состоящую из жидкой фазы и твердой фазы, область III представляет собой жидкую фазу, область IV представляет собой область жидкой фазы и газовой фазы, область V представляет собой газовое состояние тела, а область VI-область твердой и газовой фазы. Кривая I (D определяет количество сухого насыщенного пара, соответствующего равновесию 3 фаз (или соответствует тройной точке диаграммы Р).Точка k является критической точкой. По мере увеличения кривой, из соображений Ak и Dk Рисунки 9-4 По мере
повышения температуры количество кипящей жидкости увеличивается, что уменьшает количество сухой насыщенной жидкости. steam. At критическая точка&, оба тома будут одинаковыми. Когда фазовый переход из твердого состояния в жидкое или газообразное и из жидкого в газообразное происходит при постоянном давлении, температура не изменяется. Общий вид Изотерм в области жидкого и газообразного состояний показан
на рисунке. 4-3. TS-A и A g r a m m a. диаграмма Ts широко используется для термодинамического анализа многих технологических процессов и циклов. Это позволяет проверить изменение температуры рабочей жидкости и найти количество тепла, участвующего в процессе. Недостатком данной схемы является то, что при определении количества тепла Лот нуждается в измерении соответствующей площади, что затрудняет определение
необходимых значений. На диаграмме Ts значения определенной энтропии s строятся по абсциссе, а абсолютная температура T — по ординате. Кривая кипящей жидкости (граничная кривая жидкости) и кривая сухого насыщенного пара (граничная кривая пара) нанесены на Ts diagram. In кроме того, изобарные линии, изобарные линии применяются к фигуре! Линия постоянной сухости. Общий вид диаграммы G нормального вещества показан на рисунке. 9-5.На Граничной кривой жидкости Ak находится точка спекания
жидкости, а на Граничной кривой пара Ck-точка сухого насыщенного пара. Площадь / представляет собой твердую фазу、 Область / / — состояние равновесия твердой и жидкой фаз, область III-жидкая фаза, область IV-состояние равновесия жидкой фазы и газовой фазы, область V-газовая фаза, а область VI-состояние равновесия твердой и газовой фаз. Линия BC определяет температуру тройной точки S, или температуру всех 3 фаз в равновесии. На диаграмме 7s обратимый адиабатический или изоэнтропический процесс
представлен вертикальной линией (s = const), в то время как изотермический процесс представлен горизонтальной линией(T = const). Общая форма изобарической линии П (С, Т)= const может быть установлено путем анализа формулы (6-45) (ДТ / ДП) П = Т / СР. Где (ДТ / DS) в р-угловой коэффициент линии изобарического (ТГА). (ДТ! Ds)p> 0, поэтому угловой коэффициент всегда равен positive. In область 2-фазового состояния вещества, изобарная линия совпадает с изотермой и является горизонтальной line. In область газового
состояния вещества, изобарная линия поднимается слева направо и представляет собой выпуклую кривую по направлению к горизонтальной оси. Чем выше давление, тем выше соответствующая изобарная линия. Угловой коэффициент конформного угла v (s, T)=const по формуле (6-45) равен (dT / ds) v = T / cv. Поскольку она всегда (dT / ds) v> 0, изолиния представляет собой восходящую кривую, более крутую, чем Изобарная линия. Поскольку угловой коэффициент изотермии равен i (s, T)= const (dT / ds) i <0, то изотермия будет представлять собой нисходящую кривую.
Смотрите также:
Решение задач по термодинамике
| Общие условия равновесия термодинамической системы | Уравнение Клапейрона — Клаузиуса |
| Равновесие однородной системы | Тепловая теорема Нернста |

