Оглавление:










Теория водородного атома
- Теория водорода atoms. It кажется, что проблема строения простейшего атома-атома водорода-была решена планетарной моделью, предложенной в 1911 году, но сама эта модель имела внутреннюю структуру. contradictions. In дело в том, что согласно классической идее электродинамики, электроны, вращающиеся вокруг ядра, должны непрерывно излучать энергию в виде электромагнитных волн.
- Из этого будут вытекать 2 важных следствия. 1.Радиус орбиты электрона должен непрерывно уменьшаться, потому что энергия постоянно увеличивается. radiated. 2.Из-за постепенного изменения скорости вращения электронов электромагнитное излучение атомов должно состоять из непрерывной серии лучей различного типа. wavelengths. In другими словами, спектр водорода должен быть непрерывным.
In в конце концов, электроны должны попасть в атомное ядро, что приводит к разрушению атома. Людмила Фирмаль
Ни один результат не оправдан: саморазрушения атомов водорода не происходит, и видимый спектр этого элемента, как видно из диаграммы, состоит из большого количества отдельных линий, соответствующих определенной длине волны. III-2L Cluey синий fiol9t. Г — * » Я » Г ’ — ■ Т ■’ Я>■ Я■ч■я•**’■…….. 7000 V500 6000 5500 5000 4500 * 000 3500 * Рис. 111-21.Видимого спектра водорода(серии Бальмера). Следовательно, либо планетарная модель, либо классическая теория должны были быть wrong.
In дело в том, что оба они нуждались в серьезной коррекции. Еще до появления планетарной модели атома был отвергнут тезис классической электромагнитной теории света о непрерывности излучения. «Тезис о том, что есть скачок, что есть только непрерывность, на самом деле диаметрально противоположен антитезису, в том смысле, что изменение всегда осуществляется скачком, и только череда малых и быстро следующих друг за другом сливается» отсесс с«(преханов).
Такой антитезой была квантовая теория (Планк, 1900). Согласно этой теории, энергия излучается не непрерывно, а в определенных частях. Это кратно «Кванту действия» (h).Величина энергии излучения тем больше, чем больше частота колебаний излучения, то есть чем короче длина волны(II§ 2).Например, фиолетовый луч имеет больше энергии, чем красный one.
In в электромагнитном спектре (рис. III-12) энергия луча y самая высокая, а энергия радиоволны самая маленькая. Значение кванта энергии электромагнитного излучения(£erg) может быть вычислено из соотношения E * = / * V. где h-Квант действия(6.62 * MP7 erg sec), а v-частота колебаний рассматриваемого излучения. Квантовая теория была подтверждена широким спектром экспериментальных материалов и в настоящее время является общепринятой.
Два Основываясь на идее планеты и квантовой теории, в 1913 году Бор построил модель атома водорода, которая не содержит вышеперечисленных противоречий. Данная модель была разработана на основе следующих положений: 1.Электроны могут вращаться вокруг ядра по всем видам орбит, но только по определенным определенным орбитам.
На такой»допустимой» траектории вращение высвобождает энергию. 2.Ближайшие к ядру орбиты соответствуют наиболее стабильному («нормальному») состоянию атома. Когда последняя энергия передается извне, электрон может пройти через 1 из более удаленных орбит, и его запас энергии тем больше, чем дальше от ядра атома. величина эрг близка к энергии падения 1 мг с высоты 1 СР.
Прохождения траектории. В противном случае это выражается тем, что такие электроны имеют более высокую энергию level. In в отличие от обычного энергетического уровня, атом, содержащий 1 электрон на высоком энергетическом уровне, называется»возбуждением«.как видно из опыта, обратный переход из возбужденного состояния в нормальное осуществляется очень быстро. Среднее «время жизни» большинства возбужденных атомов оценивается примерно в 10-10 секунд. 3.
Поглощение и высвобождение энергии атомом происходит только тогда, когда электрон прыгает с 1 орбиты на another. In в этом случае разность между энергией начального (Eu) состояния и конечного (£k) состояния воспринимается или задается в виде лучистой энергии (фотонов), соответствующей излучению частоты колебаний, определяемой соотношением hva = «- £k».
Представленная идея позволила рассчитать различные радиусы,»допустимые» квантовыми условиями орбит электронов в атомах водорода. 12: 22: 32: 42:…: получается, что они связаны между собой как n2.Величину n назвали главным квантом number. As как видно из вышесказанного, n может принимать различные значения, соответствующие натуральному числу целых чисел. Оказывается, радиус ближайшей орбиты (l = 1) к атомному ядру равен 0,53 а относительно водорода. 2200 км / С (средняя скорость вращения Земли вокруг Солнца составляет 30 км! С.)
На рисунке II1-22 показана схема возможных орбит атомов водорода, причем показаны только первые 4. Скорость 2-го электрона равна половине скорости первого электрона, скорость 3-го электрона в 3 раза медленнее и т. д.3-4. Работа, необходимая для вытягивания электрона атома водорода с 1-й или другой орбиты, обратно пропорциональна 2-й степени его основного кванта number.
So например, вытянуть электрон с 3-й орбиты в 9 раз проще, чем с первой. Оказалось, что частота расчетного излучения, возникающего в результате прыжков электронов с одной орбиты на другую, совпадает с экспериментально наблюдаемой частотой линий водорода spectrum.
As как видно из рисунка III-23, прыжок с различных орбит, удаленных от ядра, на соответствующую n = 1 соответствует линии ряда в ультрафиолетовой области, а прыжок на траекторию n = 2 соответствует линии ряда Бальмера (рисунок Sh-21), а прыжок на линию 3 —ряда в последних 2-х сериях был обнаружен экспериментально и точно на основе их предсказаний после развития теории атомов водорода.
Цифры 111-22. Возможные траектории движения электронов атомных вулканов вдоль Бора. ^ Трафик ^ * серия Рисунок II1-23.Схема происхождения спектра водорода. Когда атому водорода дается достаточно энергии, его ионы генерируются из атома и распадаются на электроны и протоны.
Энергия, которую нужно потратить на это, эквивалентна n = oo (рисунок (-24)) и называется энергией ионизации (/). она определяется из спектра, а в нормальном состоянии атом водорода составляет 313,6 ккал на грамм атома: И+ 313,6 ккал = H ++ e Используя соотношение/ = 313,6 / l2, можно также рассчитать энергию ионизации возбужденных состояний атомов водорода. Дальнейшее развитие теории атомов водорода было дано Зоммерфельдом (1916).
- Он показал, что, помимо круговых орбит, электроны могут также двигаться с овалом (1 из фокусов эллипса имеет ядро).Главное квантовое число. Последний определяет размер полудлинной оси некоторого семейства эллипсов (в случае некоторой окружности-ее радиус).Значение полу-малой оси определяется «квадратичным» квантовым числом(6).Это также принимает значение смежного целого числа, но не может быть больше основного целого числа.
Для полудлинной оси эллипса справедливо соотношение a = n2r, для малой полуоси b = nkr, где r-радиус орбиты нормального состояния атома (0,53 а). Zg и Zz указывают, что большая ось указывает на меньшую ось как 3: 1, 3: 2 и 3: 3, respectively.
Например, для основного квантового числа 3 возможны 3 типа эллипсов, которые характеризуются обозначением 3. Людмила Фирмаль
In в последнем случае возникает специфический вид-круг эллипса, который рассматривался только в оригинальной теории. Модель возможных электронных орбиталей атомов водорода Зоммерфельда показана на рисунке. III-25.Мы сравниваем энергетический уровень (подуровень), соответствующий каждому из них на диаграмме. II1-26 (B) уровень (A), соответствующий только круговым орбитам. Усовершенствование модели атома водорода, созданной Зоммерфельдом, позволило объяснить тонкую структуру спектральных линий.
На рис. III-26 показано, что самые низкие подуровни соответствуют наиболее вытянутым эллиптическим орбитам. Поэтому при построении новых слоев с многоэлектронными атомами они заполняются в основном электронами. Сам электронный слой (то есть совокупность электронов с тем же значением, что и основное квантовое число) часто обозначается буквами/ C, L, M, N, O, Z, Q в порядке их удаленности от ядра.
В случае тяжелых атомов линии видимого спектра обусловлены скачками только самых внешних электронов, но при скачках в более глубоких слоях лучи, соответствующие ультрафиолету, более чувствительны. .ПШ— ■/> * 5 ПГА „«„Fi“ g » 6} 1 {g Двести пятьдесят 200. Пятьдесят Пятьдесят Рисунок Sh-24.Энергетический уровень атома водорода(ккал! Г атом). Диаграмма III-25.Схема возможных электронных орбиталей атомов водорода по Зоммерфельду.
Или рентген. Энергия ионизации этих атомов понимается как энергия, необходимая для удаления наиболее сильно несвязанных электронов, 1 из самых внешних орбит. Задача отделения электронов от атомов часто представляется в виде демонстрации их потенциала ионизации. Последнее понимается как минимальное напряжение напряжения, при котором свободные электроны, ускоренные этим электрическим полем, смогут вызвать ионизацию данного атома (выбивание внешнего электрона).
Например, потенциал ионизации атома водорода составляет 13,595 дюйма. Потенциал ионизации численно равен энергии ионизации, измеренной в электрон-Вольте (эВ), а переход от них к тепловой единице задается соотношением sv = 23,06 ккал / моль. Коэффициент преобразования — это молярная энергия электрона (то есть 6,02-1023), которая приобретается при прохождении через ускоряющее электрическое поле при напряжении 1 вольт.
Таким образом, работа атомной ионизации может быть представлена в вариантах как в термической единице (ккал / моль), так и в электронных вольтах. Рассмотренные выше понятия не противоречат простейшим атомным моделям (рис. IIJ-19), а лишь уточняют их. Действительно, электронная дистрибуция на Слой удерживается в модели Бора-Зоммерфельда и соответствует тому, который был указан в предыдущем разделе.
И, конечно, эти и другие модели не отражают структуру атома во всей его сложности. Но, тем не менее, нет никаких сомнений в том, что она дает некоторое правильное представление об основных функциях этой структуры. Вот как их следует понимать. «Восприятие теории как моментального снимка, приблизительной копии с объективной реальности материалистично» (Ленин).12 ″ 14 Добавь 1) численная зависимость между величиной длины волны, частотой колебаний и энергией электромагнитного излучения в видимой части спектра (4000-7000 А) и ближайшей к ней областью наглядно показана на Рис.1. III-27.
К последним также относятся наиболее распространенные значения химии соответствующей энергии в кКал на грамм атома (то есть 6,02-10 фотонов).Простота установки из схемы. 111-27, лучистая энергия в видимом спектре изменяется почти в 2 раза. 2) Если вы рассматриваете вопросы, связанные со спектром, вы часто не используете длину волны напрямую, а используете обратную противоположную величину.«О = ВВК.
Поскольку длина волны в этом случае выражается в сантиметрах, размерность<o равна cm’. волновые числа указывают, сколько волн определенной длины укладывается на 1 см. Связь между энергией излучения и его волновым числом определяется простым соотношением M: Q = < ® / 350 ккал / г атома. Вы можете использовать аналогичное соотношение Q = 1/350 (где A представлено см), чтобы сделать приблизительный расчет лучистой энергии по Поли-длине. Обратите внимание, что чистые волны часто называют «частотами» и обозначают V. может привести А4 Ага.
Цифры 111-26.Схема относительных энергетических уровней круговых и эллиптических орбит. x-это заблуждение, но tach kah на самом деле v = » o s. c-это скорость света. Низким риском в этом отношении является обозначение v, которое используется для волновых чисел. Для обозначения CG1 иногда вводится термин «Кайзер»(K) и»килокай-zsr» (x /()) для 1000 cmgh. 3) равновесие кругового движения-это равенство центробежного и центростремительного forces.
In в случае атома водорода, первый определяется кинетической энергией электрона и радиусом окружности, в которой он вращается, а второй определяется электростатическим притяжением к ядру электрона. если m-масса электрона иль второй! Сто одиннадцать тысяч сто одиннадцать ■■■ ’■■■■-…………. 。 …… ■И. Меня. И. И. И. 。 35 30 25 20 15/09 8 7 6s 4 3 sec’1 Я…. 11 ″ ■ 11…. Я■Я Я■Я Я Я Я Я Я Я Я Я Я Я Я Я я т я Iiiiilinil 1111f 11111)М 111. 20 15/09 6 7 6 5 4 3 2 эрг / фомон 300250 ГОО/ 50 SHO906870 60 50 40 30 надевай ботинки / г-аток Гонка III-27.
Длина луча-это энергия излучения. (9.11•10 «a g), e-его заряд (4.80•I0» 10 абсолютная электростатическая единица), r-радиус орбиты, o-скорость электронов. Условия равновесия атома водорода выражаются в следующих соотношениях: Тогда * е •* — «„- G или ТО2- г г г г г Нельзя однозначно сказать о внутреннем строении атомов aodorod, поскольку в этом уравнении 1 Есть 2 неизвестных (o и r).
Бор преодолел ту трудность, что, исходя из идеи квантовой теории, угловой момент электрической энергии (МВР) может измениться только путем перехода к уравнению. • МВР—. я (Ц 2, 3. …) Значение* = 1,054 * I0 “ * 7 эрг * сек-постоянная Планка-часто указывается л. Объединив 2-е уравнение, введенное этим методом, с предыдущим, можно получить общее решение, которое уже было определено для обоих неизвестных параметров электрического движения.
Л.* 2Пет * 1 р= 4л ВМ н »» а Известные значения коксита (i, A. подставляя e, t) в эти формулы, получаем следующую простую формулу для радиуса»допустимой» траектории и скорости вращения электрона. r (A) » = 0£3la и r-км / с И затем N HJ орбита! Электрон вращается 10 раз примерно за 1 секунду.
4)радиус первой электронной орбиты атома водорода входит в объем. Атомная системная единица: длина 0.53-10- * см), масса (9,1-10 * А * Е), заряд(4.8-10-10 АБС. е. Д. Это не так. Время (2.42 * 10 ′ 17 секунд), скорость(2.2 * 10 см /с), частота(4.1.1 «сек-1»), энергия(4.36-10 ″ эрг), или 27.2 эВ, nln 2.2-105 см «или 627.2 ккал / моль).Рассматривая атомные объекты в единичной системе, такой как эта (предложенная Хартом-Р), уравнения часто свободны от численных факторов и принимают более простую форму. y)до ’ 14 ч «!0н.
5) 2 равные равные противоположные электрические заряды e потенциальная энергия е * Расстояние друг от друга вычисляется по формуле R и определяется по формуле—.С другой стороны (\then3 е ’、 С другой стороны, китайская энергия атомов водорода I-J электронов(ср. Добавьте его в список.
3).Поскольку полная энергия ( £ ) состоит из движения и потенциала, в случае атома водорода, ярма г 2г «„„2г““ Каков размер фотона (Av), соответствующий скачку электронов в атоме водорода? 1 от одной орбиты к другой, определяемой разностью энергий между начальным ( £ ■ ) состоянием и конечным (£*) состоянием. Его общее выражение (add.3) замените на, вы получите 2n7e * t / 1. е * т (1 я \ \ 2Н ’ в * Т /!Один \ Ав Подставляя значение константы, уравнение частоты колебаний приобретает вид вычисления: в 3.30
Наконец, отношение Xv = c (см. II§ 2) допускает переход от частоты к длине волны. если yah выражается в Ангстреме, то формула имеет вид: Я сказал: „о! Ниже в качестве примера сравним экспериментально определенные длины оси ряда Балмера, вычисленные по последней формуле (в ангстремах): Lnyum из n ^ nl Теория: S5444Ш4329 4091 Опыт работы; 6563 4961 4340 4102
Приведенное выше сравнение показывает, что теория атомов водорода, даже в самой простой форме, дает результаты, которые полностью согласуются с экспериментом. c) относительно инфракрасная часть спектра водорода была изучена в более detail. In в первой серии мы обнаружили 2 дополнительные линии, во 2-й и 3-й серых-по 1 строке.
Впервые был показан 4-й инфракрасный серый цвет, соответствующий скачкообразной электрической траектории l “ b, представленной линией с длинной волной 123684 A (то есть 0,01 мили или более).Энергия такого излучения составляет всего 2,3 КК <и / г атомов. 7) Длина приведенной выше теоретической формулы АВ позволяет выполнять различные приближенные расчеты, связанные с изменением энергетического состояния атома водорода.
Введем в уравнение коэффициент 1.44-10**.Помощь в переходе от эрг к 1 атому, который помещается на грамм атома、 2 p7e * Т (<„; — 3l4(я * 🙂 Например, предположим, что вам нужно вычислить энергию возбуждения, соответствующую линии линии бальмара Грея (/ 2 = 2).Подставляя I * 3, 4, 5 и 6 последовательно в уравнение, вы получаете: л…………..Onneighe “ б Стирание юлбужедека.
Положить его. 44 59 66 70 Девятьсот девять Е » ■ = 1.44 * 10″ Ля’ Как видно из приведенной выше серии рисунков, энергия между последовательными энергиями возбуждения быстро уменьшается по мере удаления электронов от ядра. Это связано с быстрым сближением отдельных линий водородного спектра, которое наблюдается при приближении к границе замши (см. рис.111-21).
Сами подобные границы соответствуют pc = oo. То есть это соответствует полной десорбции электронов из ядра или ионизации атома. в зависимости от np соответствующие значения энергии явно различаются. Наиболее важной из них является энергия, соответствующая нормальному исходному состоянию атома (n» — I).
На это обычно указывает название энергии ионизации. Если определить экспериментально от границ ультрафиолетовой замши, то это будет значение 313,6 kcal. It это значение мало отличается от значения, рассчитанного по приведенной выше теоретической формуле (314 ккал) 9. он называется rndberg (Ry) и иногда рассматривается как единица энергии. Ия равна половине атомной единицы (add4). 8) чтобы оторвать последний электрон от ядра с зарядом Z, необходимо потреблять Z7 раз больше энергии, чем ионизирующий атом водорода.
Согласно расчетам на грамм атома, эта энергия составляет 313,6 Z3 ккал. Радиус слоев связан друг с другом как обратная величина заряда атомного ядра — / сложных атомов. То есть по мере увеличения атомного номера элемента они постепенно уменьшаются. Но даже самый тяжелый атом в сотни раз больше собственного размера атомного ядра.
9) электроны в электрическом поле отталкиваются от отрицательного полюса и притягиваются к положительному полюсу. Если R-разность потенциалов © ускоряющего поля, то скорость электронов, создаваемая им, определяется соотношением а = 600к£км / с. Таким образом, изменяя напряжение, можно оповестить электроны об определенной скорости, тем самым сообщив им определенное количество кинетической энергии. energy.
It полезно помнить следующее энергетическое соотношение между электрическим напряжением и волновым числом (дополнительно 2): I ev = 8066 см-1. 10) связь между величиной потенциала ионизации и энергией ионизации четко показана на рисунке. III-28.Величина потенциала ионизации, описанная в литературе, как правило, относится к 0°К. приблизительное преобразование соответствующей энергии ионизации Нм в 25°С может быть выполнено следующим образом: 1/5 ВТ 9 8 7 6 5 4 3 2 Г Около 1300250200150 Юо90 80 70 60 50 40 30 23 ККА ^ мм рисунок 111-28.
Потенциал ионизации и энергия ионизации. К каждому отделенному Электрону прибавляется заданное значение 0,07 эВ (или 1,5 ккал / моль). 11) ниже приведен пример значения энергии ионизации (эВ), соответствующей непрерывной десорбции электронов из внешнего электронного слоя атома инертного газа. При указании элемента указывается основное квантовое число слоя.
Разрыв электронов I Если III IV V VI VI VI VII VIII Нет (с-1) 24.581 54.403 Нэ(п-2)21.559 41.07 63.5 97.02 126.3 157.91(206.6)(237.9) Ар(н)— 3)15.755 27.62 40.90 59.79 75.0 913 124.0 143.46 Кг (р-4)13.096 24.56 36.9(52.1)、(65.9)(79.6)(109.6)(127.3)。 Хе(Я— 5)12.127 21.2 32.1(45.46)(56.9)。 (68.3) (96.0) (110.4) РН(м-б)10.746(20.02)(29.78)(43.78)(55.1)(66.8)(96.7)(1ч. Два) Все числа указываются в количестве знаков, соответствующем ожидаемой точности определения или вычисления спектра ns.
Такие расчеты проводились практически по всем элементам. Эти результаты приводятся в скобках, поскольку они ненадежны. Рассматривая представленные данные, можно видеть, что по мере увеличения основного квантового числа электронного слоя, то есть при удалении атомного слоя от ядра, отделение однотипного (например, первого) электрона происходит последовательно.
Отделение каждого последующего электрона от одного и того же слоя требует значительно больших энергозатрат, чем отделение предыдущего. Особенно резкие скачки наблюдаются при переходе от одного электронного слоя к другому. Например, энергия ионизации алгоя.
Соответствующее разделение 9-го электрона(то есть первого в слое n-2) составляет 421 эВ, что почти в 3 раза превышает значение 8-го электрона (то есть последнего в слое n = 3). 12) с середины 1920-х годов наблюдается перелом в развитии учения об атомной структуре, обусловленный влиянием новых физических концепций (то есть когнитивных идей), выдвинутых де Бройлем в 1924 году. Даже из самой квантовой теории, если после изучения столкновения фотонов и электронов было экспериментально подтверждено, что каждый электромагнитный волк обладает свойствами частицы одновременно, по де Бройю.
И происходит обратное: каждая движущаяся частица одновременно обладает свойствами волны. Количественная взаимозависимость между волновыми свойствами вещества и свойствами частиц (свойствами, соответствующими частицам) задается уравнением де Бройля. Я «= hfmv Где A-Квант действия, m-масса частицы, v-скорость, а A-соответствующая длина волны.
Используя это уравнение, квантовая масса лучистой энергии, соответствующая любой длине волны (o x => c = 3,00-!010 см /С) может быть calculated. At в то же время, вы можете рассчитать характеристики длины волны частиц по любой массе и скорости. Например, соответствующие линии серии Бальмера (R = 6563 A = » = «6.563-U» 5 см) примерно в 300 000 раз ярче электрона, так как масса фотографии составляет m = » 3-10 * M g. с другой стороны, например, электрон со скоростью 6-10°см /с характеризуется волной с R = 1.21-10 см-1.21 A, поэтому волна имеет рентгеновский тип.
Это следствие теории вскоре нашло прямое экспериментальное подтверждение: пучок электронов, направленный на кристалл, подвергся рентгеновской дифракции. Чуть позже то же самое было установлено в отношении атомов водорода и гелия. Дифракция является характерным свойством воли, поэтому представленный результат с уверенностью подтверждает правильность рассматриваемого понятия.
13) волновая механика, разработанная на основе этих идей, подходит к проблеме строения атомов с точки зрения свойственного им принципа неопределенности (Гойснссберг 1925).Согласно последнему, принципиально правильно зафиксировать природу движения электронов невозможно. Поэтому идея модели атома с определенной орбитой электрона должна быть заменена описанием, оценивающим только вероятность присутствия электрона в определенном месте пространства.
Оценка самой этой вероятности осуществляется с помощью таковых, с использованием чисто математических методов, при этом учитываются структурные данные. Волновое уравнение (Шредингер, 1926).Последняя обладает свойством гипотезы, истинность которой устанавливается выводом (в отличие от теоремы) или прямым доказательством, а также соответствием экспериментальным данным вытекающих из нее следствий.
На рисунке Sh-29 показано распределение вероятностей электронов на определенном расстоянии от ядра для различных квантовых состояний водорода atoms. As как видно из рисунка, квадратичное квантовое число и основное квантовое число равны(k «I) 2.5 2.5 5 2J 5 7.5 s / 2J расстояние от ядра. Дж Рис. 111-29.Вероятностное распределение электронов и атомов водорода. Положение максимальной вероятности примерно соответствует радиусу круговой орбиты теории Бора-Зоммерфельда.
Для эллиптической орбиты (k <n) и некоторого расстояния от ядра отображаются только максимум, io и минимумы вероятности. То есть в атоме появляются отдельные зоны различной»плотности электронного облака». подобный метод выражения вероятности нахождения электрона с помощью Би»размазывания» и таким образом оценки плотности полученного «электронного облака» особенно полезен для объемного анализа внутримышечных электронных атомов.
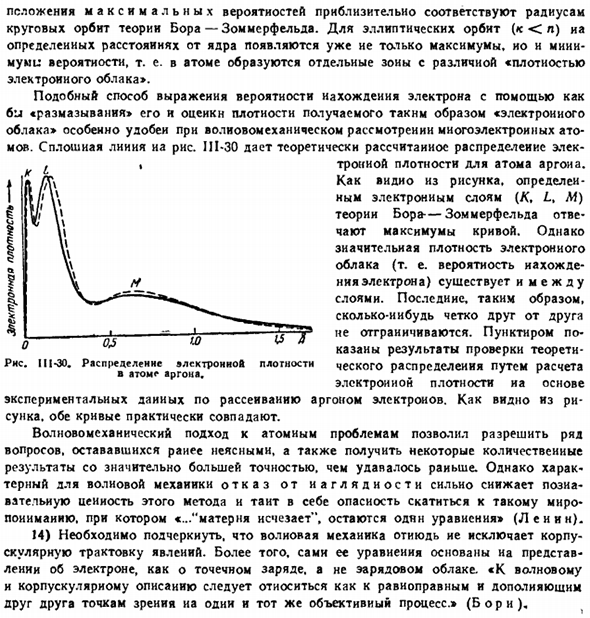
Сплошная линия IJI-30 на рисунке показывает теоретически рассчитанное распределение электронной плотности аргона atoms. As как видно из рисунка, удельное максимальное значение кривой соответствует удельным электронным слоям (/C, L, M) теории Бора・Зоммерфельда. Однако между слоями существует довольно плотное электронное облако (то есть вероятность нахождения электрона).
Поэтому последние четко не отличаются друг от друга. Пунктиром показаны результаты расчета электронной плотности и подтверждения теоретического распределения на основе экспериментальных данных рассеяния электронов по argon. As это видно из рисунка. Обе кривые примерно одинаковы.
Волново-механический подход к атомной задаче призван решить многие ранее неизвестные задачи и получить количественные результаты с гораздо большей точностью, чем раньше. Однако, отказавшись от визуальных характеристик волновой динамики, познавательная ценность этого метода существенно снижается, что влечет за собой риск впасть в такое мировоззрение.
«…Задача «исчезает», «уравнение остается только 1» (Ленин). 14) необходимо подчеркнуть, что динамика волн не исключает интерпретации микрочастиц из phenomenon. In кроме того, само уравнение основано на идее электрона как точечного заряда, а не зарядового облака. «Описание волн и частиц следует рассматривать как один и тот же объективный процесс с равной и взаимодополняющей перспективой.(Ров)) II1-30.Электронное распределение атомов аргона. Плотность
Смотрите также:
| Сложность структуры атома | Валентная связь |
| Атомные модели | Типы простейших молекул |

