Свойства тел в разных агрегатных состояниях
Агрегатные состояния вещества (от лат. aggrego — присоединяю) — это состояния одного и того же вещества в различных интервалах (промежутках) температур и давлений.
Агрегатными состояниями принято считать газообразное, жидкое и твёрдое.
Самым простым примером существования одного и того же вещества в этих трёх агрегатных состояниях являются лёд, вода и водяной пар. Невидимый водяной пар всегда присутствует в окружающем нас воздухе. Вода существует в интервале температур от О °C до 100 °C, лёд — при температуре ниже 0°С. При температуре выше 100 °C и нормальном атмосферном давлении молекулы воды существуют только в газообразном состоянии — в виде водяного пара. Вода, лёд и водяной пар — это одно и то же вещество с химической формулой 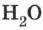 .
.
Многие вещества в обыденной жизни мы наблюдаем только в одном из агрегатных состояний. Так, кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193 °C он превращается в жидкость. Охладив эту жидкость до -219 °C, мы получим твёрдый кислород. И наоборот, железо в обычных условиях твёрдое. Однако при температуре 1535 °C железо плавится и превращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти вещества не молекулами, а тем, как эти молекулы расположены и как движутся. Расположение молекул воды в трёх агрегатных состояниях показано на рис. 70.
При определённых условиях вещества могут переходить из одного агрегатного состояния в другое.

Всего различают шесть процессов, приводящих к агрегатным превращениям вещества (рис. 71).
Переход вещества из твёрдого (кристаллического) состояния в жидкое называется плавлением, обратный процесс называется кристаллизацией, или отвердеванием. Пример плавления — таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называется парообразованием, обратный процесс называется конденсацией. Пример парообразования — испарение воды, обратный процесс можно наблюдать при выпадении росы.
Переход вещества из твёрдого состояния сразу в газообразное (минуя жидкое) называется сублимацией, или возгонкой, обратный процесс называется десублимацией. Например, графит можно нагреть до тысячи, двух тысяч и даже трёх тысяч градусов и, тем не менее, в жидкость он не превратится: он будет сублимироваться, т. е. из твёрдого состояния сразу переходить в газообразное. Все запахи, которыми обладают твёрдые тела (например, нафталин), также обусловлены возгонкой: вылетая из твёрдого тела, молекулы образуют над ним газ (или пар), обладающий запахом.
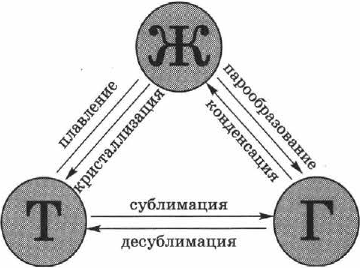
Примером десублимации является образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры образуются при десублимации водяного пара, находящегося в воздухе.
Переходы вещества из одного агрегатного состояния в другое играют важную роль не только в природе, но и в технике. Так, воду, превращённую в пар, можно использовать в паровых турбинах на электростанциях. Из расплавленных металлов на заводах получают различные сплавы: сталь, чугун, латунь и т. д. Для понимания этих процессов надо знать, что происходит с веществом при изменении его агрегатного состояния и при каких условиях это изменение возможно.
Эта лекция взята со страницы лекций по всем темам предмета физика:
Возможно эти страницы вам будут полезны:
| Закон Шарля в физике |
| Закон Гей-Люссака в физике |
| Испарение и конденсация в физике |
| Насыщенные и ненасыщенные пары в физике |

