Оглавление:








Структура твердых тел
- Твердый structure. In в отличие от более или менее свободно движущихся частиц газов и жидкостей, твердые частицы совершают лишь незначительное колебательное движение вблизи определенной точки. point. In теоретически эти точки располагались в строго регулярном пространстве и должны были соответствовать узлам некоторой пространственной решетки (рис. 1II-55).
- Прямое подтверждение этого теоретического вывода экспериментами стало возможным только после 1912 года, когда рентгеновские лучи оказались в разрезе 55. Естественно, это зависит от расположения частиц, образующих кристаллы. Схема, используемая для этой установки, показана на рисунке. II1-56.
An примером может служить характер отклонения, а также то, что новые лучи отклоняются при прохождении через кристалл странно. Людмила Фирмаль
Тонкий пучок рентгеновских лучей, прошедший через свинцовый экран (а), проходит через кристалл(Б), а за ним на фотопластинку (в), рис.5 111-57. Расчеты, основанные на таких картинах, позволяют не только установить пространственное расположение самих частиц, но и получить инструкции по задачам самих частиц. С этой точки зрения необходимо выделить 4 основных типа твердых конструкций. II1-58.
Как видно из самого названия, атомная структура характеризуется главным образом тем, что отдельные атомы располагаются в узлах пространственной решетки. Последние соединены между собой обычными ковалентными связями(как схематично показано на линии соединения на рисунке II1-58).Поскольку все эти связи полностью эквивалентны, то нет никаких оснований объединять те или иные атомы в отдельные молекулы, и весь Кристалл следует считать огромной единой частицей.
Твердое вещество, образованное атомным типом, обычно характеризуется высокой температурой плавления и высокой твердостью. Типичным примером твердого тела с атомной структурой является алмаз, в котором каждый атом углерода непосредственно связан с другими 4 атомами.
Специфические особенности молекулярной структуры определяются наличием неполярных или полярных молекул в узлах пространственной решетки, которые связаны между собой только между молекулами и силами. молекулы Этна иногда бывают одноатомными (инертными Рисунок Sh-56.Схема рентгеновского исследования кристаллов. Газ), но при всех своих свойствах решетка продолжает оставаться молекулой.
Таким образом, различие в атомных и молекулярных структурах обусловлено не типом частиц, а характером взаимодействия между ними. Твердые тела с молекулярной структурой обычно характеризуются низкой плавленостью и низкой твердостью, поскольку межмолекулярные силы притягивают частицы относительно слабо.
Характерным для твердого состояния веществ, образованных ионными молекулами, является ионная структура, которая характеризуется наличием отдельных ионов в узлах пространственного lattice. As фото. II1-58, каждый из них имеет точно такие же отношения со всеми ионами непосредственно вокруг противоположного знака. Таким образом, при переходе в твердое состояние индивидуальность отдельных молекул полностью теряется.
Весь Кристалл ионного соединения-это огромная одиночная частица. Силы, действующие на ионную структуру, вызывают гораздо более сильные сокращения между частицами, чем межмолекулярные силы. Таким образом, температура плавления и твердость ионных соединений значительно выше температуры плавления веществ, образованных полярными молекулами или неполярными молекулами 2 Структура металла, характерная для металлов в твердом (и жидком) агрегатном состоянии, существенно отличается от изученной выше по своей структуре. complexity.
It содержит как нейтральные, так и ионизированные атомы. То есть он делит 1 или другую часть валентного электрона. Все атомы данного металла ЧЕЗ> С ^ Д 0©0©О ^©О©©. «5С05С©©©©©© © ъ’ * * 0 © © © © о’Нилл Атомные, молекулярные, ионные металлы Рисунок Sh-58.Основные типы монолитных конструкций. В то же время каждый из них имеет возможность ионизации, равную other.
In другими словами, переход электрона из нейтрального атома в ионизированный атом происходит без расхода энергии. energy. As в результате аналогичный электронный обмен осуществляется непрерывно в металлической структуре, в которой всегда имеется определенное количество свободных электронов.
- То есть он не принадлежит определяемому в данный момент атому. Рис. 111-58 эти свободные электроны обозначены точками 3 Из-за незначительного размера электронов, электроны могут двигаться вокруг всего металлического кристалла почти freely. In эта связь, последняя может рассматриваться как пространственная решетка положительных ионов и нейтральных атомов, расположенных в атмосфере «электронного газа».
Каждый структурный элемент металлического кристалла не связан между собой, а потому представляет собой огромную единичную частицу. Рисунок Sh-57. . Наличие свободных электронов во всех металлических структурах имеет свойства, общие для металлов. К ним относятся, прежде всего, внешние признаки, которые характеризуются такими признаками, как непрозрачность, металлический»блеск«, преимущественно серый цвет.
Рентгеновская дифракционная картина кристаллов MGO Людмила Фирмаль
Высокая электронная проводимость металлов и их хорошая теплопроводность связаны со степенью свободы движения электронов. Все эти особенности четко отличают металлы от твердых и атомных или ионных структур, таких как алмаз или taC1. Как видно из вышесказанного, общие свойства металлов так или иначе связаны с наличием в них свободных электронов.
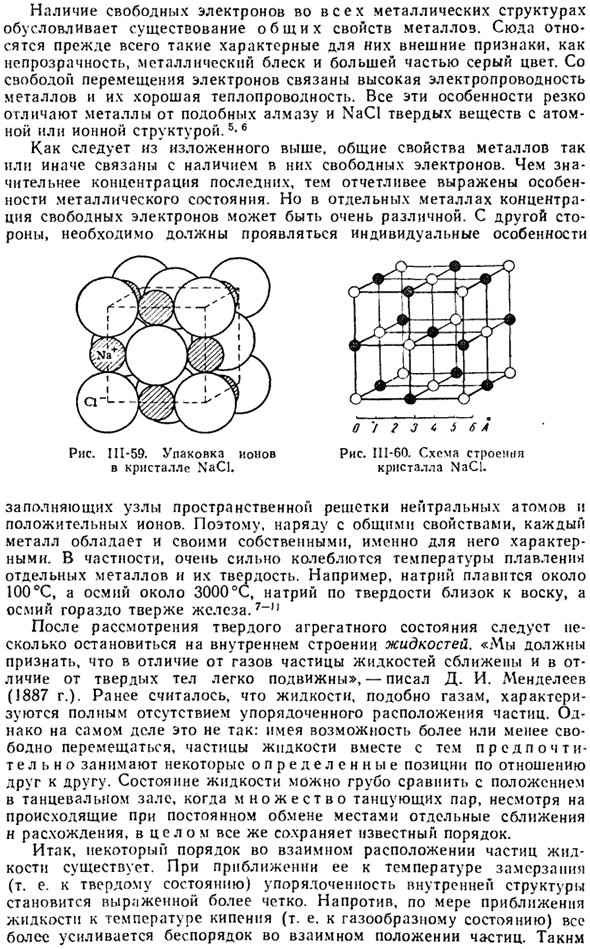
Чем выше концентрация последнего, тем более выражены особенности состояния металла. Но в отдельных металлах концентрация свободных электронов может быть очень разной. С другой стороны, должны проявляться индивидуальные особенности. о’/? ы ы ы 5 6 в Рисунок II1-60. Структурная схема Кристалла NaCl. Диаграмма II1-59. Упаковка ионов в кристаллы NaCl.
Заполните узлы пространственной решетки нейтральными атомами и положительными ions. So, наряду с общими характеристиками, каждый металл имеет свои characteristics. In в частности, температура плавления отдельных металлов и их твердость очень изменчивы. Например, натрий плавится при 100°с, осмий-около 3000 ° С, твердость натрия близка к восковой, осмий гораздо тверже железа.
После рассмотрения твердого состояния агломерации необходимо рассмотреть внутреннюю структуру жидкости. «Мы должны признать, что, в отличие от газа, частицы жидкости собираются вместе и, в отличие от твердого тела, они могут легко перемещаться», — сказал он. И. Менделеев (1887) писал. Ранее считалось, что жидкость, как и газ, характеризуется отсутствием регулярного расположения частиц. Но на самом деле это не так.
Поскольку он обладает способностью перемещаться более или менее свободно, предпочтительно, чтобы частицы жидкости занимали определенное положение относительно друг друга одновременно. Состояние жидкости можно примерно сравнить с ситуацией в танцевальном зале. И многие танцевальные пары поддерживают определенный порядок в целом, несмотря на постоянное появление мест, уступок и разногласий.
Поэтому существует определенный порядок во взаимном расположении частиц жидкости. Ближе к температуре замерзания(то есть к твердому состоянию) порядок внутренней структуры становится более выраженным. Напротив, когда жидкость приближается к точке кипения (то есть к газообразному состоянию), возмущение взаимного положения частиц возрастает все больше и больше. more. So …
Итак, с точки зрения внутренней структуры агрегатное состояние жидкости, безусловно, является переходом между твердым телом и газом. 2-ли Уже отмечалось, что в начале параграфа изучение вещества с помощью рентгеновских лучей позволяет точно установить взаимное пространственное расположение частиц. Это открывает важные возможности для химии определять размеры (точнее, сферы Действие) отдельных атомов и ионов.
Например, радиус не-Na +равен C1—1.81 A и равен 0.98 A. As обозначенные RNS, оба Иона можно грубо рассматривать как шары, упакованные в кристаллы NaCI. Ш-59.Обычно кристаллическая структура веществ изображается схематично, не принимая во внимание размер частиц, а только их относительное расположение (около 111-60). Радиусы нейтральных атомов Na и C!
Сравнение ионного и атомного радиусов показывает, насколько сильно отдача или адгезия электронного атома влияет на его размер. Для того же элемента этот эффект четко показан на схеме. Размер атома серы Ill-61 ″ увеличивается до 0 миллионов раз в нейтральном (s), 2-отрицательном (S «2) и 6-положительном (S * 6) states. In будущее, размеры атомов и ионов, многие свойства материи сильно зависят от них.
Добавь 1) каждая молекулярная решетка может быть разделена на отдельные атомные составляющие решетки. Такое разбиение (то есть точное определение местоположения каждого атома) позволяет сделать важные выводы о внутреннем строении самой молекулы.
Напротив, при рассмотрении свойств кристаллов это необходимо в большинстве случаев, так как расстояние между отдельными атомами в молекуле обычно значительно меньше расстояния между соседними молекулами. Таким образом, всю молекулу можно считать основным структурным элементом Кристалла. 2)напряжение между ионами в кристалле характеризуется энергией кристаллической решетки.
Под этим понимается энергия, выделяемая из свободного газа ионами при образовании кристаллов числом грамм molecules. So, для NaCI (58,5 г)、 Н *(Г)+ С г(г) — нацмен (т) — ф 186 ккал Очевидно, что при разложении кристаллов на свободные ионы газа должно поглощаться такое же количество энергии. 3) металлическую структуру можно рассматривать как переход между атомами и ions.
In факт, связывая свободный электрон структуры металла (рис. 111-58) с его положительными или нейтральными атомами, они приобретают атомную структуру или ионную структуру, respectively. In другими словами, можно представить себе металлическую структуру, соответствующую такому состоянию, что электроны от одних атомов уже расщепились и соединились с другими.
Стабильность такого промежуточного состояния характерна для металлов. Ву СЭ С * 4 Рисунок Sh-61.Влияние валентного состояния на размер атома. О©О©©О© о©о©©о© Рига 11142. Схема металлической конструкции из Beehl-Htronio точек zredi. 4)в дополнение к вышесказанному, есть 2 мысли о внутренней структуре металла. Согласно 1 из них, все атомы металла ионизированы. То есть последний состоит только из положительных ионов и свободных электронов.
Согласно другой точке зрения, металл считается состоящим из нейтральных атомов, а катионы и анионы некоторых элементов, то есть свободные электроны, исключаются из рассмотрения. Структура металла с точки зрения этого»ноэлектролита» передана схемой на рисунке 1. 111 * 62.
Хорошая электропроводность металлов и их механическая деформируемость противоречат этой идее, так как состояние постоянно обменивается между отдельными атомами (за счет обмена электронами).Однако общие оптические свойства металлов указывают на присутствие в них» электронного газа«.Средняя скорость электронов в этом газе составляет около 100 км / с.
То есть примерно в 200 раз превышает среднюю скорость теплового движения молекул в воздухе. 5) очень важной особенностью типичного металла является его относительно легкая механическая деформируемость, которая может быть сформирована в той или иной форме соответствующей холодной обработкой («холодная обработка») или высокой температурой («горячая обработка»).
ВОПРОС-ВОПРОС-ВОПРОС-ВОПРОС-ВОПРОС©©©©©.©.О.©-<адрес>©.О.©О cJkJhJk!© © © © ’©ОВО ОВО Б-О-О©©©© Атомная ионная металлическая Рияс, 1II-63.Схемы сдвиговых разломов различных типов конструкций. М. В. Ломоносов, » металлом называют легкое тело, способное к подделке.»Наоборот. Твердые частицы, подобные алмазам и NaCI, хрупки, то есть они распадаются при обработке.
Причины столь резкого различия характеристик выявляются при изучении рисунка. Ш-63.Результатом механического воздействия на твердое тело является смещение отдельных слоев его пространственной решетки. Этот сдвиг в атомной структуре приводит к разрушению валентной связи в ионной структуре за счет взаимного отталкивания одного и того же заряженного Иона, тем самым разрушая адгезию между слоями.
Ситуация с металлоконструкциями совершенно иная. Адгезия между слоями здесь всегда сохраняется, так как электроны могут свободно перераспределяться в) наличие примесей в металлах (особенно элементах с большим числом химических свойств) делает структуру более структурно однородной за счет последних, что затрудняет скольжение отдельных слоев пространственной решетки близко друг к другу.
Влияние примесей на механическую деформируемость можно грубо сравнить с действием песка, насыпанного под полозья движущегося Сайока на лед. С другой стороны, примеси также уменьшают степень свободы движения электронов. Это объясняет обычно наблюдаемое снижение теплопроводности чистых металлов при загрязнении.
Фактическое использование этого эффекта примесей основано на производстве различных технологически значимых сплавов, свойства которых более или менее отличаются от свойств исходного металла. 7) примеры, уже приведенные в тексте, указывают на то, что напряжение, действующее на металл, должно иметь сложный характер.
Вероятно, так называемые металлические связи, выражающие эти силы в совокупности, сводятся главным образом к одновременному существованию обычной ковалентной связи (между нейтральными атомами) и кулоновского притяжения (между ионами и свободными электронами).Относительная значимость каждого из этих компонентов определяет характер проявления»металлических» свойств твердых и жидких металлов.
Напротив, пара Металл состоит из отдельных молекул (обычно моноатомов) и ведет себя как любое другое газообразное вещество. Поэтому металлические связи характерны только для твердого и жидкого состояния. Это не отдельные частицы, а свойства их агрегатов.
8) согласно идее квантовой теории, за счет взаимодействия атомов, сближающихся при образовании агрегатов металлов, энергетический уровень, соответствующий индивидуальной валентности атома, делится на несколько подуровней, характеризующихся несколько иной энергией(рис. III-64).
Число таких подуровней для каждого атома определяется числом его соседей. Один и тот же тип расщепленного ужаса образует более или менее широкую энергетическую зону в целом, состоящую из множества подуровней, допускаемых в квантовых условиях. Свободные электроны металла распределены по зонам и их подуровням, начиная с самого нижнего, и каждый подуровень занят не более чем 2 электронами (обратное направление спина). Атом.__
Полупроводниковый изолятор металлического поплавка Рисунок 111-64.Схема дивизиона II1-65.Расположение зон Энергия level. In различные вещества. Согласно этой зонной теории, для металлов число подуровней во внешней зоне больше числа электронных пар (и отдельных электронов), удовлетворяющих ей, то есть существует дополнительная возможность размещения электронов в самой этой»валентной»зоне.
Отдельные подуровни в одной и той же зоне очень близки энергетически, поэтому перераспределение электронов металла на соседние подуровни происходит легко, поэтому и связаны особенности состояния металла. Как видно из рисунка II1-64, когда уровень атомной энергии разделен, подуровни появляются с более высокой энергией, а также ниже, чем начальная энергия. Таким образом, эмиссия электронов с самых верхних заполненных подуровней восходящей зоны будет легче, чем с первого атомного уровня.
Именно поэтому рабочая функция электронов из металла значительно снижается по сравнению с ионизацией отдельных зтомов одного и того же элемента. Например, ионизация атомов Ag требует затрат 7,6 эВ, а рабочая функция электронного ns металла серебра составляет 4,7 эВ. В отличие от металлов, в неметаллических структурах электроны заполняют все возможные подуровни валентной зоны.
Таким образом, изменение состояния электрона происходит только при переносе его на следующий возможный слон («зона проводимости»).Поскольку такой перенос обычно требует очень больших энергозатрат(например, около 6 эВ для алмазов), он не происходит. 9) промежуточное положение между металлическими и токовыми непроводниками(изоляторами) занимают полупроводники (рис. III-65).
Все подуровни в валентной зоне заполнены электронами, но запрещенная зона » ( £ ) настолько узка, что для перемещения некоторых электронов в зону проводимости требуется лишь относительно небольшое потребление энергии (например, 1,10 ЭВ в кремнии и 0,75 ЭВ в Германии).таким образом, само вещество является непроводником, но под воздействием некоторых внешних воздействий (усиление электрического поля, нагрев, освещение) оно более или менее легко превращается в проводник.
Но если исключить такой эффект, то электроны возвращаются на более низкий энергетический уровень, и вещество снова становится непроводящим. Электропроводность полупроводников имеет интересные особенности. Каждый электрон, покидающий валентную зону, оставляет «дырку» на одном из своих подуровней.
Под воздействием внешнего электрического поля место расположения этого «зала» занимают соседние электроны, тем самым оставляя «зал» в его первоначальном виде place. As в результате дальнейшего повторения такого процесса было установлено, что» зал » движется от положительного к отрицательному, то есть с положительным зарядом.
Это позволяет предположить 2 типа проводимости-электроны в полупроводниках (обусловленные движением электронов, которые ранее перемещались в свободную зону проводимости) и»дырки» (возникающие при освобождении места расположения начальной валентной зоны).Для отдельных полупроводников и выше Это nln другое в inkh.
Например, в Германии более характерны электроны (l-образные), а в селене более характерна проводимость дырок (p-образная). 10) наличие примесей обычно затрудняет экспрессию полупроводников Характерно (так как многие нижние подуровни зоны проводимости заполнены электронами примесных элементов).Поэтому полупроводники чаще всего подвергаются самой тщательной очистке.
Но в дальнейшем они часто «загрязняются» незначительным количеством определенных примесей, и вводимые ими дополнительные подуровни располагаются между валентными и проводящими полосами самого полупроводникового материала. Эти примеси выбраны для повышения электронной проводимости или дырочной проводимости.
Первый обычно достигается добавлением веществ, которые теряют электроны относительно легко, а второй достигается относительно простым захватом. Например, замена атомов Si (4 внешних электрона) в Кристалле Крестина атомами As(5 внешних электронов) увеличивает электронную проводимость, а замена их атомами B(3 внешних электрона) увеличивает дырочную проводимость. 11) 2 полупроводника разных типов-электроны (рис. III-66//) и дырки ( / / ) — при объединении возникает однополярная проводимость: система пропускает ток (электронный поток) в одном направлении и наоборот.
III-66 на питающем напряжении (e) левая сторона цепи на рисунке становится вместе Электроны с дырками в пограничном слое. Это позволяет потоку электронов свободно перемещаться слева направо, а при подаче напряжения вправо происходит размножение электронов и дырок, создается»блокирующий» пограничный слой, токи справа налево не текут(происходит то же самое).
Явление яркой проводимости широко используется в электротехнике. 12) вышеизложенное в тексте о внутреннем строении жидкости можно объяснить экспериментальными данными по ртути (рис. III-67).Если все атомы жидкой ртути расположены строго упорядоченно (в случае твердых тел), то кривая вероятности атома на 1 или другом расстоянии от исходного атома (в начале координат) будет иметь ряд резко выраженных максимумов и минимумов.
Напротив, если в расположении атомов преобладали полностью неупорядоченные свойства газов, то на всех расстояниях, превышающих пределы, при которых атомы максимально приближены друг к другу, вероятность нахождения должна быть одинаковой(соответствовать ломаной линии на рис.111-67).
Как видно из рисунка, экспериментальные кривые, полученные с помощью рентгеновских лучей, отражают некоторые промежуточные состояния.1 атом или другой атом может быть расположен на расстоянии более приблизительно 2,5 а от исходного атома、 д♦ * too0 «.?И<> £?о // . * — В} О°О О 0° Фигура о’о’о’о’о’ / •/ М * °о «) О!」 111-66.Схема генерации монополярной проводимости. / 7 а Фигура III-67.
Распределение жидкой ртути. На некотором расстоянии (около 3; b n 8.5 A) он самый большой, а на некотором другом (около 4.5; 7.5 и 10 A) он самый большой. smallest. In другими словами, строго регулярное расположение частиц, характерное для твердых тел, как бы уже в жидкости.
13) Если твердое тело характеризуется практически отсутствием изменений в расположении отдельных частиц, то в жидкости постоянно происходят флуктуации плотности структуры (кратковременные локальные изменения), вследствие чего возникают свободные полости молекулярного размера и disappear. So, жидкость имеет непрерывно изменяющуюся «перфорированную» структуру.
14) среднее время, в течение которого молекула сохраняет свое положение в определенной точке жидкости, составляет порядка 10-10 секунд или 10-10 секунд. Кроме того, собственная частота молекулярных колебаний составляет порядка 10’3 или 10IJ секунд, так что молекулы могут завершить эти колебания, оставаясь в определенной точке жидкости.
Каждый из них можно рассматривать как попытку изменить свою позицию, поэтому лишь малая часть таких попыток будет успешной. С другой стороны, большинство из них преуспели в 2 газах, и на твердом они почти не преуспели. Обусловлено преобладанием колебательного движения частиц за счет поступательного движения, а также сходством жидкостей и твердых тел.
15) Как видно из всего представленного в этом разделе, атомная модель позволяет систематизировать и визуализировать различные явления и уроки. Практическая применимость к интерпретации химических материалов показывает, что они основаны на правильных идеях. Однако эта применимость ограничена фундаментальными недостатками существующих в настоящее время моделей.
Они полностью основаны на законах механики и учении об электричестве. Из-за этой ситуации такая модель не может охватить все химическое вещество и полностью объяснить его. «Все движения включают в себя механические движения, движения больших или малых частей материи. Знание этих движений — первая задача науки, но это только первая задача.
Но это механическое движение совсем не исчерпывает движения. Переезд-это не просто смена места жительства. location. In область машин, это тоже изменение качества » (Энгельс).1. одним из таких идеологических направлений является химия. Именно поэтому его нельзя полностью свести к учению механическому и электрическому.
Смотрите также:
| Типы простейших молекул | Водород |
| Межмолекулярные силы | Химическое равновесие |

