Оглавление:
Скорость химических реакций и химическое равновесие
Задача 26.
Реакция между веществами А и В выражается уравнением: 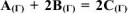 . Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ
. Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ 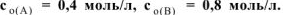 . Вычислить начальную скорость реакции и определить, во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
. Вычислить начальную скорость реакции и определить, во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.

Решение:
В простейших одностадийных реакциях скорость пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции:
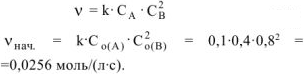
Уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, так как исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции:
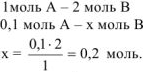
Тогда 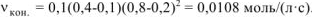
В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается:
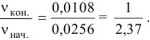
Ответ: 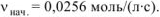
При уменьшении концентрации вещества А на 0,1 моль/л скорость реакции уменьшилась в 2,37 раза.
Задача 27.
Как изменится скорость реакции:
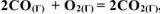 , если: а) уменьшить давление в системе в 2 раза; б) уменьшить объем системы в 3 раза?
, если: а) уменьшить давление в системе в 2 раза; б) уменьшить объем системы в 3 раза?

Решение:
На основании закона действующих масс
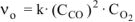
а) уменьшение давления в системе в 2 раза равносильно уменьшению концентраций реагирующих веществ во столько же раз.
Следовательно:
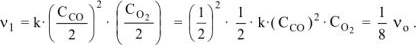
Тогда:
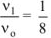
б) уменьшение объема в системе в 3 раза равносильно увеличению концентрации реагирующих веществ во столько же раз:
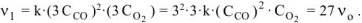
Тогда: 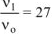 .
.
Ответ: а) при уменьшении давления в 2 раза скорость реакции уменьшится в 8 раз; б) при уменьшении объема системы в 3 раза скорость реакции увеличится в 27 раз.
Задача 28.
Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость этой реакции: а) при повышении температуры от 320 до 360К? б) если она протекает при 298 К в присутствии катализатора (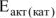 = 48 кДж/моль)?
= 48 кДж/моль)?

Решение:
а) Из уравнения Аррениуса получаем:

где 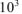 — коэффициент пересчета кДж в Дж, тогда
— коэффициент пересчета кДж в Дж, тогда 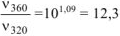 раза;
раза;
б) зависимость скорости реакции от наличия катализатора выражается уравнением:
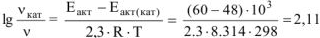
откуда 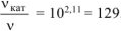 .
.
Ответ:
а) при повышении температуры от 320 до 360К скорость реакции возрастает в 12,3 раза;
б) в присутствии катализатора скорость реакции возрастает в 129 раз.
Задача 29.
При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8  водорода, а при температуре 303 К — 13
водорода, а при температуре 303 К — 13  водорода. Водород собран над водой при давлении 740 мм рт. ст. Рассчитать энергию активации протекающей реакции. Давление паров воды при температуре 293 К составляет 17,54 мм рт. ст., а при температуре 303 К — 31,82 мм рт. ст.
водорода. Водород собран над водой при давлении 740 мм рт. ст. Рассчитать энергию активации протекающей реакции. Давление паров воды при температуре 293 К составляет 17,54 мм рт. ст., а при температуре 303 К — 31,82 мм рт. ст.

Решение:
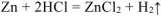
Из уравнения , 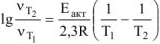 выражаем энергию активации
выражаем энергию активации
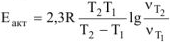
Скорость гетерогенной реакции определяем по уравнению:
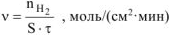
где 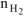 — количество моль выделяющегося водорода;
— количество моль выделяющегося водорода;
S — площадь цинковой пластины, 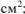
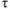 — время протекания реакции, мин.
— время протекания реакции, мин.
Определяем отношение скоростей выделения водорода при двух различных температурах (площадь пластины и время протекания реакции постоянны):
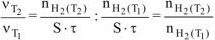
По уравнению Менделеева-Клапейрона
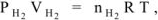
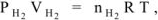 , а так как
, а так как 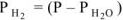 , то
, то
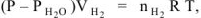
где Р — общее давление газов , мм. рт. ст;
Р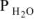 — давление насыщенного водяного пара при температуре опыта, мм. рт. ст.;
— давление насыщенного водяного пара при температуре опыта, мм. рт. ст.;
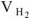 — объем выделившегося водорода,
— объем выделившегося водорода, 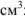 ;
;
Т — температура опыта, К;
R -универсальная газовая постоянная.
Из уравнения (5.6) 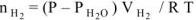
Подставив выражение (5.7) для температур  в отношение (5.5), получим
в отношение (5.5), получим
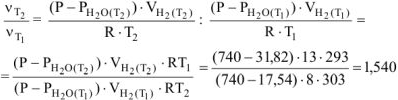
Откуда 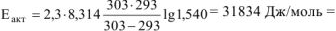
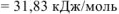
Ответ: 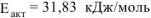 .
.
Задача 30.
На основании принципа Ле Шателье определить, в каком направлении сместится равновесие: 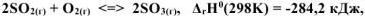 при: а) понижении температуры, б) повышении концентрации SO3, в) повышении давления. Записать выражение для константы равновесия реакции. Ответы обосновать.
при: а) понижении температуры, б) повышении концентрации SO3, в) повышении давления. Записать выражение для константы равновесия реакции. Ответы обосновать.

Решение:
Выражение константы равновесия реакции может быть приведено в зависимости от равновесных парциальных давлений газообразных участников реакции (5.8) или от их равновесных концентраций (5.9):

а) Выражение зависимости константы равновесия от термодинамических характеристик реакции имеет вид:
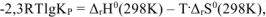 , откуда
, откуда
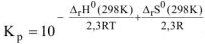 Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции
Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции 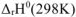 . Так как
. Так как 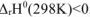 , то при понижении температуры показатель степени
, то при понижении температуры показатель степени 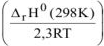 будет возрастать, а значит и значение
будет возрастать, а значит и значение 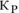 будет возрастать.
будет возрастать.
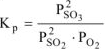 возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие
возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 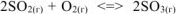 будет смещено вправо (
будет смещено вправо ( ).
).
б) Константа равновесия 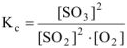 остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации
остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации 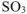 (числитель) при неизменном значении
(числитель) при неизменном значении 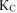 должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (
должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево ( ).
).
в) В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той реакции, которая сопровождается уменьшением давления или уменьшением суммарного числа моль газообразных веществ.
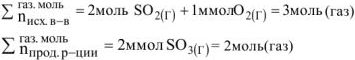
Следовательно, при повышении давления равновесие системы смещается вправо ( ).
).
Задача 31.
Вычислить константу равновесия для гомогенной системы 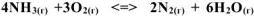 , если исходные концентрации
, если исходные концентрации 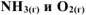 соответственно равны 6,0 и 5,0 моль/л, а равновесная концентрация
соответственно равны 6,0 и 5,0 моль/л, а равновесная концентрация 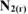 равна 1,8 моль/л.
равна 1,8 моль/л.

Решение:
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных веществ равна разности исходной концентрации и концентрации прореагировавших веществ.
Равновесная концентрация продуктов реакции равна количеству образовавшихся продуктов реакции, т.к. в исходном состоянии их количество было равно нулю.
Обозначим через х количество моль прореагировавших или образовавшихся веществ. Тогда с учетом коэффициентов в уравнении реакции отношения концентраций во второй строке под уравнением реакции равны: 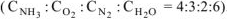 .
.
Последовательность расчетов равновесных концентраций веществ, участвующих в реакции, показана ниже:
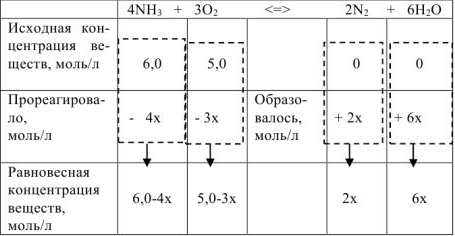
По условию задачи равновесная концентрация 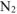 равна 1,8 моль/л. В то же время
равна 1,8 моль/л. В то же время 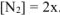 . Следовательно, 2х = 1,8,
. Следовательно, 2х = 1,8,
а х = 0,9. Тогда равновесные концентрации веществ равны, моль/л:
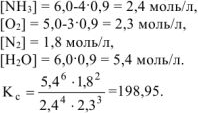
Ответ: 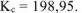
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:

