Оглавление:

















Щелочноземельные металлы
- Щелочноземельный металл. Элементы подгруппы кальция называются щелочноземельными металлами. Происхождение этого названия связано с тем, что их оксиды («земля» алхимиков) дают воде щелочную реакцию. Кальций составляет 1,5%от общего количества атомов в земной коре, но содержание радия очень низкое(8•10 «、2%)。
- Промежуточные элементы-стронций (0,008) и барий (0,005%) — близки к кальцию. Помимо различных силикатных пород, Ca, Sr и Ba встречаются в основном в виде плохо растворимых карбонатов и сульфатов. CaCOj-кальцит CaSO » — engndrnt SrCOj-стронцианит SrS04-Селестин BaCOj-whitelight BaS04-тяжелая шпора . Форма кристаллизованного CaCO3 встречается реже. Для сульфата кальция наиболее характерной является форма гипсового минерала (CaS04•2НаО), залежи которого часто имеют огромный power.
Карбонат кальция в виде известняка и мела иногда образует целые горы Людмила Фирмаль
In кроме того, важным кальциевым минералом является флюорит (CaF2). В случае стронция и бария сульфатные минералы встречаются чаще, чем углекислый газ. Первичные месторождения радия относятся к урановой руде(кроме того, в ней содержится всего 1000 г радия на 0,3 кг урановой руды).6-12 Промышленное применение, практически без исключения, находят в соединениях рассматриваемых элементов, их характерные свойства определяют область их применения.
Исключение составляют соли радия, практическая ценность которых связана с их общим свойством-радиоактивностью (III§ 2).Химия самого радия и его соединений еще не полностью изучена. studied. In в целом по своим химическим свойствам он напоминает барий. В свободном состоянии элементы подгруппы кальция могут быть получены по схеме ЗЭО + 2A1 ″ = А1203 + зэ В глубоком вакууме, окись сделана для того чтобы накалить с алюминием metal.
In в этом случае щелочноземельный металл удаляется и осаждается в более холодной части оборудования. В больших масштабах (около нескольких тысяч тонн в год) производится только кальций, а для его производства используется также электролиз расплавленного CaCl. Четырнадцать Кальций и его аналоги-это ковкий серебристо-белый металл. из nnh кальций сам по себе очень твердый, а стронций, в частности барий, гораздо спокойнее.
Сравните некоторые константы щелочноземельных металлов ниже. СА-ср ва РА 1.5 2.8 3.5 5 Температура Плавления, * C. 850 770 710 690 Точка кипения, # С. 。 1490 1357 1634 1536 Электропроводность (Hg-1) 22 4 2 В практическом применении (главным образом в металлургии) кальций встречается почти исключительно. Б-17 Летучие соединения щелочноземельных металлов окрашивают пламя в характерный цвет: Ca-оранжевый красный, Sr и Ra-Кармин-Красный, Ba-yellow-green. It используется в химическом анализе для обнаружения рассматриваемых элементов.
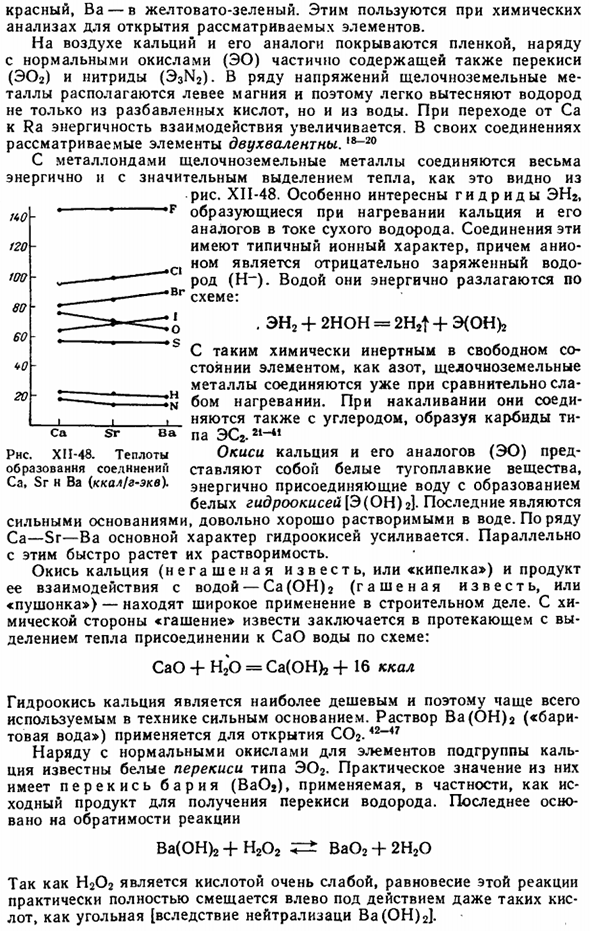
В воздухе кальций и его аналоги покрыты пленкой, вместе с обычными оксидами (ЭО), а также частично перекисью (Э02) и нитридом (Эз2). в серии напряжений щелочноземельные металлы расположены слева от магния, поэтому они легко замещают водород не только из разбавленных кислот, но и из воды. При переходе от Ca к Ra энергия взаимодействия increases. In их соединения, рассматриваемый элемент является двухвалентным. Как вы можете видеть, щелочноземельные металлы очень энергично соединяются с металлоидами и сопровождаются значительной лихорадкой. Диаграмма XII-48.
Особый интерес представляют гидриды EN2, которые образуются при нагревании кальция и его аналогов потоком сухого водорода. Эти соединения обладают типичными ионными свойствами, где анионы представляют собой отрицательно заряженный водород (Н〜).Они бурно растворяются в воде по схеме: 。 EN2 + 2NOH = 2H2t + E (OH) 2 В химически инертных элементах в свободном состоянии, таких как азот, щелочноземельные металлы связываются даже при относительно слабом нагревании. Во время зарева, они также совмещают с углеродом и формируют карбиды в СР СА ва па ЕЅ2. 21-41 РНС. XI1-48.
Жара окиси кальция и подобие предварительного образования соединения (EO) белое тугоплавкое вещество, Ca, Sr, и Ba(kcal / g-eq).Мы добавим воды и построим его. Белый гидроксид[E (OH) 2).Последний является сильным основанием, очень растворимым в воде. Основные свойства гидроксидов усиливаются в Ca-Sr-Ba series. In параллельно с этим быстро растет их растворимость. Продукт взаимодействия оксида кальция (негашеная известь, или скипперка) с водой-Ca (OH) 2 (гашеная известь, или»пух«) широко используется в строительстве.
С химической стороны, «тушение» извести заключается в добавлении воды в воду CaO, выделяя при этом тепло по схеме. CaO-f H20 = Ca (OHfe-f 16 ккал Гидроксид кальция является самым недорогим, поэтому он является самой прочной основой, которая чаще всего используется в технике. Используя раствор VA (OH) 2 («тяжелая вода»), откройте C02. 42-47 В дополнение к обычным оксидам, белые пероксиды типа Е02 известны как элементы подгруппы кальция. Из них используется пероксид бария (BaO2), который особенно используется в качестве исходного материала для производства пероксида водорода.
Последнее основано на обратимости реакции. Ba (OH)g + H202 ^ Ba02 + 2HgO Н202 является очень слабой кислотой, поэтому равновесие этой реакции сдвигается почти полностью влево под воздействием однородной кислоты, такой как угольная кислота (путем нейтрализации Ba (OH) 2). / » ? 120100-60 баллов 20 Технически BaO2 получают нагреванием BaO до 500°C воздухом flow. In в этом случае добавление кислорода по реакции 2×0+ 02 =2Х02+ 34 ккал Напротив, при дальнейшем нагревании BaO2 разлагается на оксид бария и кислород.
Таким образом, сгорание металлического бария сопровождается образованием только его оксида 4 * −61 При взаимодействии с кислотами, оксидами и гидроксидами щелочноземельных металлов легко образуются соответствующие соли, обычно бесцветные. Из производных обычных минеральных кислот легко растворяются соли с анионами SG, Br〜, G и NOJ. Напротив, в анионе F〜, SOr, COH, HOG, слабо растворим в воде. В отличие от ионов Ca * * и Sr**, ионы Ba токсичны, и многие соли рассматриваемого элемента имеют различное практическое применение.
Свойства галогенидов щелочноземельных металлов делятся на 2 достаточно резкие и разделенные группы. К одному относится фторид, к другому-производные других галогенов. Фторид почти нерастворим в воде, а также в разбавленных кислотах, а кристаллические гидраты-нет known. In напротив, хлориды, бромиды и йодиды легко растворяются в воде и отделяются от раствора в виде кристаллогидратов. 55-47. Нитрат бария кристаллизуется в нормальных условиях без воды, а нитраты Ca и Sr выделяются в виде кристаллогидратов.
Последний легко растворяется в воде, но растворимость Ba (NOs) 2 [и Ra (NOj) 2]значительно ниже, а нитрат кальция широко используется в качестве азотсодержащего минерального удобрения. Нитрат стронция и нитрат бария используются в пиротехнике для производства композиций, которые горят красным (Sr) или зеленым (Ba) пламенем. Сульфаты Sr и Ba кристаллизуются без воды. Выше 66 ° С в безводной форме (гипсовый ангидрид) сульфат кальция также выделяется из раствора. Гипс-CaS04-2H20 осаждается ниже 66°С.
Рассматриваемые сульфаты плохо растворимы, а в сериях Ca-Ra их растворимость быстро снижается. При нагревании гипса до 170°С большая часть (но не вся) его гидратационной воды удаляется. При замесе теста водой из такого гипсового порошка, не полностью обезвоженного (60-80% его массы), последний перекристаллизовывается и сопровождается затвердеванием целого с его кристаллизацией. Это является основой для изготовления гипса из различных предметов, а также использования гипса в качестве строительных материалов для вязания.
Карбонат щелочноземельного металла практически нерастворим в воде. При нагревании CO2 разлагается и превращается в оксид. В серии Ca — Sr — Ba, термическая стабильность карбоната быстро улучшена. Наиболее важным из них является карбонат кальция. Использование отдельных природных сортов CaCO3 отличается. Известняк используется непосредственно в строительных работах, а также служит сырьем для извести и цемента, которые являются наиболее важными строительными материалами.
Мел употребляется в качестве минеральной краски, в качестве основы, например, в качестве абразива. Ма-Мор является лучшим материалом для гравировки, изготовления электрощитов и т. д. 6 Б, В, Некрасов Ежегодное мировое производство извести из известняка достигает десятков миллионов тонн. Термическая диссоциация CaCO3 сопровождается выраженным поглощением тепла. CaCO3 + 43 ккал CeO + CO2 Температурную зависимость положения равновесия этой реакции можно увидеть в следующих данных: Температура,°С…. 550 fcOO 650 700 750 800 850 897 давления Co*, мм РГ. Статья 0.4 1.8 6.9 22.2 63167372760
Технически прокаливание известняка чаще всего осуществляется в шахтной печи (рис. XII-49). важным побочным продуктом производства является углекислый газ. Известь широко используется во многих отраслях промышленности. Значительное количество также потребляется в сельском хозяйстве.
Однако наиболее значительным и известным в области использования извести человечеством с древнейших времен является использование Д / У в качестве цементного строительного материала в сочетании с камнем, кирпичом и др. (во имя лайма лайм).Используйте достаточное количество воды для получения пастообразной массы с песком (3-4 части на 1 вес относительно веса песка).
Последний постепенно затвердевает за счет кристаллизации гидроксида кальция по реакции и образования кристаллического CaCO3 (за счет СО2 воздуха). Ca (OH> 2 + CO, = CaCO3 + H20 + 27 ккал В то же время, силикат кальция также сформирован (должный к песку SiO2).Вода выделяется при затвердевании известкового раствора, поэтому влага в построенных с его помощью зданиях будет храниться дольше.
Важным преимуществом перед известью является искусственная цементация material. In помимо того, что применение цемента исключает длительную сырость зданий, цемент характеризуется способностью затвердевать не только на воздухе, но и в воде. water. It затвердевает гораздо быстрее известкового раствора и придает камню гораздо большую прочность. Объем производства цемента в СССР в 1972 году составил 1 миллиард 400 миллионов тонн(в 1940 году 570 миллионов тонн, в 1913 году 150 миллионов тонн).
Цемент представляет собой зеленовато-серый порошок, который состоит в основном из смеси различных силикатов кальция и алюминатов. При смешивании с водой образуется масса. Переход из последнего пастообразного состояния в твердое называется «затвердеванием» и обычно осуществляется в течение нескольких часов. С химической стороны, затвердевание цемента происходит в основном за счет гидратации его составных частей. Вт-101 В дополнение к вышеуказанным солям Ca, Sr и Ba для химии этих элементов важно, что они известны только для бикарбоната E (HCO3) 2 в растворе.
Они образуются при взаимодействии растворенного в воде углекислого газа и обычных карбонатов по схеме ES03-gCO * — gн ^ ^ ^ э (НС03) 2 Рисунок XI1-49.Схема шахтной печи для обжига известняка. Эта реакция обратима, и нагревание смещает ее равновесие в сторону распада бикарбонатов. Гидрокарбонат щелочноземельного металла природная вода обычно содержит только Ca (HC03) 2.Его наличие придает воде приятный освежающий вкус (его нет в дистиллированной воде).102.
Содержание солей кальция и магния в природной воде часто оценивается как жесткость*. при этом жесткость различают на карбонатную («временную») и некарбонатную («постоянную»). 1, обусловлена наличием Ca (HC03) 2, а частота Mg (HC03) 2 равна low. It называется временным, потому что он может быть удален путем кипячения временного water. In при этом бикарбонаты разрушаются, а нерастворимые продукты распада (угли Ca и Mg) оседают на стенках сосуда в виде n и P.
Постоянная жесткость воды обусловлена наличием в ней солей кальция и магния. Соли кальция и магния не дают осадка при кипячении. Наиболее распространены сульфаты и хлориды. Из них особенно важно иметь плохо растворимый CaSO’, который будет оседать в виде очень плотной чешуи. Если паровой котел работает с жесткой водой, то нагретая поверхность будет покрыта чешуей. Во-первых, сама эксплуатация котла будет неэкономичной, так как последний плохо проводит тепло.
Даже слой накипи толщиной 1 мм увеличит расход топлива примерно на 5%.С другой стороны, стенка котла, изолированная от воды слоем накипи, может нагреваться до очень высоких температур. Это железо постепенно окисляется, и стенки теряют прочность, что может привести к взрыву котла. Проблема жесткости воды имеет большое практическое значение, так как паровые установки существуют на многих промышленных предприятиях.
Жесткая вода также не пригодна для проведения технологических процессов во многих отраслях промышленности (окрашивание и др.).С его помощью очень сложно выполнять другие манипуляции, связанные со стиркой одежды, мытьем волос и потреблением мыла. Это связано с тем, что в его органических кислотах соли кальция и магния нерастворимы. Это приводит к загрязнению моющихся предметов с одной стороны, и непродуктивному расходу мыла-с другой. 103.
Очистка воды от растворенных солей перегонкой слишком высока, поэтому в местах, где есть жесткая вода, применяют химические методы ее смягчения. Обычно твердость карбоната снимается добавлением Ca (OH) 2 в количестве, которое строго соответствует содержанию бикарбоната, обнаруженному в анализе. Кроме того, согласно реакции Ca (HC03) g + CafOHfe = 2CaCCU + 2H20 Все бикарбонаты становятся обычными карбонатами и precipitate.
In в большинстве случаев некарбонатная жесткость снимается добавлением соды к воде, и в результате реакции образуется осадок CaS04-f Na2C03 = CaCO ^ — f Na2S04 Затем вода осядет, и тогда котел будет приведен в действие или использован для производства. Для того, чтобы смягчить небольшое количество жесткой воды (например, в прачечной), в нее обычно добавляют небольшое количество соды и позволяют settle. In в этом случае кальций и магний прекрасно осаждаются в виде карбонатов, но то, что остается в растворе натриевой соли, препятствует использованию мыла.
Из вышеизложенного видно, что соду можно использовать для удаления твердости как карбонатной, так и некарбонатной. Тем не менее Тем не менее, технологи стараются правильно использовать возможность нанесения Ca (OH) g, поскольку он намного дешевле для этого продукта по сравнению с содой. Добавь 1) соединения кальция (известняк, ГНПС) известны и применяются на практике с древних времен. Валиум был открыт в 1774 году, стронций-в 1792 году. Химические элементы Ca, Sr и Ba были впервые получены в 1808 году.
Есть монография по кальцию. 2) радий, в 1871 г. I. It был предсказан Менделеевым и открыт в 1898 году. Добыто было около 2,5 кг.^В дополнение к урановой руде. Источник радия£Q_ будет действовать как некоторая буровая вода. Жизнь. Недавно было обнаружено, что ил на морском дне удивительно богат радием. I ^ В°С<>стоя, щелочь Земные металлы имеют структуру внешнего электронного слоя типа ns * и нулевого значения.
Возбуждение до двухвалентного состояния осуществляется по схеме ns *- * — nsnp или/ wa — + — ns (n-1) d (где n-основное квантовое число внешней оболочки). как видно из рисунка XI1-50, соответствующий энергетический уровень находится в Барии, который отличается от других элементов рассматриваемой подгруппы.
Непрерывная энергия ионизации щелочноземельных металлов приведена в следующем (эВ): СА Ср Ба Р」 Я 6.11 5.69 5.21 5.28 Это 11.87 11.03 10.00 10.14 5) соединения кальция всегда содержатся не только в животных и растительных организмах, но и в почве и природной воде. Например, растения извлекают из почвы большое количество кальция (в кг СА на тонну). Зерно соломы / плод Ботвуд Озимая рожь…….. 0.6 2.1 I картофель………. 0.2 6 Яровая пшеница……. 0.4 1.8 / sugarsusakura…… 0.4 1.2
Кальций табак, гречиха, клевер и другие потребляют еще больше кальция, а корневая система растения страдает от его дефицита. Однако истощение почвы, связанное с этим элементом, наблюдается относительно редко. в) человеческое тело содержит массу 0,7-1,4.%Кальций. Около 99% его объема составляют костные и зубные ткани(IX§ 5 add.3), остальное распределяется по разным органам и крови. Родни В. В. кальций, его соединения и жиры. М..«Металлургия» 1967.186 С.
7) суточная потребность человека в кальции составляет около 1 г, пожилые люди имеют больше, чем молодые. Количество этого элемента, входящего в тело, во многом зависит от типа письма. Это относительно небольшое, в основном растение днет. Высокое содержание мяса, особенно подходит для молочных продуктов.
Увеличение содержания кальция в продуктах животного происхождения сопровождается повышением впитывающей способности, что, по имеющимся наблюдениям, приводит к более быстрому росту и более длительному сроку хранения. 8) невесомость значительно влияет на баланс кальция в организме. Стимулирует переход этого элемента из кости в кровь, способствует его потере за счет жидких выделений.
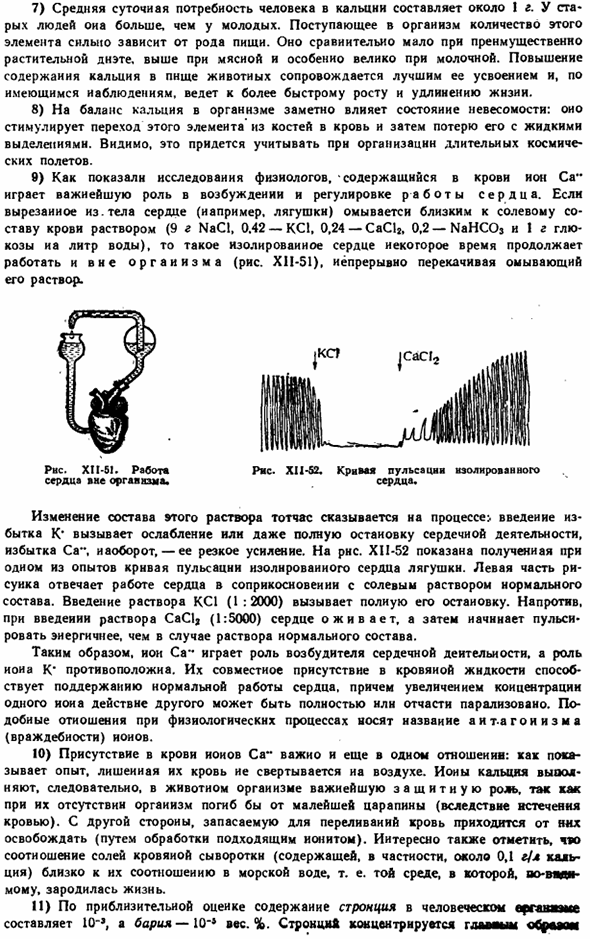
Видимо, это придется учитывать при организации длительного космического полета. 9) как показывают исследования физиологов, ионы Ca, содержащиеся в крови, играют важную роль в возбуждении и регуляции работы сердца (например, лягушки), которые вырезаются из организма, и раствора (9 г NaCl, 0,42 КС!), который близок к солевой составляющей крови. , 0,24-CaCl2, 0,2-NaHCOs и 1 г глюкозы и 1 л воды), такое изолированное сердце продолжает работать вне организма в течение длительного времени(рисунок X1I-51), раствор непрерывно перекачивается и промывается РНС. Хп-51.
Работа » внешний разум тела.» ПОЛИВИНИЛХЛОРИД. XI1-52. Krmn > изолированные пульсации сердца. Изменение состава этого раствора сразу же влияет на процесс. Введение избытка к * вызывает ослабление или полное прекращение сердечной деятельности, а даже избыток Са», наоборот, резкое повышение. РНС. Лягушка. Левая сторона рисунка соответствует работе сердца при контакте с обычным физиологическим раствором.
Полностью останавливается при введении раствора KC1(1: 2000), но при введении раствора CaC1a (1: 5000) сердце начинает оживать и пульсировать. Acce более активно, чем в случае обычных композиционных растворов. Таким образом, ионы Са играют роль возбудителя сердечной деятельности, а роль ионов К *противоположна, наличие их сочетания в крови способствует поддержанию нормальной сердечной деятельности, а при увеличении концентрации одного, действие другого может быть полностью или частично парализовано.
Этот процесс называется антагонизмом (враждебностью) ионов. 10) наличие ионов Са в крови важно еще в 1 пункте: как показывает опыт, лишенная крови кровь не сворачивается в воздух. Ионы кальция работают. Таким образом, наиболее важную защитную роль в организме животного играет рана(вследствие кровотечения).С другой стороны, кровь, хранящаяся для переливания, должна быть освобождена от крови(путем обработки соответствующими ионообменниками).кроме того, соотношение сывороточных солей (в частности, около 0,1 г / л содержащего кальций) близко к соотношению морской воды, то есть примерно к той среде, в которой зародилась жизнь.
11) по приблизительным оценкам, содержание стронция в организме человека составляет 10°, бария-10_>веса. Стройтснд концентрируется везде^ fpirw В кости он частично замещает кальций. Превышение нормы вызывает ломкость костей. Интересно, что концентрация стронция в позвоночнике в 4 раза выше, чем в среднем скелете. Характер распределения бария в организме пока не определен, но было отмечено, что его содержание в пигментной оболочке глаза относительно высокое.
12) нормальное содержание радия в организме человека составляет около МО * г, а максимально допустимое значение〜 L0 — * г. дальнейшее накопление этого элемента приводит к развитию заболеваний и кровопотери. 13) генерация алюминотермита свободных щелочноземельных металлов осуществляется при температурах около M200°C. It потоки немного сложнее, чем это Поскольку соединение Aljo>образуется из избытка исходного оксида, оно соответствует принципиальной схеме в тексте. Например, для кальция реакция протекает по следующему уравнению: — bCaO + 2A1 = Ca»(A10s) t + 3Ca.
В результате происходит также частичное слияние щелочноземельных металлов и алюминия. Относительное значение Ca. Sr А Ба на мировом рынке-это примерно 1: 4: 3. 14) электролизер для производства металлического кальция (рисунок КП-53) представляет собой печь с внутренней графитовой футеровкой, которая охлаждается проточной водой. Неводный CaClj подается в печь, а Железный катод и графитовый анод выступают в качестве электродов. Этот процесс протекает при напряжении 20-30 С. сила тока до 1 млн, и, вероятно, при низкой температуре(около 800 ° с).
Из-за последней ситуации графитовая футеровка печи всегда остается покрытой защитным слоем твердой соли. Последний электролиз по ходу будет постепенно увеличиваться, и только его концы останутся погруженными в расплав, так как кальций будет оседать в катоде только при достаточно высокой плотности тока (порядка 100 а / СМГ).Поэтому, по сути, катодом является сам металлический кальций (он изолирован от воздуха застывшей соляной коркой).Его очистка обычно осуществляется дистилляцией в вакууме или атмосфере аргона.
15) под стандартным давлением меньше чем 464°C кальция, структура Куба смотря на центр стабилизирована, и куб центризованный над этим temperature. It также было отмечено, что в присутствии загрязняющих веществ наиболее плотная структура шестиугольника может возникать во время it. In стронция (чистота 99,5%), установлено наличие всех 3 упаковок: плотных кубиков(до 213°с), плотных шестиугольников(до 602°с) и центральных кубиков. Барий кристаллизуется в виде куба в центре.
Кривая сжимаемости щелочноземельного металла (рис. XI1-54) показывает наличие фазового превращения, как если бы это была зона 2 млн для Sr и Ba.3 для всех 6 миллионов зон). пока не ясно. В нормальных условиях однотипные кристаллические решетки Ca и Sr могут образовывать непрерывный твердый раствор, но в системах Ca-Ba и Sr-Ba появляются отслаивающиеся участки.
Твердость бария в основании 10 (§ 2 add.75) — это 2.0. 16) теплота плавления и испарения щелочноземельных металлов равна 2,1 Н (СА) соответственно. 2. 2 и 33 (Sr); 1. 8 и 36 ккал / г-это (Ба). Теплота сублимации при 25°C оценивается как 42 для Ca и Baile и 39 ккал / г атомов для Sr и Ra. 17) Как видно из рисунка XII-55. Относительное электрическое сопротивление Ca. Sr и Ба при разных давлениях различаются по-разному. Максимальное значение кривой стронция составляет около 37 000, а изгиб кривой амбара-около 58 000 (второй изгиб наблюдается примерно на 146 000).
Электрическое сопротивление кальция будет увеличиваться плавно Ряса. HP-53.Схема электролизера для получения кальция. Рисунок HP-54. относительное изменение объема при dz & llyann (тысячное давление). Плоский максимум около 37 миллионов арг (если он примерно в 55 раз превышает нормальное давление), то начинает уменьшаться. Что вызвало сингулярные свойства всех этих кривых до сих пор evident. In в общем, рассматриваемые элементы ведут себя ненормально.
Это связано с тем, что электрическое сопротивление твердых тел (особенно типичных металлов) обычно уменьшается с увеличением давления. 18) синевато-серая мембрана, покрывающая серебристую поверхность кальция в воздухе, очень(но все же полностью) защищает металл от дальнейшего окисления. Первичная реакция (200-300°С) взаимодействия с водяным паром соответствует формуле 2Ca + H20 = CaO + CaHj, а вторичная реакция начинается только после завершения формулы CaHj + 2HjO Ca (OH) s + 2H *и CaO + HjO = Ca (OH) j, perrig> xn-56.
Воздействие * даале- Вика. Взаимодействие метана и кальция при 800°с mn < * В тыс. —. 。 И некоторые> лектрозоаротмалины. Это приводит к образованию CaC2 и Cali. 19) сравните стандартный потенциал © щелочноземельных металлов со следующим(Для сравнения, Be n Mg также включен). Будь Мг Ка Ср Ба Ра Кислая среда……..— 1.85 −2.37 −2.87 −2.89 −2.90 −2.92 Щелочная среда……. — 2.62-2.69-3.03 -.99-2.97
Как видно из представленных данных, значения потенциалов различных сред приближаются друг к другу по коэффициенту усиления металлических свойств элементов. Энергия гидратации ионов E, f равна (ккал / г-Ион): 386(Ca). 353 (Sr), 320 (Ba). 20) интересным производным сульфата бария является его днпирндиловый комплекс Ba (Dipy) 4.
It неустойчив к воздействию воздуха и воды и вступает в реакцию с йодом в тетраэдре ублюдочной раны(Ba (Dipy) » JIj. 21) CP-48 из рассмотрения данных на рисунке вытекает интересная специфичность результирующей теплоты соединений вдоль ряда Ca-Sr-Ba>; они незначительно уменьшаются при относительно малом радиусе аниона (например, O’) и значительно увеличиваются (например, I’).То же самое число увеличивается, но это явно связано с отношением объема.
22) гидрид щелочноземельного металла представляет собой бесцветное кристаллическое вещество. Температура, при которой начинается добавление водорода к металлу в серии Ca-Sr-Ba, несколько снижается (до 250, 200 и 150°С соответственно).Теплота образования гидрида составляет(ккал / моль)> 44,5(CaHs), 43,0(SrHj), 45,4 (BaHj). При изучении системы LiH-EN было обнаружено присутствие соединений 1lEN. 23) термическая диссоциация EN-гидрида начинает быть заметной примерно при 600°C и несколько усиливается в Ca-Sr-Ba series.
In в атмосфере водорода CaH > плавится без разложения при температуре 816°C (давление диссоциации при этой температуре составляет 32 мм рт. ст.).Расплавленный CaHj может растворить металлический кальций. 24) в отсутствие влаги гидрид щелочноземельного металла устойчив в воздухе, а при нормальной температуре реагирует с сильными окислителями, такими как йод, бром и хлор. При нагревании химическая активность резко возрастает и начинает бурно реагировать с очень многими substances.
It может использоваться, в частности, для разделения многих металлов (Ti, W, Nb и др.) из оксидов (в зависимости от схемы, например, 2СаН * + э02 = 2сао + 2hj + э).Реакция гидрида кальция с оксидом алюминия составляет приблизительно 3°С по схеме «3CaHi-fAliOj».Гидрид кальция реагирует с азотом при 600 ° С по следующей схеме: ЗСаН * — F — N’J = cajnj ■ + зна (кроме того, аммиак образуется даже в небольших количествах).
За счет взаимодействия с углекислым газом получают формиат кальция 1СаНа + 2соа-СА (НСО) а) и bc1a-диборай (зсан34- +■2В 3CaCI2 + участие в программе в2н»).При воспламенении воздуха гидрид щелочноземельного металла воспламеняется и медленно сгорает (за счет образования защитной пленки на поверхности) по схеме schemeH2+ 02 =ЭО + Н20.Смеси с твердыми окислителями (например, клюз) взрываются при нагревании.
25) гидрид EN2 не растворяется в 1 из обычных растворителей (без разложения). По схеме EN2 + 2H20 = E (OH),+ 2H, энергетически реагирует с водой(даже в следовых количествах).Или в ioiah: 2Н-(НЗ-гидрид) — f2н*(из воды)=2н2.Эта реакция может служить удобным способом получения водорода. Потому что в дополнение к CaH2 (около 1 m * H2 получается в 1 кг), вода нужна только для его implementation.
It сопровождается большим выделением тепла, например, погруженный в небольшое количество воды, CaH2 будет самопроизвольно воспламеняться в воздухе. Взаимодействие между гидридами EN2 и разбавленными кислотами является более активным. Наоборот, они более мягко реагируют на алкоголь, чем на воду. Гидрид кальция использован как эффективный осушитель для жидкостей и gases. It также используется для количественного определения содержания воды в органических жидкостях, кристаллогидратах и др.
26) В отличие от CaH2, гидриды Sr и Ba могут продолжать поглощать водород при 0°C, пока они не окажутся почти в составе EN. Это может быть связано с образованием нестабильных ионов H — (IV§ 1).18).Поглощенный водород высвобождается снова при нагревании или истощении. 27) ранее рассматривался связанный с гидридом боронат щелочноземельного металла (XI§ 1 add.103).Из этих союзов Ca (A1H4) 2 является listed.
It получается при взаимодействии раствора AlCIj с избытком CaH2 в tetradolofuran. It представляет собой бесцветное твердое вещество, обладающее свойствами, сходными с Аритом щелочного металла (XI§ 2 add.79). Четыре 28)состав 3jN2 щелочноземельных металлов нитрид представляет собой бесцветный огнеупорный материал (Калифорния * Н2 растворяется в 1195 и Ba5.\ 2-prn 1000 ° С). Теплота образования NS элементов составляет 105 (Ca), 93(Sr), 87 (Ba) ккал / моль.
Очень медленное взаимодействие металла и азота очевидно происходит даже на нормальной температуре, которая повышена в серии Ca-Sr-Ba. При нагревании реакция значительно ускоряется, и при 450 (Ca) она быстро реагирует. 350 (SR) и 200°С(Ба).Интересно, что при переходе кальция в другой аллотроп при 464 ° С(дополнительно 15) эта реакция резко замедляется, а при дальнейшем повышении температуры ее скорость снова возрастает.
Аналогичные производные Be и Mg (§ 1 add.67), а также нитрид щелочноземельного металла является ионным соединением. Они бурно растворяются в воде. 3jN2-f-6Н20=■ЗЭ (ОН) 2+ 2NH,. 20) пиролиз Sr » N2 и BajN2 в вакууме 500°C протекает в соответствии со схемой 43jN2-N2-f 334N2.Полученные нитриды представляют собой черные порошки, реагирующие с водой по схеме: 34N2 + 811 ^ = 43 (OH) t-f 2NH3-fH2.
30) находясь под давлением азота 250 атмосфер Ба * .При выдержке м2 при 500°с образуется перитолид валиум Ba * N2 + 2N2■ ■ 3BaN2.Описан также состав 3jn4 коричневого щелочноземельного металла с перефромизмом. Это достигается нагреванием соответствующего Амида 3 (NH2) 2 в вакууме. При взаимодействии с разбавленными кислотами эти пероксиды вместе с 2 молекулами аммиака также отделяют свободные молекулы азота.
Аналогичное аналогичное отверстие возникает при нагревании черного BajN4 при температуре 250 ° C и выше (в атмосфере азота). в воздухе он нестабилен даже при нормальных условиях. 31) состав 3 (NHs) e комплексы аммиака, Ca, Sr и Ba образуются между этими металлами и взаимодействием аммиака с жидкостью или газом при охлаждении. Они представляют собой твердые вещества с металлическим блеском, похожие по внешнему виду на золото и медь, они характеризуются высокой электропроводностью.
В последнем случае они могут быть истолкованы как соли, содержащие комплексный катион (3 (NHj) эж *или[3 (NHj)»], и полярные анионов(ІХ§ 1 дополнительные 27). В воздухе эти комплексные соединения самопроизвольно воспламеняются, а при хранении без воздуха они поступают в соответствующие производные Амия типа 3 (NHa). В серии Ca-Sr-Ba, стабилность сложного амиака несколько reduced. As можно увидеть от температуры (°C) показанной ниже.
Когда давление NHs достигает 50 ppm. Искусство. Для сравнения приведем аналогичные данные по аммиаку [3 (NHa)»] Ia. (CXNHiM <НХ ЛСР$) <л [Ба (НСЗ) Эль-Дж (Са(NHj) е |!Джей ФСР (Нха) Элла ЛБ * Нью-Хэмпшир, ухи 12 4-3 I 96 62 20 Согласно другим источникам, состав рассматриваемого комплексного аммиака не соответствует строго Формуле[3 (NH$) » J, но зависит от температуры. 32) при нагревании аммиачно-щелочноземельные металлы легко разлагаются по схеме 3 (NH$) «» 3 (NHa) t + 4NH3-f H2.Амид 3 (NHa) a почти нерастворим в жидком аммиаке(Ba (NH2) a более растворим, чем другие).
При нагревании выше 400 ° С Схема 3 (NHa) a = » NHa + 3NH, затем 33NH-NHj + 3 $ Na. Соединение желтого щелочноземельного металла также может быть получено нагреванием нитрида в атмосфере водорода (3aNa +2На = s 3h2 + 23nh), но за счет взаимодействия металла и аммиака при высоких температурах, водорода и нитрида (63 + 2nhaj =ззна+ 3an2). 33) производные щелочноземельных металлов типа 3nk-2nh $можно считать продуктом, который заменил калий непосредственным водородом.
Он осаждается при взаимодействии соли щелочноземельного металла в растворе KNHj и жидкости ammonia. In вода, эти аморфные отложения быстро растворяются. 34) разбавленный раствор щелочноземельных металлов в жидком аммиаке, цвет очень blue. By под действием этих растворов эти растворы монооксида углерода разделяются нелетучими углеродами СА в виде белого или желтоватого порошка. Sr и Ba состав 3 (C0) A. они, вероятно, aiiioi 1Ca02) 2-и соль с、 [- O-OshC-b:]〜. в воздухе эти карбилы постепенно разлагаются, первоначально образуя прозрачный желтый раствор с водой.
При нагревании под вакуумом происходит демпфирование по схеме: 23 (СО) а = ■»ЗСО» + 30+ ЗС. Согласно другим источникам, рассматриваемые карбоилы представляют собой отдельные соединения, но смеси различных продуктов. 35) нитриды Ca и Sr (и Mg) реагируют с монооксидом углерода при повышенных температурах по схеме: 3aNa +ЗСО » =IGHHIGHО + Na+ ЗС. В противном случае реакция будет протекать в случае Валия: Ba3Nj + 2CO = 2BaO-f Ba (CN) T. Эта разница обусловлена значительно более высокой термической стабильностью Ba (CN) a по сравнению с Sr, Ca, Mg цианида.
- 36) по схеме 3aNa + 3r2-23N3r или EGa + 3E + Na = 23N3r, 3N3r (3-Sr или Ba. D — это CI, Br. I) полученный нагреванием. Oii представляет собой желтовато-серое твердое вещество, которое термически устойчиво (например, BaNBaCl плавится без разложения при 965 ° С) и разлагается водой при выделении аммиака. Я также получил красный Канкачи.
37) борнит Райд состава 3абана, полученный для кальция и бария, также является смешанным производным Ирида. Они, вероятно, включены в Состав ионов[BN, P-структура [: N = B-N:].Эти нитриды Бора разлагаются по схеме 3a (BNa) 2 + 12, 33 (OH)»+ 2B (OH),+ 4NH. 38) из фосфида щелочноземельного металла известны CaaPa, CaP, SraPa. Ваджпаи. Бап и бара. Наиболее хорошо изученным Ca $ Ra является кристаллический красновато-коричневый порошок, легко расщепляемый водой[ia Ca (OH) a и RNe].
Все ОИИ могут быть получены путем комбинирования из элементов. Людмила Фирмаль
39) карбиды (за) кальция и его аналога, образующиеся при люминесценции смеси металла (или его оксидов) и угля, разлагаются с выделением ацетилена. Эта реакция особенно активна в случае BaC3, который воспламеняется при контакте с водой. Структура CaCa (mp 2140°С) показана на рисунке. Х-5.Теплота образования карбидов кальция и бария из элементов, составляет 14 ккал / моль и 12 ккал / моль.
Нагрев их в атмосфере азота приведет к образованию CaCNj и Ba (CN) a соответственно(add.35).в виде двойного соединения с аммиаком известно белое кристаллическое вещество гидроксид бария-Ba (C2H) j-4NH$. 40) в случае щелочноземельных металлов известны силициды различного состава. В основном 3SI и 3Slj.
Имеющиеся данные о теплоте, выделяемой элементами, сравниваются ниже: (ккал / моль)> 85(CaSi), 113 (SrSI), 182 (BaSI), (162) CaSi «. (147) SrSfo. Интересны различные курсы данных UPC из серии Ca-Sr-Ba (BaSl $известен для валиума, что означает, что его можно использовать в различных приложениях).Но основы явно не существует).Силицид щелочноземельного металла легко разрушается при разбавлении кислотой (обычно с продуктом Эун, силы и дальнейшего разложения).
Касия (депутат. Начиная с 1020°C), вы можете получить широксен(X§ 4 ext.106). Следует отметить, что нет никакой определенности в индивидуальной природе некоторых отдельных silicides. So, для CajSl была показана теплота образования из такого элемента, как 50 ккал / моль. 920 С с, на самом деле, кажется, есть такие силициды. Примерный состав сплав Касла кальция и кремния используется в качестве раскислителя и дегазатора для выплавки стали. 41) в ряду щелочноземельных металлов, полученных в результате синтеза элементов железа, характерен состав ЭВ.
Их кристаллы имеют CsCI-тип structure. In кроме того, анион является BJ-8-гранной группой. Они плавятся около 2250 * С. Я хорошо провожу электричество. Эти бориды обладают высокой химической стойкостью к обычным кислотам (кроме HNO>) и щелочным растворам, но легко разрушаются расплавленной щелочью. 42) изменение свойств оксидов и гидроксидов вполне естественно как для самого щелочноземельного металла, так и для всей серии Be-Ba.
Это естественно Непрерывное увеличение радиуса ионов в ЕС, при сохранении ими о Структура меглония (инертный газ): Будь МК Са Ср Ра 0.78 1.06 1.27 1.43 Выделяемое тепло * * ЭО. ккал / моль…. Сто сорок три триллиона сто сорок четыре миллиарда сто пятьдесят два миллиона сто сорок одна тысяча сто тридцать три Плотность кристаллов ЭО. л / см * …… 3.0 3.6 3.4 4.7 5.7 Энергия кристаллической решетки ЭО. 942. Восемьсот пятьдесят три миллиона восемьсот шесть тысяч семьсот шестьдесят шесть 6.5 4.5 3.5 3.0 2S50 2614 2420 1920
Теплоты гидратации ЭО. ккал / моль•*. 。 5.4 8.9 15.8 20 г)24.5 Растворимость при 20°C E (OH )a моль / л. 4 » l0 — * 2. Ю-4 2-10— * ’MO’ 1 Диссоциация Хофштадтера Иона Эона…. S 10 9 0.003 0.04 0.15 0.20 Из-за высокой температуры гидратации BaO этот оксид используется для объединения с водой для получения абсолютных (безводных) спиртов. Его кристаллы с 0,1% избытком бария красного цвета (§ 2 add.73).
48) выраженное испарение оксидов щелочноземельных металлов происходит только при очень высоких температурах(в случае САО, T. Bp. It оценивается, что 2850 * с). В сериях Ca-Sr-Ba летучесть оксидов возрастает, а испарение сопровождается диссоциацией молекул на атомы. Для энергии такой диссоциации приведены следующие значения (, ккал / моль): 100 (САО), 97(СРО), 133 (Бао). Молекула BaO была изучена лучше, чем любая другая молекула, с ядерным расстоянием 1.94 A ’(2.76 A в кристалле).
Дипольный момент равен 8,0(это соответствует эффективному заряду±0,86 атомов в сарае и oxygen. It также ee±2, как получено из чистых ионных структур). Молекула SrO имеет 8,9 пар. 44) гидроксид E(OH) раствор IA обычно отделяют в виде Ba (0H) i-8H20. СР (0ч) а * 8ч | 0 и СА (он) J и Ю. Растворение самого гидроксида (и моногидрата Ca (OH) a) происходит с выделением тепла, в то время как растворение октагидрата сопровождается его поглощением(ккал / моль-、 С\О) и СР (О) Джей BdOHlt | СР <О) есть.8HaO. Ба (Охх-8хао +23 + ОТ +12.3 I-14Л-IW
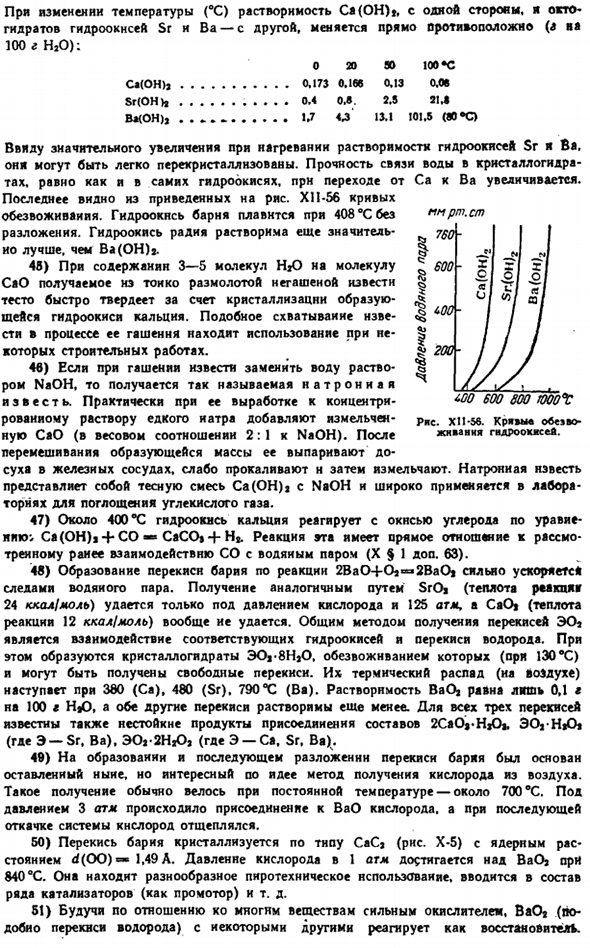
При изменении температуры (°с) растворимость Ca (OH)с другой стороны, растворимость гидроксидов Sr и октагидрата BAдиаметрально противоположна(a 100 г НАО): Около 20 «100 * C СА (он) Дж……….. 0.173 0.166 0.13 0.08 Старший (О…………. 0.4 0 Л. 2.5 21 Л. Ba (OH) 2………….. U O 13.1 101.5 (80 * C> Потому что при нагревании растворимость гидроксида Sr I Ba значительно возрастает. Он может быть легко перекристаллизован. Прочность связи воды в кристаллическом состоянии hydrates.
As с самим гидроксидом увеличивается переход от Ca к Ba. Последнее можно увидеть из того, что показано на схеме. Кривая обезвоживания XI1-56.Гидроксид бария растворяется при 408°C без разложения. Гидроксид радия более растворим, чем Ba (OH). 45) тесто, полученное путем измельчения мелко натертой негашеной извести, с содержанием 3-5 молекул HjO на молекулу САО, быстро твердеет за счет кристаллизации полученного гидроксида кальция.
Аналогичная установка извести в процессе тушения используется в некоторых строительных работах. 46) при тушении извести, заменяя воду раствором NaOH, используется так называемая содовая известь obtained. In дело в том, что при его разработке измельченный САО добавляют в концентрированный раствор гидроксида натрия (в массовом соотношении 2: 1 к NaOH).
После перемешивания полученную массу выпаривают в железной емкости до сухости, слегка прокаливают, а затем измельчают. Содовая известь представляет собой тесную смесь Ca (OH) j и NaOH, широко используемую в лабораториях для поглощения углекислого газа. 47) при температуре около 400°с гидроксид кальция вступает в реакцию с монооксидом углерода по формуле * — Ca(OH) i + co CaCOj-f Hj.
Эта реакция непосредственно связана с рассмотренным ранее взаимодействием со с водяным паром (X§ 1, доп. 63). 48) 2 bao-fO » образование перекиси бария по реакции 2BaOt значительно ускоряется следовыми количествами водяного пара. Получение СРО(теплота реакции 24 ккал / моль) аналогичным способом возможно только при давлении кислорода 125 АТМ, но CaOj (теплота реакции 12 ккал / моль) совсем не является успешным.
Распространенным способом получения пероксидов ЭО * является взаимодействие пероксида водорода с соответствующим hydroxide. In в этом случае образуется кристаллогидрат E0ya * 8H * 0, в результате чего происходит его обезвоживание (130°С) и высвобождение перекиси. Их пиролиз (в воздухе) происходит при 380 (Ca), 480 (Sr), 790°C (Ba).
Растворимость BaO составляет всего 100 г на 0,1 г NaO, а оба других пероксида еще менее растворимы. Для всех 3 пероксидов также известен нестабильный продукт с добавлением 2саоНЗО»соединения. 30j-Ht0″(е-SR и Ва), Еоа-2ч * ОА(е са, SR и Ва). 49) образование и последующее разложение пероксида бария основано на интересном способе получения кислорода из воздуха, который в настоящее время заброшен.
Такие приготовления обычно проводили при постоянной температуре около 700°С, кислород добавляли к Бао при давлении 3 атмосферы, а кислород отделяли во время последующей эвакуации системы. 50) пероксид бария кристаллизуется в соответствии с типом CaCa (рисунок X-5), а ядерное расстояние d(OO) составляет 1,49 A. существуют различные пиротехнические применения, и многие катализаторы вводятся (в качестве ускорителей).
51) потому что это сильный окислитель для многих веществ, BaOa (как перекись водорода) реагирует с некоторыми другими при отталкивании. мм ПМ. см Ширина 600600 ° C к 10.000°C Ряса. XI1-58. Криам обоэу-Цуй Вонг гидроксид. Именно таков характер взаимодействия с солями многих тяжелых металлов. Например, в случае хлорированной ртути реакция протекает следующим образом: HgClj-f BaOa = — Hg + BaCl,+ O.
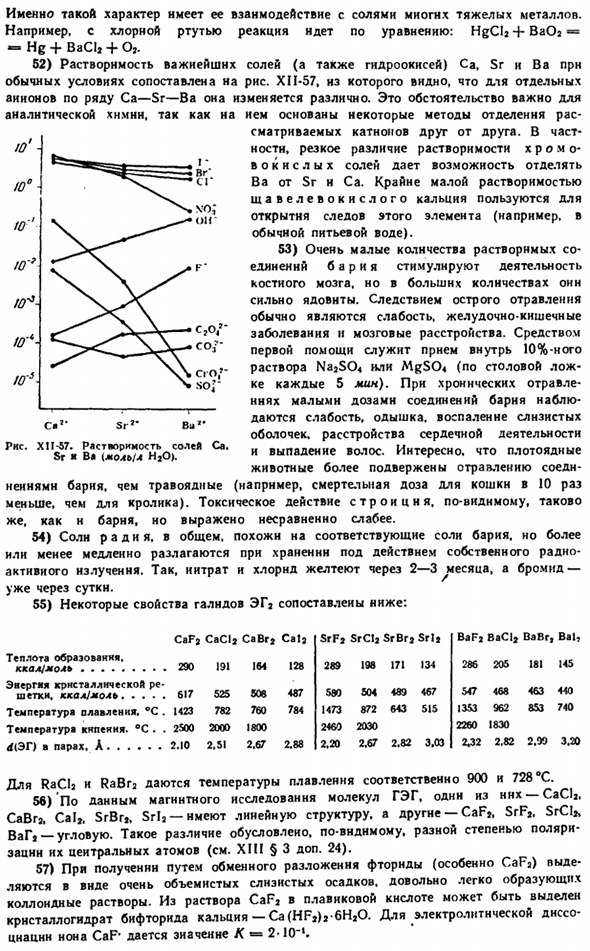
52) сравните растворимость наиболее важных солей (и гидроксидов) Ca, Sr и Ba в нормальных условиях на рисунке 5. Из XII-57 видно, что для отдельных отрицательных ионов серии Ca — Sr — Ba она изменяется по-разному. Эта ситуация важна для аналитической химии. Это неудивительно, поскольку несколько способов отделения рассматриваемых катионов друг от друга основаны на следующих принципах: it.
In в частности, из-за резкой разницы в растворимости хроматов можно отделить Ba от Sr n Ca. Очень низкая растворимость оксалата кальция используется для открытия следов этого элемента (например, в обычной питьевой воде). 53) очень небольшое количество растворимых соединений бария стимулирует активность костного мозга, но в больших количествах он очень токсичен. Острое отравление обычно вызвано слабостью, желудочно-кишечным заболеванием и повреждением головного мозга.
Первая помощь заключается в приеме 10% раствора NaaS04 или MgSO(по 5 столовых ложек каждые 1 минуту).При хроническом отравлении небольшим количеством органических соединений наблюдаются слабость, одышка, воспаление слизистых оболочек, нарушения сердечного ритма, выпадение волос. Интересно, что плотоядные животные более склонны к отравлению соединениями бария, чем травоядные (например, смертельная доза кошки составляет 10 минут 1 кролика).
Токсическое действие стронция, по-видимому, такое же, как и в сарае, но выражено оно так же слабо, как и несопоставимо. 54) соль радия в целом аналогична соответствующей соли бария, но при хранении она разлагается несколько медленнее под действием собственного радиоактивного вещества radiation. So, нитрат и хлорид пожелтеют через 2-3 месяца, а бромид пожелтеет через 1 день.
55) некоторые характеристики eg2 желез по сравнению со следующими: CaFa CaCI * CaBr, Ca / 3 SrFa SrCIa SrBra Srla BaF2 BaClj BaBr, Bal、 Тепло образования. ккал / моль…….. 290191164128289289198171134286205181145 Энергия кристаллической решетки. ккал / моль….. 617 525 506 487 580 504 489 467 547 468 468 463 440 Температура плавления. °C 1423 782 760 784 1473 872 643 515 1353 962 853 740 Температура кипения. °C 2500 2000 1800 2460 2030 2260 1830 4 (например) пара.
Один…… 2.10 2.51 2.67 2.88 2.20 2.67 2.82 3.03 2J2 2.82 2.99 3.20 Для RaCb и RaBra температура плавления составляет 900 и 728°C соответственно. 56) согласно магнитному исследованию молекулы GEG, 1 из nnh является CaCU. Дики, Коэф. Србрт. Срла — имеет линейную структуру, а другие-кафт, СРФ, Сркла, Вага-угловой тип. Это различие, по-видимому, связано с различием в степени поляризации центрального атома (XIII§ 3 add.24).
57) при получении путем обменного разложения фториды(особенно CaFa) выделяются в виде очень крупных слизистых отложений, образуя коллоидные растворы очень легко. Кристаллический гидрат плавиковой кислоты Ca (HFa) 2 6HaO можно отделить от раствора плавиковой кислоты CaFa. In случай электролитической диссоциации не-CaF-β, величина K = = 2 — 1 дается. Диаграмма XII-57. Растворимость солей Ca. СР Ба (молится НАО).
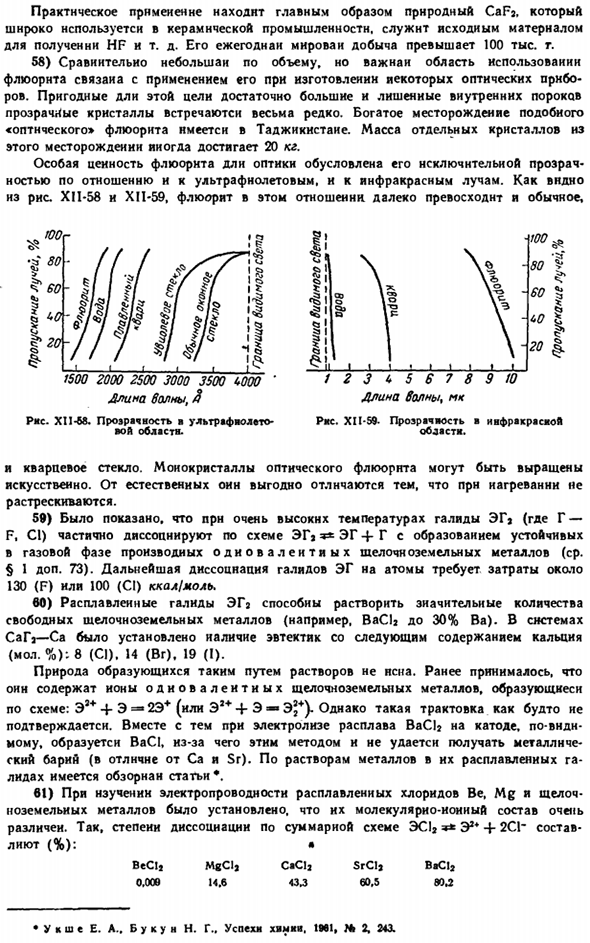
Практические применения главным образом в естественном CaFa. It широко используется в керамической промышленности и служит исходным сырьем для производства таких изделий, как ВЧ. Годовая выработка больше чем 10 миллионов тонн. 58) относительно небольшая, но значительная область применения флюорита отчасти связана с его использованием в производстве оптических приборов.
Прозрачные кристаллы, достаточно крупные и без внутренних дефектов, пригодные для этой цели, встречаются крайне редко. Аналогичное поле обилия» оптического » плавикового шпата встречается и в Таджикистане. Масса отдельных кристаллов из этого месторождения может достигать 20 кг. Специфическая ценность флюорита для оптики обусловлена его исключительной прозрачностью как в ультрафиолетовом, так и в инфракрасном диапазоне rays.
As как видно из рисунков XII-58 и XI1-59, флюорит в этом отношении намного лучше обычного. 3 < > 5 6 7 длин волн, МК Арена волна, 3 Рисунок XI 1-M. прозрачность ■ УФ. Рисунок XII-S9-прозрачность и инфракрасное излучение. С кварцевым стеклом. Монокристаллы флюорита можно выращивать искусственно. Они выгодно отличаются от натуральных тем, что не трескаются при нагревании.
59) при очень высоких температурах показано, что галогенид EG * (Γ-F, C1) частично диссоциирует по схеме EG * t EG-f G, что приводит к образованию моновалентного производного щелочноземельного металла, стабильного в газовой фазе (см.§ 1 на 73). ) Например, дальнейшая диссоциация галогенидов на атомы требует расхода около 130 (F) или 100 (CI) ядер/ moi. 60) расплавленный галогенид EHZ может растворить значительное количество свободных щелочноземельных металлов (например, BaClj до 30% Ba).
В системе CaG » — Ca было подтверждено наличие эвтектики следующего содержания кальция (map%): 8 (CI). 14 (Бр). 19(я). Природа решения, сформированного таким образом, не является кругом. Ранее предполагалось, что оин содержит нещелочные щелочноземельные металлы E3 * + E = » 2E *(или Ea * -f E-E]), образованные по схеме.
Однако такое толкование, по-видимому, не подтверждается. Но во время электролиза расплава BaCl? BaC1, очевидно, образуется на катоде, поэтому этот метод не приводит к получению металлического бария (в отличие от Ca и Sr).О металлическом растворе расплавленных галогенидов есть обзорная статья. 61) исследуя электропроводность расплавленных хлоридов be, Mg и щелочноземельных металлов, мы обнаружили, что их молекулярно-ионный состав очень different.
So, степень диссоциации по суммарной схеме ES1 * E2 * + 2C1 равна (% ). Бек! Mgclj Сасl2 SrClj BaClj 0.006 м. 6 433 60.5 90.2 •У Ш. Е. .. Б У К Н Н. Г.. Достижения в области химии. 1961, м. 2, 243. Эти данные связаны с плавлением при температуре плавления соответствующей соли. Они показывают, что даже в первом приближении практически невозможно рассматривать расплавы солей, состоящие только из ионов (см. V§ 8, доп. 16). *
2) хлорид, бромид и йодид щелочноземельных металлов обычно отделяют от растворов, содержащих 6 (Ca, Sr) или 2 (Ba) молекулы H20.Многие из них тают на воздухе и хорошо растворяются в спирте. Оба последних свойства усиливаются с помощью BA-Sr-Ca и CI-Br-I series. In кристаллический гидрат EGU6NgO (E = Ca, Sr, G = CI, Br), структура G2 1E (OH2) была установлена методом рентгеноструктурного анализа.
Безводные соли получают медленным нагреванием кристаллогидратов до достаточно высокой температуры (в случае CaCl2 выше 260°C).При быстром нагревании происходит частичное удаление свободной галогеновой кислоты. Хлорид кальция легко образует пересыщенный раствор. 63) из-за гигроскопичности безводный CaCU часто используется в качестве осушителя, а его кристаллический гидрат используется для приготовления хладагентных смесей со снегом, и этот раствор используется для полива дорог для удаления пыли.
Последнее опять же основано на гигроскопичности CaClj. Поэтому обводненная дорога еще долго будет оставаться мокрой. Медицинское применение раствора хлорида кальция очень разнообразно (я внутривенно).Хлорид бария используется для борьбы с вредителями в сельском хозяйстве и в качестве важного реагента в химических лабораториях(на СОИ). 64) раствор CaClj иногда используется в качестве жидкости для поддержания равномерных высоких или низких температур.
Сравните температуру кипения и температуру замерзания в зависимости от концентрации. 41.5 60.0 101 137.5 178 222 268 292 11012013014001501650170175 10 15 20 25 30 32.5 −5.9-11.0 −16.6 −29.9 −48.0 −51.0 65) обработка ГАЛОГЕНИДА EG2 водяным паром приводит к высокотемпературному гидролизу. Минимальная температура, чтобы стать выдающимся (C) j CaClj SrClj BaClj Дж SrBrj CaBrj Б»Бк2 423640970 я 348443640
Таким образом, сопротивление галогенидов действию водяного пара в серии Ca — Sr — Ba значительно повышается. 66) путем сплавления галогенидов и гидридов щелочноземельного металла (900°С в атмосфере водорода) можно получить эндгароид ENG nx (G-CI, Br, I).Это бесцветные кристаллы, похожие по внешнему виду на слюду (из-за тонкой сети трещин они выглядят темными в толстом слое).
При 660-860 ° С (например, 700°С CaHCI) эти кристаллы начинают разлагаться без разложения, бурно реагируют с водой и сразу же превращаются в белый диффузионный порошок на воздухе. 67) для солей щелочноземельных металлов, таких как галогениды, необходимо отметить nh-азид-3 (Nsh) и роданид-3 (NCS) j-3HaO. Решетка (ккал / моль): 517 (Ca).494 (Sr), 469 (Ba).516 (ПБ).Род и Иды * легко обезвоживаются при нагревании.
Растворитель (спирт, ацетон и др.) можно получить путем обмена роданда с азидом многих других металлов, используя соли бария (обменные сульфаты разложения HX). 68)нитрата кальция и нитрата стронция, как правило, кристаллизуется в 4NaO. При нагревании до 100°C, это легко dehydrated. In подача азота, безводный нитрат термально стабилизирована до 455 (Ca). 480 (Ср). 495°С(БА). РН расплава Ca (N03) I-4H20 составляет 5,15(при 75°C).
Отличительной особенностью нитрата бария является медлительность раствора. Его хрустальный оскал. При переходе от Ba (NOj) a к Ra (NOs) a растворимость незначительно возрастает(в нормальных условиях на 100 г NaO приходится соответственно 9 и 14 г). Константы диссоциации ионов 3N0 * составляют: 0,31 (Ca), 0,54 (Sr) и 0,94 (Ba). Только нитрат бария, где известен неустойчивый комплекс Kz [Ba (MOe)«], проявляет тенденцию к комплексообразованию.
Нитрат кальция хорошо растворим в некоторых органических растворителях (спирте, ацетоне, метилацетате).Нитрат стронция в них очень растворим, а нитрат бария практически нерастворим. cc) для температуры плавления нитратов задается значение около 600°С, но примерно при той же температуре начинается их пиролиз. Во-первых, IAH преобразован к соответствуя нитриту, и когда раскаленное добела будет сильным, оно ломает вниз в EO, которое производит окиси азота.
Полный распад происходит только при достаточно высокой температуре. В серии Ca-Sr-Ba, термическая стабильность нитратов несколько улучшена. 70) пиротехнический состав, который инкрустирует при горении пламени яркие цвета его окраски или разные цвета, широко используется с целью размещения фейерверков и передачи сигнала. Ниже приведен примерный состав нескольких «огней».
Красный……….. 4 Weight. Me. KCIOj + P » она.«Я. S + 2 веса. В том числе уголь+ вес ZZ. Время Sr (N03) j Желтый……….. Вес б. Меня. Kpyuz + 3.2 вес. Меня. С + 3 Вес. Меня. Nycos. Зеленый……….. 9 weight. Me. KCIOj + 10 weights. Me. S + 31 » ec. Me. Ba <KOZ) 2 Синий………… 15 weight. Me. KCIOj + 2.5 ″ ec. h. S + 2 ac. Me. КАКСО ^ + 2 Weight. Me. (CuOHhCOj Фиолетовый……… 15 вес. Меня. KCIOj + 4 да. Меня. С + 3 Вес. Меня. KAKSO.) 2 + 3 Вес. Меня. Или так* Качество получаемого состава сильно зависит от степени сушки исходного материала, а также от тщательности их измельчения и перемешивания.
71) нитрат по составу близок к хлорату, бромату и даже щелочноземельным металлам. Растворимость в воде уменьшается в сериях Ca-Sr-Ba и CI-Br-I. So это (hjo при 25°С g на 100 г) Ca (CO«) при 195, Ba (IOs) при всего 0,04 A. константа диссоциации для non-BaClЮ*равна 0,20.Хлорат бария, выделяющийся из раствора в виде кристаллогидрата Ba (ClOj) a-HjO (120°С потеря воды), используется в пиротехнике.
72) перхлорат щелочноземельного металла * легко растворяется не только в воде, но и в некоторых органических жидкостях(VII§ 2, add.65).Наиболее важным из них является барий perchlorate. It выделяется из раствора в виде кристаллогидратов Ва (су<) а-знао. При вакуумной сушке (100-140 ° С) образуется пористая масса безводной соли, которая интенсивно притягивает влагу и позволяет использовать ее в качестве осушителя.
Преимущество в этом отношении состоит в том, что Ba (СУ4Ь приближается к негидрону (добавлено к § 1.61).после использования oy его можно регенерировать (но при нормальном давлении полное обезвоживание достигается только длительным нагреванием до 260°C). Ba (CI04h теперь выделяется только при 400°C. насыщенный раствор этой соли кипит при 140°C.
73) для продукта растворимости фосфата щелочноземельного металла показаны следующие значения: SbP04 SrHP04 BaHP04 I Ca «(P04B Sfs (P04)j Ba3 {P04B MO» * 7 6. KG «7 9-U * * 1 I MO-f * 4.10» * * 3.Значения i0- » Точки плавления Ca *(P04) a и Bas (P04) a составляют 1670 и 1730 * 0 соответственно. 74) малорастворимые оксалаты щелочноземельных металлов (РНС. XII-57) отделяется от раствора в виде кристаллогидратов.
Наиболее важным является NZ InC CaC, 04-ZNz0.It достигает 130°С с моногидратом, обезвоживается при 200 и разлагается на CaCOe и CO при 430°С. Для константы диссоциации солей щавелевой кислоты в растворе значения равны l-IO » 3 (Ca).3-U ’3 (Sr) и 5-10″(Ba). 75) ацетат щелочноземельного металла также выделяется в виде кристаллогидрата. Однако он легко растворяется в воде (20 г на HjO 100 г при T): −35 (ом.41 (Sr) и 72 (Ba).
Для константы диссоциации ESNCOO-ионов задано значение 0,17 (Ca). 36 (Sr) и 0,39(Ba). 7c) если вес равен 1. Насыщенный раствор Ca (СеСООЬ) быстро заливают в 17-весовую емкость, заполненную этанолом, и все жидкости быстро затвердевают. Полученный «сухой спирт» медленно сгорает в пламени для некурящих после зажигания. Это топливо особенно полезно для туристов. 。
77) за счет взаимодействия гидроксида и ацетил-ацетона (добавлено х§ 2.80), можно получить щелочноземельный металл ацетон ацетат-3(CsH70) 2.In в присутствии воды они выделяются в своих 2 молекулах, которые легко отделяются при нагревании комплекса в вакууме. Эти ацетоновые ацетаты практически нерастворимы в воде и почти нерастворимы в спирте. 78) растворимость в воде сульфатов щелочноземельных металлов при комнатной температуре приблизительно равна(моль / л): 8-10 «(CaS04), 5-10» 4(SrS04), MO «*(BaS04), b-10-4 (RaSO»).
Степень диссоциации растворенных молекул невелика(для CaS04,/ C = «5-10«’). Растворимость серной кислоты в серной кислоте гораздо выше, потому что она частично complezes. So концентрированный HjS04 растворяет до 10% BaS04.Соответствующие комплексные соединения типа 3S04-H2S04 также были получены в свободном состоянии. Двойная соль H, соответствующий комплекс кислот?/ 3 (S04h) сульфат натрия.
K. NH4 известен только для Ca и SR. относительно высокая растворимость (NH4) j (Ca (S04b), из Sr его соли гораздо менее стабильны и слабо растворимы в воде. 79) сжигание ГНПС для получения связующего обычно проводят при температуре, не превышающей 180°С. полученный продукт продается под названием обожженная (строительная) штукатурка.
Затвердевание гипсового теста сопровождается некоторым увеличением объема, что способствует приобретению хорошего гипса. При выпечке при 200 ° С и более образуется растворимая форма безводного Казота. И более 500 ° С — его нерастворимая форма не может быть использована в качестве связующего («мертвая штукатурка»), потому что он больше не прикрепляет воду. 80) основная соль состава * CaS04-yCa0(гидравлическая штукатурка) образуется при дальнейшем обжиге (900-1200 ° С), а при смешивании с водой вновь возникает затвердевшая масса.
Его затвердевание обусловлено добавлением воды и кристаллизацией материала, образующиеся кристаллы тесно переплетаются и сплавляются друг с другом, что приводит к большей механической прочности затвердевшей массы. Последние, однако, очень устойчивы к действию воды, перепадам температур и т. Гидравлическая штукатурка применяется в строительной промышленности для изготовления ступеней, оконных рам и др., и как вязание material.
It был известен египтянам 2000 лет назад. e. Nmn был использован в строительстве различных зданий. 81) в дополнение к другим видам применения природный гипс(еще лучше ангидрит) может быть использован в качестве исходного материала для производства комбинации серной кислоты и цемента. С этой целью мелкозернистая смесь калия и песка, угля и глины (и небольшое количество оксида железа, играющего роль катализатора в процессе) обжигается вращающейся цементной печью.
Сернистые газы, образующиеся при обжиге, используются при обработке серной кислотой, а твердые остатки дают цемент хорошего качества. 82) термическое разложение, подобное тому, которое наблюдается в CaS04, также характерно для сульфатов Sr и Ba. Однако это происходит только при более высоких температурах (в случае BaS04 это становится заметно примерно с 1400°C).Полученный осадок из раствора сульфата бария («пустая форма») широко используется как в минеральной лакокрасочной промышленности, так и в производстве некоторых видов картона и бумаги (особенно фото).
BaS04 нерастворим в воде и разбавленных минеральных кислотах, поэтому он не токсичен. Он сильно задерживает рентгеновский снимок в то же время, поэтому, когда его порошок суспендирован в воде, он дает пациенту ПНТ, прежде чем он станет прозрачным в желудке и кишечнике. 83) при взаимодействии BaSO с карбонатами щелочных металлов в твердом состоянии обратимая реакция BaS04 + CaCO3 * * EgEO * 4-BaCO3 устанавливает иное равновесие с водной средой(V§ 6, 7).
Интересно, что его расположение во многом зависит от характера щелочи metal. So при 700°С можно видеть, что соотношение[EaBOOL ^ COz]составляет 1,73 в натрии и 28 в Калуне (то есть оно увеличивается в 16 раз). 84) образование сульфидов 3S обычно является первым этапом технологической переработки природных сульфатов Ca. Sr n Ba и другие соединения. Уравнение реакции составляет около 900°С в соответствии с уравнением.
Например, CaSO + — СЗ + 86 ккал * CAS + coa + 2co. Сульфид КАС. Sr и^ Ba-белые твердые вещества, которые кристаллизуются в виде NaCl на ядерном расстоянии (A): 2.84 (Ca). 3.00 (Ср). 3.18 (Ба) и 3,29 (Ра). Теплота образования элемента NS и энергия кристаллического регистра равны (ккал / моль)> 110 n 722 (Ca). 108 N 687 (Ср). 106 и 656 (Ba).Ядерное расстояние (А) и энергия диссоциации(ккал! Для Mol) были получены следующие значения: 2.27 n 74 (Ca). 2.42 и 74 (Sr), 2.51 и 95 (Ba).
Дипольный момент для бас равен 10,9. 85) из рассматриваемых сульфидов CaS менее растворим в воде, чем другие(mp.2500°с).Насыщенный раствор, содержащий около 1 г солнечного света на 0,2 л в норме temperature. In раствор, нейтральные сульфиды щелочноземельных металлов гидролизуются практически полностью по схеме: 23S + 2HaO 3(SHh + 3 (OH) j. ) 2-6HaO. Гидросульфид кальция используется в медицине для временного выпадения волос (во время операции).
Для этого соответствующую часть тела покрывают NZ Ca (SH)*и глицерином в течение 5-10 минут. АСОК. 86) явление фосфоресценции хорошо наблюдается в сульфидах щелочноземельных металлов. Последнее заключается в том, что некоторые вещества, ранее подвергавшиеся воздействию освещения, продолжают некоторое время светиться в темноте. Сущность этого явления заключается в возбуждении электронов фосфоресцирующих веществ под воздействием внешнего освещения, а также их возвращении на низкоэнергетические уровни с последующей эмиссией.
Поэтому фосфоресценция-это, так сказать, накопление световой энергии. Способность светиться после предварительного освещения не присуща самому сульфиду кальция. СР н Ба. А твердыми растворами в них являются сульфиды некоторых тяжелых металлов. Чем больше такого сульфида содержится в твердом растворе, тем сильнее становится фосфоресценция. Однако растворимость сульфида тяжелого металла в расплавленном щелочноземельном сульфиде очень мала, поэтому его содержание обычно возрастает до 1: 10 000 и более.
Большинство светящихся композиций (другими словами,»люминофоров«) получают путем слияния смеси химически чистых возможных индивидуальных components. In кроме веществ, необходимых для образования сульфидов тяжелых и щелочноземельных металлов, в исходный состав обычно добавляют вещества («атавни»), которые служат только для снижения температуры плавления смеси.
Например, для получения фосфоресцирующего ярко-зеленого цвета можно использовать SrCO 40 г, s 6 г. 1 г as — > mix Ss. 1 г» 1 л » раствора CO3 и 2 Ил T1COe (1: 200) и нагревают полученную смесь до 1200°C в течение 1 часа. hour. In эта формулировка, As2S3 и LiaCOj играют роль потока. Хороший светильник, светит очень ярко, а продолжительность свечения измеряется в часах. Это основа для производства люминесцентных красок для покрытия различных ночных сигналов, на Perl мосты, барьеры и т. д. Есть монография * о люминофорах. 」 * Марковский Л. Я. От P s до r s и m <! сказал он.
M prostosina L. II. Л. «Химия». 1066.231 секунд 87) в воздухе, сульфид щелочноземельного металла oxidized. By пропуская воздушный поток через водную суспензию CaS по реакции, получают 2-CAS 4-HjO + 20 * » =»-CA (OH) t-fCaSjOj тиосульфат кальция. OI очень растворим в воде. Стронций, переходя в порядок бария, значительно снижает растворимость тиосульфата (VIII§ 1 add.76).Значения констант диссоциации в растворе составляют MO * *(Ca), 910эe (Sr) и 510 * (Ba). 88)в дополнение к обычным сульфид, полисульфид КАС, SR и BA в состав 3С известны.
Распространенным способом получения является кипячение раствора (или суспензии) сульфидов или гидроксидов щелочноземельных металлов в избытке серы. Из полученной красной жидкости в кристаллическом виде выделяются главным образом тетрасульфоновые соли hydrates. An примером этого является красный BaS4HjO (растворимость 15 г для 100 e HjO при 41°C). Переход от Ca к Sr и Ba улучшает стабильность polysulfide. In в безводном состоянии он вообще не получается про кальций. Также в стронции и валиуме известны члены ряда (и желтый SrSt) от 3S до 3S4.
Температура плавления была определена для BaS>(925°С), BaSs (554) и BaS4 (300).Плавление этих соединений сопровождается разложением. Раствор полисульфида кальция используется в кожевенной промышленности для удаления волос с кожи. 80) обычные сульфиды щелочноземельных металлов, состав которых аналогичен 3se церидам и ETe тедроиду, кристаллизуются в виде NaCl на ядерном расстоянии (а): 2,96 n 3,18 (Ca), 3,12 и 3,32 (Sr) 3,31 и 3,50 (Ba) соответственно.
90) карбонат стронция и карбонат бария образуют кристаллогидраты, а кальций, как известно, является практически нерастворимым в воде нестабильным кристаллогидратом CaCOs«6HiO. It интересно отметить, что около 90%карбоната кальция имеет перламутр и его наиболее ценный вид-жемчуг(остальное состоит в основном из органических связующих).
Энергия активации термического разложения CaCO $составляет 51 ккал / моль. Для термической диссоциации SrCOi и BaCOj требуется температура, значительно превышающая температуру CaCO(примерно при 1200 и 1350°C соответственно достигается давление COj в 1 атм).При достаточно высоком давлении со (например, длина 60 атм SrCO$) карбонат щелочноземельных металлов растворяется без разложения. В этих условиях их температура плавления составляет 1360 (Ca), 1497 (Sr) и 1740°С (Ba). 91) измельченный натуральный мел часто добавляют в различные пирожки. Особенно.
Оконную замазку готовят по 4 весовых раза мелом 1 вес и тщательно перемешивают. Включая сушку oil. To изготавливают зубную пасту, используют искусственно приготовленный («осажденный») мел. Использование натуральных продуктов в этом случае осуществляется с твердыми остатками оболочки (РНС.1В-26), что приводит к быстрому разрушению, поэтому недопустимо. 92) из-за сложности термического разложения карбоната бария, получение оксидов из карбоната бария обычно осуществляется путем его тления в угле.
Реакция протекает по формуле. BaCO «+ C + 104 ккал = ■ » 2CO-f BaO. Если процесс проводили при 800°С с потоком азота, то по уравнению BaCO $ 4-4C + Nj =ЗСО+ BA (CN) A образуется цианид бария (MP 600 ° C).Последний очень хорошо растворим в воде (примерно 1: 1 по массе) и может быть использован для получения растворимого цианида других металлов(путем обменного разложения с сульфатами).Карбонат бария также используется для уничтожения мышей и крыс. *
3) при производстве цемента, компилирует смесь тонкоизмельченного бурого угля и богатого SiO в нужных пропорциях? Глина-это специальная вращающаяся печь (rns. It выпекается перед спеканием при температуре (XI1-60) (1400-1500°C).Последняя представляет собой слегка наклонную стальную трубу, облицованную огнеупорными кирпичами диаметром в несколько метров и длиной в несколько десятков метров. Печь расположена на ролике и приводится в движение медленно вращающимся двигателем. motor.
In в верхнюю его часть непрерывно вводится исходная смесь, которая постепенно продвигается вверх, так что она все больше и больше прогревается теплом горения Газовая печь (или угольная пыль). Выпеченный продукт (цементный клинкер) полностью измельчается после охлаждения. Исходную смесь искусственно приготовленного известняка и глины часто заменяют натуральными Мальтезерами подходящего состава. 94) производство цемента сопровождается огромным удалением пыли выхлопными газами (около 10% от массы сырья). чтобы избежать загрязнения воздуха, эта пыль может быть поймана в электрический пылеуловитель (X§ 5 add. 41).
Bo3Bpat ct в производстве Рисунок XI1450. Чартерная схема та «по цене производства». Часто это оказывалось нецелесообразным (из-за ухудшения качества производимого цемента).Состав цементной пыли отдельных растений несколько отличается, но часто она имеет большое содержание солей и служит ценным минеральным удобрением. 95) состав цемента обычно выражают в процентах от массы оксидов, содержащихся в цементе (в основном CaO, SiO*, AljO и Fe, Os).
Первая Яя будет играть роль основы цемента, остальные будут играть роль кислотного ангидрида. Весовое соотношение Ca O / (S iOj-f A Ij03 + Fe * Os) и название цементного гидравлического модуля хорошо характеризуют его технические качества. Количество Гидромодулей обычного (силикатного) цемента колеблется в пределах 2.Результаты анализа образца приведены ниже(мас.%): Теплопотери 2 ■ нерастворимый co.
Остаток нсl…… 0.5 Цао. ………. Шестьдесят три МГО……….. / , с Сиой……….. Двадцать два Алао«……….В Ф «l03……….. Три NajO + KjO …….. 0.С в so3………… И. С 96) силикатный (он же Portlaids * ost) минеральный состав цемента^ Т! Он главным образом состоит из Ca3SlOi, Ca2SiO», СА3 (АУ») 2 и частично Калифорния (Фео*) И. его приступы вызваны, главным образом, схема Ca3SiO + ЗН 0 — * * CajSiO » — 2HjO-Са (он)я, Ка ^ 10-4 + 2HaO-CiaSi04-2Hi0, СА3 (А10),+ bHxO — = СА3 (AI03)Джей-6IIa0 и CA (FeOa),+ р-р — ^ ка (САА) я -.После начальной установки, прочность цемента будет продолжать постепенно увеличивать в течение 1 месяца.
Основная причина этого, по-видимому, заключается в том, что процесс гидратации распространяется глубоко внутри частиц цемента. 97 ) кроме силикатов широко распространен глиноземистый цемент примерного состава (% ): 40 САО. 40 AI3O3, 10-15 FejOj и 5-10 SiOj. Основными соединениями, образующими этот цемент, являются различные алюминаты кальция, главным образом Ca (A103) G. процесс отверждения происходит в основном за счет одновременного выделения гидроксида алюминия и гидратации алюмината металла по схеме.
Например,^2Са (aloj) I + 10hto — «cataljoi-7h2o4-f2ai (oh) 3. 98) при использовании цемента в качестве строительного материала на цементной основе его обычно смешивают с песком (несколько частей на 1 часть цемента).Часто, известь также добавлена к mixture. In помимо этих добавок, которые в первую очередь помогают снизить затраты на строительство, иногда используются специальные добавки.
Например, введение в цемент так называемых гидравлических добавок (кремнеземных материалов, таких как трепел) повышает устойчивость к действию морской воды, а введение CaCl способствует затвердеванию и затвердеванию цемента (за счет образования ОКСОХЛОРИДА кальция).Поверхность гидроизоляционного цемента покрывают раствором Mg (SiFe) или Zn(SiFe): при взаимодействии САО с этими веществами образуются Кафа и кремниевая кислота, подобные фекалиям, которые полностью закупоривают поры затвердевшей массы.
99) цемент также широко используется в производстве самостоятельных строительных материалов, бетона. Последний представляет собой смесь цементного теста с песком природного и искусственного происхождения и мелкодисперсным порошком камня (гравий, щебень, кирпичные черепки и др.).Хорошо перемешанная бетонная смесь помещается в форму и отверждается. Очень часто железные каркасы предварительно устанавливаются в интерьере этих форм. Благодаря этому бета-пластины имеют примерно одинаковый коэффициент теплового расширения и прочно прилегают к нему.
Такие конструкции называются железобетонными. 100) кальций заменен на Валиевый бетон («Валиевый бетон») используется в строительстве защитной футеровки ядерного реактора. reactors. It интересно, что очень механически прочная монолитная бетонная масса оказалась очень чувствительной к радиоволнам. Когда пучок волн длиной 5кт с выходом генератора 12,2 см был облучен, он треснул почти мгновенно.
Этот способ дробления бетона имеет огромное преимущество перед механическим методом. 101) можно получить хороший искусственный кровельный материал в виде тонкой черепицы путем прессования под давлением смеси цементной ткани и асбеста (около 20%) — т. е. Шифер. В отличие от железа, шифер плохо переносит тепло и требует покраски. Его недостатки относительно хрупки. 102) имеются признаки возможного выделения Ca (HCOe) из раствора, насыщенного углекислым газом при pressure.
At в то же время было замечено, что таким образом были получены бикарбонаты стронция и бария. 103) твердость как карбонатов воды, так и карбонатов оценивается по общему количеству миллиграмм эквивалентов Ca и Mg, содержащихся в 1 литре (мэкв / л).За рубежом мы используем условную «жесткость», значение которой варьируется в отдельных странах (1 mEq (l эквивалентно немецкому 2.8, английскому 3.5, французскому 5 или американскому 50). Сумма временной и постоянной жесткости определяет общую жесткость воды. Последний характеризуется этой особенностью следующих названий: мягкий (<4).
Средняя жесткость (4-8).Жесткий (8-12), очень жесткий(> 12 мэкв / л).Жесткость отдельных природных вод значительно different. In в случае открытой воды, это часто зависит от сезона и погодных условий. Самая «мягкая» природная вода-атмосферная (дождь, снег), почти не бывает melting. An интересным признаком является то, что болезни сердца чаще встречаются в районах, где есть мягкая вода. 104) NajPO, который осаждает кальций и магний в виде фосфата, который часто плохо растворим, часто используется вместо соды, чтобы полностью смягчить water.
In во многих случаях вполне разумно использовать гексаметафосфат натрия для смягчения воды(IX§ 5 дол.42).Эту соль также можно использовать для удаления уже образовавшегося слоя накнпн. 105) для очистки чайника от накипи было рекомендовано промыть раствором соляной кислоты, содержащим уротропин (1 таблетка на литр). в то же время уротропин, который продается в аптеках, играет роль ингибитора, препятствующего действию кислот и металлов в чайнике.
106) умягчение воды осуществляется очень эффективно с использованием органического ионообменника (X§ 2).75). Замена катионов Nl Hl-CA-и Mg-и Na-ca-ca по сравнению с искусственным алюмосиликатом цеолитного типа, используемым в той же цели (X§ 4, добавлено.52)и others. In кроме того, органические катоноиды имеют много преимуществ, таких как большая абсорбционная способность. Размножение использованных катионов осуществляют путем последующей обработки NaCl или HCl, сильным раствором воды.
Функция выполнения полной очистки при необходимости воды от растворенных солей. Это важно, например, для паросиловых установок с высокими параметрами (v§ 2 add.26). 107) образование бикарбонатов Ca (n Mg) в речной воде за счет поглощения углекислого газа из атмосферы играет важную роль в процессе перераспределения солей на поверхности Земли. surface.
It подсчитано, что около 6 млрд г кальция в виде бикарбоната и карбоната ежегодно вносится в океан РГК. Если бы образование относительно хорошо растворимых бикарбонатов не происходило, то их количество было бы меньше, чем в сравнении. Ca (HCOj) * войдите в океан. Именно поэтому он не сохраняется в морской воде (за исключением очень глубоких слоев).Под влиянием различных activities. It это в основном микроскопические и мелкие организмы, которые разлагаются на CO2.
Помимо H20 и CaCO3, обычные карбонаты используются живыми организмами для строительства известковых раковин (раковин, раковин). по крайней мере, как замечательно проделана работа по извлечению кальция, например, из того факта, что устрицы, которые делают моллюсков, должны пропускать через организм примерно в 5 миллионов раз больше воды собственной массы. Обычно, наряду с CaCO3, раковины морских организмов содержат небольшое количество карбоната магния (в среднем около 1% — до 13% у некоторых видов).
После гибели организма судьба известковой оболочки может быть иной. Некоторые из них снова растворяются под воздействием углекислого газа, который содержится в морской воде, а другие, гораздо более крупные, оседают на дне не очень глубоких мест sea. In в огромных оболочках, накопленных веками, медленный процесс разрушения связующей органики прогрессирует, а основа остается. Морская вода, содержащая CO2, постепенно вымывается из этих отложений, которые в основном содержат CaCO3, в котором накапливается MgCO3, а иногда образуются огромные горные массы доломита[CaMg (COsb) или магнезита[MgC03].
В результате геологического смещения земной коры некоторые из этих отложений поднимаются на поверхность Земли или погребаются под слоем rock. In в последнем случае CaCO3 под высоким давлением медленно закрывается, постепенно превращаясь в мрамор. Вода, протекающая через глубокие слои Земли, насыщенная углекислым газом, встречает на своем пути известняковые отложения, превращает значительное количество CaCO3 в бикарбонат и уносит его в растворенном состоянии.
На протяжении многих веков таким образом может образоваться огромная подземная полость. Когда он выходит на поверхность, вода, насыщенная бикарбонатом, теряет большую часть CO*, и выделяется CaCO3, часто образуя красивый Nene. Основным направлением современной геохимии кальция является непрерывный переход его природных условий-переход от его Нанокремниевого соединения к накоплению carbonates.
At на первом этапе такого перехода происходит выветривание горных пород, а на втором этапе-превращение карбонатов в бикарбонаты и миграция последних в океан. Оба эти процесса, приводящие к диспергированию кальция, не имеют прямого отношения к органическим организмам. Напротив, заключительный этап перехода тесно связан с морской концентрацией кальция из моря: кажется, что все естественные накопления карбоната кальция можно считать обусловленными привычным образом жизни морских организмов.
Смотрите также:
| Бериллий и магний | Подгруппа цинка |
| Кристаллы | Первая группа периодической системы |

