Оглавление:




















































Семейство железа
- Железная семья. Среди всех 3 членов этой семьи наиболее распространенными элементами являются РЕСО itself. It составляет около 1,5%от общего числа атомов в земной коре. содержание кобальта в n-Никеле (0,003%) (0,001%) уже несравнимо меньше 1-9 Большая часть железа в верхних слоях Земли в виде оксигенатов, и наиболее важных промышленных руд этого металла Lomont (FeiCVHiO), гематит (FejOj) и магнетита (Fe203-Фео).
- Кроме того, накопление железа встречается в виде железной руды (FeCOj), и в соединениях серы и мышьяка. Для кобальта и никеля наиболее характерным является их совместное присутствие в виде последних 2 элементов (и частично сурьмы). Десять Среди элементов семейства Fe само железо, основа всех современных технологий, обладает абсолютно исключительной практичностью value. To характеризуя его особую роль, достаточно отметить, что мировое ежегодное потребление железа составляет более 5 миллиардов граммов.
Минералы типа 3S, 3As2 и 3AsS, например, Пентланд (FeS-NiS) и кобальт (CoAsS) Людмила Фирмаль
Потребление никеля значительно меньше, а кобальта еще меньше. Оба последних элемента в основном используются в составе различных сплавов с другими металлами, в частности с железом. Двенадцать Железо выплавляют из руды в специальных вертикальных Печах высотой до нескольких десятков метров, оборудованных внешней оболочкой из стали и футеровкой из огнеупорного кирпича. Эти печи называются доменными печами («домны«).Его производительность достигает 1 млн тонн металла в сутки.
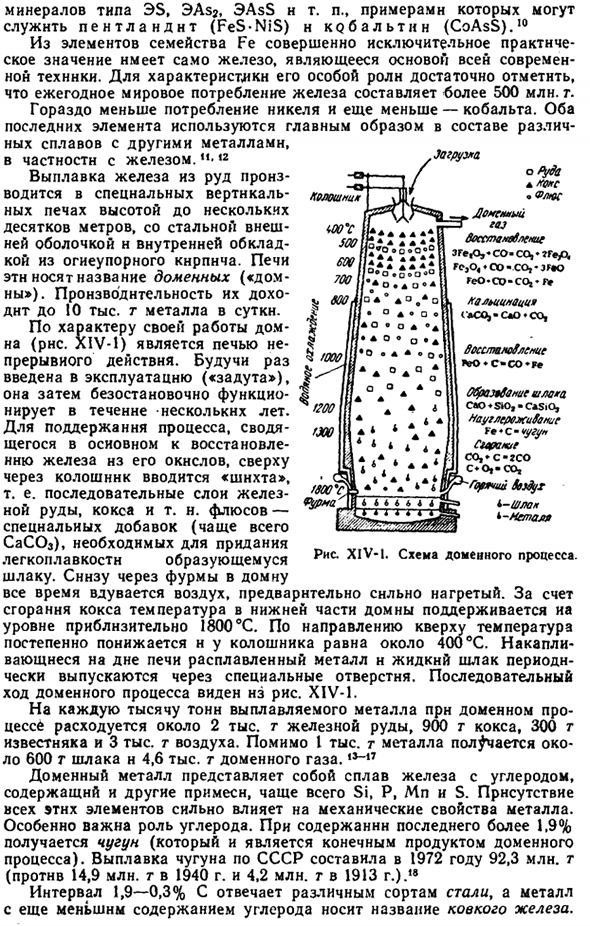
Доменная печь (рисунок XIV-1) является непрерывной печью, что обусловлено характером ее работы. Когда вы начнете работать («удар»), он будет функционировать без остановки в течение следующих нескольких years. To поддерживают процесс, который в основном сводится к восстановлению железа из его оксида, «шихту» вводят сверху донизу, то есть в непрерывный слой железной руды, кокса и др. Флюс-это специальная добавка (чаще всего CaCO3), которая необходима для придания плавкости полученному шлаку.
Снизу через фурму в доменную печь постоянно вдувается воздух, который раньше был очень горячим. При сгорании кокса температура в нижней части доменной печи поддерживается на уровне около 1800°С. По направлению к верху температура постепенно понижается, а наверху она равна примерно 400°С. расплавленный металл и жидкий шлак, накопленный на дне печи, периодически отводятся через специальные отверстия. Последовательный ход доменного процесса можно увидеть на диаграмме. XIV-1.
В процессе доменной печи расходуется каждая 1000 тонн рафинированного металла, около 2000 тонн железной руды, 900 тонн кокса, 300 тонн известняка и 3000 тонн воздуха. Кроме 1000 тонн металла, производится около 600 тонн шлака и 4,6 тыс. тонн доменного газа. Доменный металл представляет собой сплав железа и углерода, содержащий другие примеси, чаще всего Si, P, Mn и S. наличие всех этих элементов сильно влияет на механические свойства металлов. Роль углерода особенно важна.
При содержании последнего более 1,9% получают чугун (это конечный продукт доменного процесса).Выплавка чугуна в СССР в 1972 году достигла 9230 млн тонн (в 1940-1490 млн тонн, в 1913-420 млн тонн). Диапазон 1,9-0,3%С соответствует различным сортам стали, а металл с более низким содержанием углерода называют пластичным железом. Джа Шара. A ’ o ’ S Flos Месье Рагги.
Все sstamvbkni *ЗГе, 0, * со-СО,*? Г»уО|, ге, о,♦СО•СО,•JГ»oGeO. Ко-ко, ’ f> Кортинотти」 (aCOJ-СЛ * СО、 Восстание ♦С-Ко * Фе Ропропропропропропропропропропропропропропропропропропропропропо «♦S-чугунный удар.? Так, «с-ГСО с» о, — так、 — Grunchy ЗБ б-шл * металл* Я тоже адррес kolosh. ф у * °З * О О ИИИ° * °* | Вт * АО®О * а ^ / LLC II * О * О * АА•о• В F 200 A 4 * интерфейс FXO / 3009C Вт• 4 * Дж Вулканический туф Рисунок XIV-1.Схема доменного процесса.
Чугун, как правило, не поддается ковке или прокатке, потому что он твердый, но хрупкий. Главным образом использованный для отливки частей тяжелого машинного оборудования(кровати, маховика, ЕТК.).Сталь очень твердая и в то же время гибкая.
Поэтому его применяют при изготовлении всех конструкций и отдельных деталей, требующих особой прочности. Ковкий чугун отличается своей мягкостью и легко поддается механической обработке. Затем кровельное железо, проволока, гвозди и т. д. будет подготовлено 19 Для снижения содержания углерода в чугуне, полученном доменным способом, в него обычно добавляют оксид железа и выдерживают при высокой температуре на воздухе stream.
In в этом случае углерод (и большинство других примесей) выгорает, и в результате образуется сталь или ковкое железо. Обычное введение Углеродистая сталь с примесями других элементов получает различные марки легированной стали, которые удовлетворяют самые разнообразные потребности машиностроения. Обычно выплавка стали превосходит выплавку железа.
Это связано с выплавкой железного лома в больших количествах железа. Выплавка СССР в 1972 году достигла 1 миллиарда 2600 тысяч г (в 1940 году 1830 тысяч г, в 1913 году 420 тысяч).Два»-* В химически чистом состоянии железо, кобальт и никель получают восстановлением оксидов водородом или электролизом солевых растворов. Все 3 элемента-блестящие белые металлы с сероватым (Fe, Co) nln-серебристым (Ni) оттенком.
Сравните эти константы с: h Фе с Н1 Плотность, efcM * ……… 7.9 8.9 8.9 Температура плавления,°С…. 1536 1494 1455 Температура кнпенни. С….. 2770 2255 2140 Проводимость (Hg = l)… 10 15 14 Теплопроводность (Hg = l)…. 7 8 7 Железо и никель легко поддаются ковке и прокатке. Кобальт твердый и brittle. In в отличие от других металлов, Fe, Co и Ni притягиваются к магнитам. Благодаря своим химическим свойствам железо, кобальт и никель являются среднеактивными веществами metals.
In отсутствие влаги, в нормальных условиях, оно не реагирует замечательно даже с типичными металлоидами как о, С, ки, Бр, ЕТК. Однако при нагревании взаимодействие со всеми ними протекает очень активно, особенно если металл находится в основном состоянии.67-80 Co n Nf находится в серии напряжений между железом и оловом и расположен близко к олову. Поэтому оба металла растворяются в разбавленных кислотах медленнее, чем в железе. В РНС показана концентрационная зависимость скорости взаимодействия Fe с серной кислотой. XIV-2.
Сопротивление к серии FE — Co-Ni концентрирует hn03 уменьшает быстро. Сильные щелочи не влияют на все 3 элемента. По отношению к воздуху и воде стабильны кобальт, никель и химически чистое железо (в виде компактного металла).Железо при совместном действии, обычно содержащее различные примеси, наоборот Рисунок XIV-2. Взаимодействие железа и серной кислоты. Влага, углекислый газ и кислород воздуха будут разъедать.
То есть, он разъедает от surface. In в этом случае слой ржавчины, образующийся в Железном изделии, в основном состоит из водного оксида железа, и его состав примерно соответствует формуле Fe203-M20.Этот слой хрупкий и пористый, поэтому он не мешает металлу двигаться дальше rusting. As в результате коррозия постоянно выводится из обращения примерно с 30°V5 того количества Fe, которое добывается одновременно.
Примерно через 3 минуты 2 из этой суммы возвращается в производство в виде металлолома, но!/ 3, то есть 10% мирового производства безвозвратно теряется. Восемьдесят один Основной реакцией коррозии металла при контакте с водой или влажным воздухом является замена водорода, если железо протекает по схеме Фе + 2Н * = Фе «+ 2ч Помимо свойств самого металла и концентрации ионов водорода, скорость процесса сильно зависит от скорости, с которой равновесие этой основной реакции смещается вправо, за счет вторичной реакции, которая так или иначе связывает продукт.
Основная роль здесь принадлежит кислороду (растворенному в воздухе), который обычно растворяется в воде. water. In в частности, Fe * * окисляется им до Fe, а атомарный водород окисляется до H2O. As в целом, процесс железной ржавчины может быть представлен следующей формулой: 4Fe +2Н20 + 302 = 2 (Fe203 * Н20)
Чтобы уменьшить потери от коррозии, железные изделия стараются изолировать от воды и воздуха, покрывая их слоем масляной краски или металла, который устойчив в нормальных условиях. Именно поэтому чаще всего используется цинк («оцинкованное железо») или олово («луженое железо»).Также часто применяется никелирование-железные изделия покрываются тонким слоем никеля. Однако все эти способы защиты эффективны только в том случае, если целостность слоя покрытия не нарушена.
Поэтому их применение не приводит к полному удалению ржавчины, а только к задержке ржавчины на более или менее длительное время. В стабильных соединениях Fe, Co и Ni имеют почти исключительно 2 валентности и 3 валентности. Обе эти валентности имеют почти идентичные свойства по отношению к железу, но когда они проходят через кобальт, особенно никель, 2-я величина все больше отступает на задний план.
Производные других валентностей рассматриваемых элементов более или менее неустойчивы, а их практическая ценность значительно ниже. Кислородные соединения двухвалентных элементов семейства железа образуют ряд азотистых кислот общей формулы ЭО. Присутствующие здесь оксиды-черный FeO, серо-зеленый CoO и зеленый NiO-практически нерастворимы в воде и щелочах, но легко растворимы в кислотах.
При нагревании водородом они восстанавливаются до металла, и легкость такого восстановления в системах Fe-Co-Ni несколько возрастает. 1v2 ″ 183 Гидрат закиси азота (Fe), Co и Ni, соответствующий оксиду EO общей Формулы E (OH) 2, может быть получен только косвенно. Все они практически нерастворимы в воде и широко используемых растворах сильных щелочей, но легко растворимы в воде. acids. So, с химической стороны, рассматриваемые гидраты характеризуются своими основными свойствами. 11 Б. В. Искра.
Распространенным способом получения гидроксида е (он) 2 является взаимодействие раствора соответствующих солей Fe и его аналога с сильной щелочью. Большие количества осадков, образующихся в этом процессе-Белый Fe (OH) 2, розовый красный Co (OH) 2 и яблочно-зеленый Ni (OH) 2-существенно отличаются друг от друга по содержанию кислорода в атмосфере.
Ni (OH) i не реагирует, а Co (OH) 2 только медленно окисляется. Однако гидрат оксида железа вследствие реакции 4Fe (OH) 2 + O,+ 2H20 = 4Fe (OH) 3 Он быстро превращается в красно-коричневый гидрат оксида железа[Fe (OH) j].Промежуточным продуктом окисления является множество гидроксильных производных, окрашенных в грязно-зеленый оттенок (от бледного до почти черного), включая как 2-Е железо, так и 2-Е железо. Жидкий.)И* −1 *
Сильные кислотные соли, образованные двухвалентным катионом Е2 , почти все растворяются в воде, и раствор реагирует слабокислым гидролизом. 1Н, многие соли сравнительно слабых кислот, в частности анион СО | — и по? Производные, почти нерастворимые. Гидратированный E-Ион окрашен в бледно-зеленый (Fe), розовый красный (Co) и ярко-зеленый (Ni*) цвета.
Такой же цвет характерен и для кристаллических солей образуемых ими гидратов. Цвет соли разный, ее цвет не всегда совпадает с присущим ионам цветом Fe2 *(бесцветный), Co2 *(красноватый цвет), Ni2 *(желтый), но также зависит от природы аниона. Наиболее важной из рассматриваемых солей является FeS0 * — 7H20-так называемый сульфат железа. Его большие бледно-зеленые кристаллы, хранящиеся в воздухе, частично разрушаются, и железо постепенно окисляется, чтобы стать железным железом. 4FeS04 + 02 + 2H20 = * 4Fe (0H)S04
Аналогичное отношение к кислороду в атмосфере характерно и для большинства других солей оксидов железа, но соли кобальта и никеля в двухвалентной форме не изменяются под воздействием кислорода. Важная соль двухвалентного железа входит в состав комплексной соли двухвалентного железа-Hi [Fe (CN) eJ. Наиболее распространенным из них является ферроцианид калия, который хорошо растворяется в воде. K * IFe (CN) e] («желтая соль»). Переход по ряду Fe-Co-Ni приводит к уменьшению признаков 3-валентного состояния элемента.
Производные Fe2 *и Fe3 *почти одинаково многочисленны, как простые, так и сложные соединения. Что касается Co3*, то известно много очень сильных комплексов, но очень мало нестабильных простых солей. Наконец, для Ni3 *известна только одна комплексная производная, но ее простая соль недоступна. Из оксидов рассматриваемых элементов (общего типа ErO3) только FejO является стабильным в нормальных условиях. Коричневато-красный порошок оксида железа может быть получен обезвоживанием его hydrates.
In вода, Fe203 нерастворима. Некоторые из его природных разновидностей используются Они известны как минеральные краски (технические названия»охра»,»Мумия» и др.). В отличие от оксида E203, их гидрат E (OH) 3 получается для всех 3 элементов. Черный Ni(OH) 3 образуется при обработке Ni (OH) 2 в щелочной среде сильным окислителем, таким как свободный бром. 2Ni (OH)2 + 2NaOH + Br2 * =2№(OH) s + 2NaBr
Окисление гидрата оксида кобальта буровато-коричневого цвета до Co (OH) 3 уже протекает медленно под воздействием атмосферного кислорода. 4Co (OH)2 + 02 + 2H20 = 4Co (OH) s При взаимодействии обоих гидроксидов с кислотами происходит не образование солей Е8 *, а восстановление Со и Ni до двухвалентного состояния (в отсутствие окисляемых веществ) с выделением свободного кислорода. Водный оксид железа часто образует природные месторождения лимонита («бурая железная руда»).
Поскольку этот минерал обычно близок к формуле FeO (OH) (другими словами, Fe203-H20), он содержит меньше воды, чем обычный гидрат оксида[Fe (OH) 3, или Fe203-3H20].Последний получают в виде аморфного красновато-коричневого осадка щелочным осаждением раствора соли железа. В воде гидраты оксида железа практически нерастворимы(но они легко образуют коллоидные растворы).Разбавленная кислота быстро растворяет свежеосажденный Fe (OH) 3, в результате чего в результате реакции образуется соответствующая соль железа.
Поэтому гидраты оксида железа являются основными nature. In кроме того, он также проявляет слабые признаки кислотных свойств, так как замечательно растворяется в высокотемпературных концентрированных растворах сильной щелочи (не аммиака). 2.9 ″ 224″ Соль оксида железа может быть получена окислением соответствующей соли оксида железа Fe. Большинство из них очень хорошо растворимы в воде. Основные свойства Fe (OH) 3 очень слабо выражены, поэтому соль железа в растворе подвергается интенсивному гидролизу.
Основные соли, образующиеся в этом процессе, придают раствору производного Fe8 * характерный желто-коричневый цвет. Поэтому последний не соответствует уникальному цвету Fe-ионов. Fe-Ион (как в безводном Fe8 * Ионе) сам по себе бесцветен. Если добавить лишнюю кислоту, гидролиз ослабнет, и цвет раствора поблекнет. Среди рассматриваемых солей наиболее важным является хлорид железа, который обычно продается в виде желтого кристаллогидрата FeCl3-6H20.
Получают путем хлорирования раствора НС Фе! И он главным образом использован в продукции органических красок. FeCl3 * вызывает быстрое затвердевание белковых веществ, поэтому раствор иногда используют для остановки кровотечения с помощью небольшого разреза. В соответствующих солях щелочных металлов и солях аммония соли железа часто образуют бинарные соединения. Например, общая формула M [FefSOOJ * 12H20]представляет собой железные квасцы. Комплексообразование особенно характерно для многих слабокислых солей. Например, HCN производит h3 [Fe (CN) e), комплексную кислоту, синергичную с железом, и из ее солей ферритинид наиболее часто растворим в воде. И затем* Калий-KJFe (CN) e] («красная соль крови»).
Растворимые комплексные соединения трехвалентного железа и многих органических веществ также легко formed. It основан, в частности, на удалении пятен ржавчины из вещества с помощью лимонной кислоты. В безводном состоянии соли Fe3 * могут добавлять аммиак, но такие аммиачные комплексы полностью гидролизуются путем water. In напротив, 3-валентный аммиак кобальта очень стабилен, и желтый комплексный катион[Co(NHj) eP *образует хорошую соль со многими анионами, из которых простая соль не известна о Co3 *и кристалличности.
Замещая в нем аммиак другими нейтральными молекулами или кислотными остатками, образуются самые разнообразные комплексные соединения трехвалентного кобальта, большинство из которых стабилизируются как в твердом состоянии, так и в solution. An примером продукта полного замещения кислотного остатка аммиака [Co (NH3) e) 3f является комплексный анион[Co (Na2O3) c) 3″.в составе одновалентных катионов (кроме Li +и Na+) M3 [Co N02) — образование желтой калиевой соли используется для его открытия.
Из других валентных производных рассматриваемого элемента наиболее интересным является соединение шестивалентного железа. Когда бром окисляется, суспензии гидроксида железа (III) J не реагирует на высокие температуры, сильное Кох решение. 2Fe (OH) 3 + YUKON +ЗВг2 = 2k2fe04 + 6квг+8н20 Образуется темно-красная железо-калиевая соль (NgPeO*).
Обменное разложение с BaCl2 приводит к образованию красновато-фиолетового осадка малорастворимого оксида железа бария, соответствующего составу BaFe04-H20.Легко растворимая соль щелочного металла железистой кислоты гораздо труднее отделить 28°-281 Свободная железистая кислота и соответствующий ей ангидрид-триоксид железа (FeOj) — не были получены.
При подкислении раствора соли железа выделяется кислород, и железо восстанавливается до трехвалентного состояния. Все соли трехвалентной кислоты являются очень сильными окислителями. Например, он окисляет аммиак до свободного азота. 2K2Fe04 + 2NH4OH = 2Fe (OH) 3 + N2 + 4K0H Из вышесказанного видно, что почти все простые соединения Co и Ni являются производными двухвалентных элементов.
Наоборот, в случае с железом, государства и трехвалентных почти одинаково характерно. Поэтому необходимо кратко рассмотреть условия, при которых одно переходит к другому. Поскольку окисление или восстановление соответствующих соединений в твердом виде протекает только с поверхности, то есть очень медленно, ниже предполагается, что они находятся в растворе. Окисление производных железа протекает уже под воздействием атмосферного кислорода.
Большое значение для скорости процесса имеет реакция среды. Чем выше концентрация ионов водорода, тем медленнее oxidation. So например, раствор FeSOA, подкисленный серной кислотой, не изменяется в течение длительного времени, а осадок FE (OH) 2, образующийся в щелочной среде, окисляется очень быстро, и в присутствии воздуха он не получается чисто. Поэтому соединения железа на основе железа являются более активными восстановителями, чем в щелочных средах. Кислый.
Однако даже в последнем случае он может быть легко окислен до соответствующего производного легко * * под действием сильных окислителей, таких как С12 и KMnOa. In в частности, реакция в соответствии со схемой &Fe «+ MnO:+8Н ’= 5Fe »* + Mn » +4Н20 Используется для определения Fe-ионов. Производные Fe3 *очень устойчивы к атмосферному кислороду. Напротив, в отношении легкоокисляемых веществ они действуют как окислители.
Чем выше активность, тем выше концентрация ионов водорода в растворе. Поэтому сильные восстановители, такие как соли оксида железа, такие как SOj, HI в кислой среде, легко восстанавливаются до солей закиси азота oxide. In в частности, реакция по схеме 2Fe — + 2I ’= 2Fe — + L основана на 1 из методов количественного определения ионов Fe *. Добавь 1) железо известно человечеству с самых древних времен(рис.(См. XI11-29).Долгое время казалось, что потреблялись только металлы каменного происхождения. Кобальт был открыт в 1735 году, никель-в 1751 году.
Однако известно, что египтяне окрашивали стекло в синий цвет соединениями кобальта вплоть до 2000 года до нашей эры. е. имеется монография * по кобальту и обзорная статьяпо структурной химии соединений никеля. 2) естественный утюг, массовое число 54(5.8%)、56(91.7%)、57(2.2%)、58(0.3%)изотопы, и 58(67、67、 7%)、60(26.1%)。 61(1.3%)、62(3.7%)、64(1.2%)、кобальт — это»чистый» элемент (*Co). 3) в основном состоянии атомы элементов группы железа имеют структуру 3d9 4s *(Fe), 3d14s *(Co) и 3D * 4s *(Ni) внешней оболочки. Возбуждение по типу 4s * — Ms4p требует затрат 55 (Fe), 67 (Co) или 74 (N1) ккал / е атомов. Последовательные энергии ионизации (de): 7.90, 16.18 и 30.64 (Fe), 7.86, 17.05 и 33.49(Co). 7.63,■35.16 18.15(никель).
4) Как показывают результаты химического анализа доступных камней, глубокая / глубокая часть Земли содержит гораздо больше слоев, чем поверхностный слой, включая Fe, Ni и Co. поскольку встреченный камень является остатком небесного тела, подобного Земле, его состав служит индикатором состава внутреннего слоя!}- Земля. Все встречающиеся камни можно условно разделить на 2 класса камня и железа.
Средний состав силикатной фазы камня met Stone показан ниже(при%): о 58.1 Ф » 5.15 с 1.12 Н1 0.14 0.11 к С1 16.6 Собой! 1.46 на 0.78 мл 0.12 ти 0.04 м » 14.7 Н 149 КТ 0.15 Р 0.12 ко 0.01 Железный встреченный камень имеет в среднем 90% Fe, 8,5% Ni, 0,5%Co и относительно небольшое количество примесей от других элементов. Металлические сферы космического происхождения (диаметром до 250 мкм), извлеченные из глубоководных отложений, содержали Fe 68%, Ni 30% и Co 1,5%.Состав камня встреченного камня, по-видимому, соответствует составу более внешних слоев небесного тела, Железо-их сердцевине. Следовательно.
Ядро Земли в основном состоит из Сплав железа и никеля. _ * Perelm и Ф. М. 3 ■ rumkova А. Я, Д, М * Н. в. Кобальт. М.. Издательство Академии Наук СССР, 1949.176 С. ’»»- ••N Yu xol M R. S., химический прогресс, 1W6, 3, 329、 Б) железо очень важно для биологии животных организмов, так как оно является главным катализатором дыхательного процесса. В организме взрослого человека содержится около 4 г Fe. Около 57%из них входят в состав гемоглобина. Основной функцией этой части железа является связывание молекулярного кислорода и его перенос в ткани (X§ 3 add.18).К последним относятся органические соединения железа.4. дыхание каталитического процесса в клетке.
Из отдельных частей тела печень и селезенка наиболее богаты железом. Необходимое количество железа в течение 1 дня у человека составляет около 5 мг у мужчин и около 10 мг у женщин, полностью покрытых обычным железом. food. In в больших количествах растворимые соединения железа токсичны (Fe больше соли, чем Fe, N солей). в) содержание железа в почве обычно находится в пределах от 1 до 5% по массе (то есть большое), но количество растворимых соединений, поглощаемых растением, может быть insufficient. In в этих случаях окраска молодых листьев более или менее однородна diluted.
In в частности, это заболевание (в основном поражает многолетние плоды, картофель, капусту, овес) наблюдается на щелочных, легких почвах. Очевидно, что чрезмерное количество растворимых соединений железа также вредно для растений. 7) биологическая роль кобальта в организме животных, по-видимому, в первую очередь связана с кроветворением.
Добавление соединения этого элемента к животной пище(около 1 мг / кг массы) сопровождается повышением содержания гемоглобина в крови (но не количества самой крови).Состав аммиачного и стимулирующего рост витамина В0 составляет C H H H Hhoi4nmpco(4,35 wt. It это хорошая идея, чтобы иметь атере также интересные признаки того, что кобальт, введенный в организм, подавляет рост раковых клеток. Из обычной пищи говяжья печень и почки являются самыми богатыми в этом отношении. element. In высокие концентрации, кобальт токсичен. Одним из начальных симптомов отравления им является нарушение обоняния.
При остром отравлении, покраснении лица, рвоте и др. наблюдаются случаи, когда летальная доза животного составляет 25-30 мг на 1 кг массы тела. 8) нормальное содержание кобальта в почве составляет 1-15 мг / кг, а в растениях-0,01-0,6 мг / кг сухого веса. Листья свеклы и бобовых относительно богаты Нм. Если содержание кобальта в корме падает ниже 0,1 мг / кг сухого веса, продуктивность скота (особенно противоминных животных) может снизиться и может возникнуть анемия («сухая«).Способ предотвратить это-добавить небольшое количество CoC1 в пищу.
Также сообщалось о небольшом количестве подаваемого соединения Рисунок XIV-3.Производство. д-р ЭМ МН кобальт оказывает положительное влияние на культуру Эгкоте (1500 год до н. э.).Выращивать виноград и значительно увеличить производительность Пчелиный нос. 9) Среднее содержание никеля в морских животных организмах составляет 2 * 10 и наземных 1 * 10 * мас.% ,
И печень самая обильная. Из того же растения. По-видимому, относится к белым листьям ch (0,25%Ni к золе).Биологической роли этого элемента нет clear. It это токсично. Очевидно, маленький. Но это было отмечено. Что чрезмерное содержание никеля в кормах для животных (баранина, телятина) приводит к повреждению тканей глаза у некоторых из них с последующей слепотой.
10) большая масса всех трех элементов семейства железа входит в состав «конкреций», обнаруженных во многих участках морского дна(VII§ < 6).7).Последний включает в себя в среднем 20% МП по весу. 15-0. 5 Fe n-Co. It было предварительно подсчитано, что общие мировые запасы кобальта в этом районе в 2 раза превышают земельные. 11) для достижения высоких температур, необходимых для получения железа из руд, в древнеегипетской металлургии(как и в наше время) применялась продувка воздухом, которая создавалась с помощью сильфонов на ножках(рис. XIV-3).
Но Самый старый железный предмет в Египте датируется 4-м тысячелетием до нашей эры. он был сделан из металлического железа. 12) мировое потребление железа меньше данных (мл. Ж) как видно, за последнее столетие она увеличилась особенно быстрыми темпами. 1500 1600 1600 1700 1800 1850 1900 1960 0.05, 0.07, 0.1, 0.8, 4.8, 41.9, 189 До 18-го века производство железа было в основном полуквалифицированным ремесленничеством(рисунок XIV-4).
13)Схема доменного цеха металлургического завода показана на рисунке. XIV-5.Свежий кусок Ши * вы регулярно подается в доменную печь ( £ ) с помощью механизированного загрузочного устройства (а).Образовавшийся газ прожигает очистки пылевой камере (5) и скруббер (г).Купер.)£( Внутренняя подкладка будет shine. At в то же время, через такой же предварительно нагретый охладитель (L), воздуходувка (G) подает воздух в фурму доменной печи.
Через некоторое время роль Каупера (£) и (A) изменится. Первая роль будет охлаждать, вторая роль будет нагревать. Обычно для каждой доменной печи используется несколько охладителей. 14) выходящий из доменной печи газ содержит около 30%окиси углерода, а теплотворная способность составляет около 900 ккал / м*.Они главным образом использованы для того чтобы нагреть воздух который горит в охладителе и входит в фурму.
Перед этим их обычно освобождают от пыли (в специальном помещении) и примесей органических веществ (промывают водой с помощью скруббера). 15) состав доменного шлака состоит в основном из CaO, SiOj и AljOj. Эти шлаки часто используются в производстве цемента (то есть, шлакового цемента).Бетон и искусственный камень. Иногда они Он химически связывает драгоценные примеси, содержащиеся в исходной железной руде.
Например, шлак от выплавки керченских руд служит хорошим сырьем для производства ванадия. Рисунок XIV-5.Схема доменного цеха металлургического комбината. 16) если процент кислорода используемого воздуха для продувки увеличен(относительно нормы), то его предварительный нагрев будет излишним и охладитель можно будет снять. Однако, взрыв кислорода довольно ргиииив / НАМ И Мм XIV-4. Производство железа в XVI веке. Фигура Это повышает производительность доменных печей и улучшает качество газов и шлаков, которые являются побочными продуктами производства.
В частности, доменный газ. Помимо быстрого увеличения калорийности (за счет газификации кокса), он пригоден для различных каталитических процессов. synthesis. So, сама доменная печь становится сложным агрегатом, который одновременно производит промежуточные продукты для металлургической (чугун), химической (газ) и строительной (шлак) отраслей промышленности.
17) выплавка очень чистого железа, а в странах с плохим топливом иногда используется электрическая доменная печь (рис. XIV-6), которая нагревается до необходимой температуры током, подаваемым на электрод А. воздух в такие печи вообще не вводится, а уголь загружается только в количестве, необходимом для восстановления руды. Часть полученного газа обычно возвращается в доменную печь (чтобы сохранить их теплыми).
Рисунок XIV-6.Иллюстрация доменной печи. Рисунок X1V-7. схема повторного глажения ichi напрямую. 18) » со временем, я думаю, вы начнете пить воду, чтобы искать способы получать железо и сталь непосредственно из руды. D в 1899 г. И. Менделеев wrote. In дело в том, что в 1934 году старый способ добычи железной руды был вновь введен в практику metallurgy. It очень отличается от обычного домена. Весь процесс получения металла осуществляется с помощью слегка наклонной вращающейся печи(рис. XVI-7). она в основном аналогична той, что используется для производства цемента.
Измельчающая смесь руды и топлива непрерывно подается в печь. Затем постепенно идите к выходу и вступайте в контакт по траектории с потоком воздуха по направлению к нему (включая смесь газообразного и мелкодисперсного топлива).Во время пребывания в печи(b-8 часов) руда предварительно нагревается при нагреве, восстановлении и спекании. Потому что конечный продукт не плавится.(- ) Небольшой кусок шлака и железного лома, содержащий около 95% Fe, представляет собой легко отделяемую смесь.
Метод прямого восстановления гораздо скромнее доменного: открывает возможность использования некачественного сырья(бедная железом руда, колчеданное горение, шлак от плавок и др.) и недорогое топливо (уголь, бурый уголь и др.).Стоимость оборудования, использующего этот метод, также относительно невелика.
Однако в описанном варианте осуществления, с точки зрения производительности и рентабельности, он уступает домену. Ситуация при определении направления движения природного газа иная. По крайней мере с 1971 года в Гамбурге успешно работает завод прямого ремонта, который планирует построить крупный металлургический завод такого типа. Полученный губчатый чугун выплавляют в сталь в электрической печи. 1″) диаграмма состояния системы Fe-C показана на рисунке XIV-8 (несколько упрощенная форма).Ограниченная им территория соответствует устойчивому существованию- (Или сосуществуют) 1) жидкие сплавы следующих компонентов:
2) так называемый Ферр и Т-железо(a-Fe). он стабилен при нормальной температуре и кристаллизуется как куб в центре. 3) он стабилен в диапазоне 769-9 IVC 0-Fe, который отличается от обычного железа без ферромагнетизма. 4) 911?Он стабилен выше 6 и отличается от формы а — и Р за счет различной кристаллической структуры (кубики с гранями в центре) и способности лучше растворять углерод; 5) т. С); 6) так называемый перлит представляет собой смесь а-Fe и FejC с общим содержанием 0,9% с; 7) на стенках имеются смешанные кристаллы v-Fe и FesC и Т; 8) так называемыйЛедебрит представляет собой эвтектическую смесь FejC и аустенита с насыщенным содержанием C 4,2%.
Рисунок XIV-A. диаграмма состояния XIV-9.Схема преобразователя Повторно с системой. Как видно из рисунка, структура мягкой стали при высоких температурах (около 1000°С) соответствует аустениту. Продукты распада последнего (то есть мартенсита) при быстром охлаждении характеризуются чрезвычайной твердостью.
Это основа для закалки стали, которая используется при изготовлении фрез, сверл и др. Обычно во время закалки стальное изделие нагревают примерно до 900°С и погружают в холодную воду или масло. Такой частичный «отпуск» ослабляет внутреннее натяжение металла за счет резкого перехода от аустенита к мартенситу, оставляя его очень жестким и снова достаточно прочным.
Напротив, охлаждение сильно нагретой стали создает возможность нормального перехода от аустенита к перлиту и ферриту или смеси цементита, что приводит к потере упрочнения из-за нее. Они знали, как делать железо в Египте очень давно. Поэтому в кладке пирамиды Хуфу (2900 год до н. э.) была найдена только сталь. 20) температура затвердевания доменной печи обычно составляет около 1200°С (а переход от жидкого состояния к твердому сопровождается небольшим увеличением объема).
Конвертация в сталь осуществляется по 2 основным способам конвертера и мартеновской печи. 21) при использовании конвертерного метода(Bessemer, 1855) используйте специальный преобразователь, схематично показанный на рисунке 2. XIV-9.It представляет собой большой металлический контейнер, вращающийся вокруг горизонтальной оси, выложенный изнутри огнеупорной облицовкой и снабженный рядом отверстий, которые закачивают воздух в дно.
После того, как определенная часть расплавленного чугуна (непосредственно из доменной печи) помещается в секрете, сильный поток воздуха проходит через metal. In в этом случае происходит интенсивное сгорание C, Si и Mn (а также части самого Fe), содержащихся в чугуне、 Отверстие конвертера столба высокого пламени.
После окончания процесса (о чем судят по появлению пламени) конвертор наклоняют, и полученный пластичный чугун вытягивают в форму. Если вам нужно производить сталь, а не железо, либо до сжигания углерода, либо после завершения дутья, дутье прекращается, но количество углерода, богатого (но свободного от вредных примесей), добавляется более или менее к дутью. converter.
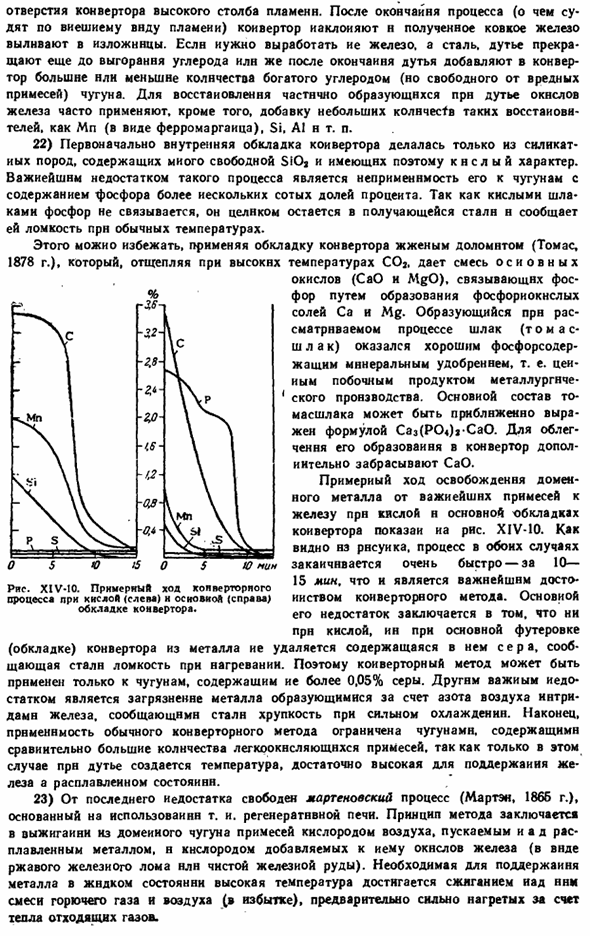
To восстанавливают оксид железа, который частично образовался во время взрывных работ, они дополнительно часто используют небольшие добавки, такие как восстановители. Mn (форма ферромарганца), Si, AI и др. 22) первоначально внутренняя футеровка конвертера имела кислые свойства, так как она была изготовлена только из силикатных пород, содержащих много свободных SiOj. Наиболее важным недостатком этого процесса является то, что он не может быть применен к чугуну, где содержание фосфора превышает 1 процент от сотни.
Фосфор не соединяется с кислым шлаком, поэтому он прекрасно остается в полученной стали, придавая ей хрупкость при комнатной температуре. Этого можно избежать, применяя футеровки конвертера с обожженным доломитом (Thomas, 1878) путем отделения COa при высоких температурах. Дайте основе смесь Образование фосфатов Ca и Mg вызывает связывание оксидов (CaO и MgO) phosphorus.
It получается, что шлак (шлак Томаса), образующийся в ходе рассматриваемого процесса, является хорошим фосфорсодержащим минеральным удобрением, то есть ценным побочным продуктом металлургического производства. Базовая конфигурация шкалы может быть приблизительно представлена формулой Caz(P04) Ca0.To облегчая его образование, САО дополнительно выбрасывается в конвертер. Примерный ход выделения доменных металлов из наиболее важных примесей к железу в кислых и основных пластинах конвертера показан на рисунке. XIV-10.
As как видно из рисунка, процесс в обоих случаях заканчивается очень быстро-за 10-15 минут, что является важнейшим преимуществом конвертерного метода. Его основными недостатками являются: даже если он кислый, сера, содержащаяся в основной футеровке (футеровке) конвертера, удаляется из металла, что придает ему уязвимость к нагреву путем steel. So, конвертерный метод может быть применен только к чугуну, содержащему более 0,05% серы.
Другим важным недостатком является загрязнение металла нитридом железа, образующимся азотом в воздухе, что придает стали хрупкость при сильном охлаждении. Наконец, область применения традиционных конвертерных методов ограничивается чугуном. Только в этом случае содержится относительно большое количество легкоокисляемых примесей, за счет чего образуется температура дутья, достаточно высокая для поддержания железа в расплавленном состоянии.
23) мартеновский процесс, основанный на использовании t(Martin, 1866).Регенерационная печь. Принцип метода заключается в сжигании примесей из доменного чугуна с кислородом воздуха. Кислород в воздухе выделяется на расплавленный металл, к которому добавляется кислород оксида железа(не чистой железной руды, а в виде ржавого железного лома).Высокая температура, необходимая для поддержания металла в жидком состоянии, достигается сжиганием на нем смеси предварительно сильно нагретых горючих газов и воздуха (избытка) над ним за счет тепла выхлопных газов. Рисунок XIV-I0.
Примерный ход конверторного процесса с использованием накладок кислотного (слева) и Oscovio A (справа) конвертеров. Конструктивно этот предварительный нагрев осуществляется в топке пода путем периодического изменения направления потока газа. Ну, как показано на рисунке. X1v-11 стрелка, горючий газ 04) и воздух ( £ ) входят слева на first. At начало пространства на расплавленном металле (G) перемешивается, масло сжигается, а выхлопные газы нагревают камеры а и в с правой стороны печи.
После того как эти камеры хорошо нагреты, газ и воздушные потоки будут обращены. Теперь правая комната будет давать им тепло, а левая комната будет светиться выхлопными газами и так далее. Когда открытый очаг нагревается горящим маслом (распыленным непосредственно в пространство над металлом), камера а становится избыточной. Недостатком мартеновского метода по сравнению с конвертерным методом является также его преимущество.
Длительное время (несколько часов) процесса позволяет легко контролировать процесс с целью получения металла нужного состава. Стоимость нагрева наружного топлива (горючего газа) позволяет производить обработку всех видов доменных печей. В зависимости от характера примесей, содержащихся в последнем, футеровка представляет собой открытый очаг Печь (Б; рисунок Х1В-11) будет»кислой»или»основной«.важным преимуществом мартеновского процесса является отсутствие отходов перерабатываемого железа. Прекрасная возможность усилить этот процесс открывается за счет использования заранее обогащенного кислородом воздуха.
24) мартеновский метод в настоящее время используется гораздо шире, чем конвертерный метод. Однако дальнейшее развитие сталеплавильного производства, вероятно, пойдет по пути широкого использования кислородно-конвертерного метода: оказывается, что, замещая воздух кислородом (подаваемым по специальной трубе сверху), он устраняет все основные недостатки конвертерного метода. Благодаря тому, что производительность значительно выше, в большинстве случаев удается успешно заменить мартеновский очаг. 25) однако недавно был предложен способ плавки из чугуна в сталь, который, очевидно, еще более эффективен. От кислорода converter.
As это видно из рисунка XIV-12.В соответствии с этим методом «распыления» расплавленное железо и известковый порошок, подаваемые в реакционное пространство, одновременно распыляются кислородом под давлением с образованием своеобразного «псевдоожиженного слоя» для обеспечения скорости реакции горения. Полученный шлак удаляется через сливную трубу, а сталь направляется непосредственно на разливку machine. An важным преимуществом данного способа является его непрерывный характер (в отличие от пакетных процессов, характерных для конвертерных и мартеновских процессов).
28) введение различных элементарных примесей в обычную углеродистую сталь значительно влияет на ее properties. So добавление кремния главным образом влияет на увеличение упругости, марганц-выкостности, вольфрам-твердости, etc. By комбинируя такие легирующие добавки («добавки») в нужных пропорциях, можно получить специальные стали, обладающие самыми разнообразными свойствами.
Например, сталь с содержанием 18% W, 4-Cr и 1-V («быстрая»)、 Рисунок XIV-11.Схема открытого очага. Правая сторона. XIV-12.Предложена пуленепробиваемая схема вариационного способа выплавки стали. Жидкая собака Мзбестовский порошок кислорода Сурин^ я «Наш Твердость против раскаленной докрасна температуры. Поэтому его применяют при изготовлении инструментов (резцов, сверл и др.) которые очень горячи во время работы.
Пирофиллал обладает отличной химической стойкостью и механической прочностью при высоких температурах (68 мас.%Железо.30-Я-С, 0.5 — МН 0.5-Си).В отличие от обычной стали, он может содержать до 0,1% s веса и до 0,4-R без ущерба для качества. 27) при выплавке специальной стали чаще всего она не происходит из пластичного чугуна, поэтому добавляются другие элементы расчетного количества (обычно в виде сплава с железом-чугун, ферросилиций, ферромагнетик и др.).Процесс плавки осуществляется либо в открытой печи, либо в электродуговой печи (рис. XIV-13).
Там нагрев достигается за счет значительного сопротивления, оказываемого прохождением тока слоем жидкого шлака, который почти соприкасается с торцами Рисунок X1V-I3-схема электрической печи на лугу. Рисунок XIV-I4. Схема кидука. Электрическая Печь Ahnonio. Углерод electrode. At в то же время слой шлака защищает основной металл от дыма, поэтому возможна точная дозировка отдельных компонентов в электропечи. Благодаря этому полученная таким образом специальная сталь («электрическая сталь») отличается высоким качеством.
28) индукционная печь (рис. X1V-I4), в которой нагрев металлов осуществляется высокочастотным переменным током, протекающим во внешнюю обмотку, еще более удобна при производстве сталей строго определенного типа composition. An важным преимуществом такой электропечи для дуговой печи является отсутствие карбонизации металлов углеродом electrodes. In кроме того, под воздействием электромагнитного поля происходит энергичное перемешивание металлов, что обеспечивает его высокую однородность.
29) при охлаждении стального слитка происходит неравномерное распределение углерода, что отрицательно сказывается на strength. To чтобы избежать этого, недавно был предложен «дождевой» метод быстрого охлаждения. Там жидкая сталь распыляется в специальную башню сильным потоком аргона и оседает в виде порошка. Последний затем спекается при P00°C под давлением 1000 атмосфер.
Эксперимент shows. It было установлено, что такая обработка стали увеличивает долговечность сверла, изготовленного из нее, примерно в 5 раз. 30)в деталях механизма (коленчатый вал, шестерня и др.), требования к внутреннему и поверхностному слоям металла различны. Большинство деталей должны быть вязкими и эластичными, но их поверхность должна быть очень твердой и упругой. wear-resistant. To получив такое качество изделия, его готовят из пластичной и эластичной мягкой стали и подвергают так называемой цементации.
Последний заключается в насыщении поверхностного слоя металла углеродом, причем это делается путем нагрева готового изделия до 900°С в течение достаточно длительного времени, в присутствии угля, цианида или углерода monoxide. As в результате цементирования поверхностный слой глубиной 0,5-2 мм приобретает необходимую твердость и прочность 31) азотирование стали дает лучший результат-азотом насыщается поверхность на глубину 0,2-0,4 мм(при длительном нагреве ее до 500-600°С в атмосфере аммиака).Азотированная сталь приобретает гораздо более высокую hardness.
It гораздо более устойчив к износу, чем лучшие инструменты. Причиной изменения этого свойства является частичное образование нитрида железа на поверхности layer. At высокое давление, азотирование происходит в атмосфере свободного азота. 32)некоторые марки стали содержат большое количество никеля. Например, нормальная нержавеющая сталь содержит 18% Cr и 9%Ni. Сталь с содержанием 36% Ni, 0,5% Mp, 0,5 C (Inbar), характеризуется очень низким коэффициентом теплового расширения, поэтому она служит подходящим материалом для изготовления различных прецизионных приборов.
Сталь с содержанием 0,15% C и 46%Ni («платина») имеет тот же коэффициент расширения, что и стекло, поэтому ее можно припаять к нему. Это важно для производства электрических ламп. Состав сплава 65 вес.%Железо. Оказалось, что 18 — Cr, 12 — Ni, 2 — Mo, 2 — Mn, 1 — Si особенно подходят для изготовления гвоздей, которые удерживают крупные кости вместе во время операции. 33) кроме специальной стали, никель входит в состав сплава с технически значимым Cu. Такие как Мп ЧР. Пример теплостойкого сплава нимоник, используемые в производстве газовых турбинных лопаток (5 , 5 , 20-СГ , 16-Со , 3-ти , 2-Аль).
С названием «пермаллой», характеризующийся высокой проницаемостью и часто содержащий добавки Cr, Mo, Cu, Mn, Ni (36-85 мас.% ) И сплавы на основе Fe известны. 68 мас. Сплавы с составом% Ni, 28-Cu, 2,5-Fe, 1,5-Mn («Монель-металл») очень устойчивы к различным химическим воздействиям и используются при изготовлении некоторых видов оборудования химических заводов. 67,5 мас. Сплав состава% Ni, 16-Fe, 15-Cr и 1,5-Mn характеризуется высокой термостойкостью и высоким электрическим сопротивлением, и называется «нихром»в виде проволоки для изготовления различных электрических heaters. In некоторые случаи, 83 wt.
It может быть заменен на более дешевый»фехрал«, который включает в себя% Fe, 13-Cr и 4-A1. 34) имеется интересное сообщение, характеризующееся плотностью 2,74 г / см *и температурой плавления 1310°С. Нити («intiol») сплав состава для обнаружения памяти. При нагревании до 60h-70°С первоначальная форма восстанавливается самостоятельно. Это удивительное свойство еще не нашло внятного объяснения, но уже начинает применяться на практике. 35) кобальт часто используется в виде различных сплавов, в основном используемых при изготовлении фрез, сверл и других наконечников.
Примеры 35 wt. It является «Стеллитом», содержащим% Co. 35-Cr, 15-W, 13-Fe и 2-C. Так называемые твердые сплавы («VK», » win » и др.) обычно представляют собой карбид кобальта-карбид вольфрама. Они составляют 78-88 мас.%W. Включая 6-15% Co. 5-6% ci особенно ценны тем, что они допускают очень большие скорости обработки металла, так как не теряют своей твердости даже в условиях высоких температур.
Кобальт также часто вводят в состав жаропрочных, кислотостойких, сплавов, которые предназначены для получения постоянных magnets. An примером последнего типа сплава является » magnico «(51 мас.%Fe, 24-Co, 14-Ni, 8-AI, 3-Cu).Состав сплава 53,8 мас.%Фе, 29-Н, 17-Ко. Мп („Коваль“), как и 0,2-» платина», хорошо паяется на стекле и в то же время обладает высокой стойкостью к действию паров ртути, что открывает возможность его использования в электротехнике, радио-и светотехнике.
36) при извлечении никеля и кобальта из природных рулонов очень трудно отделить эти элементы одновременно взаимно с другими металлами, содержащимися в рудах. Поэтому, весь процесс очень complicated. It также зависит от характера ore. At на заключительном этапе растворы, содержащие Co и Ni, обычно обрабатывают отбеливателем, первая часть которого высвобождает Co, а следующая, Ni, восстанавливается в виде оксида E * 0 * Металл.
Чаще всего проводят электролитическую очистку. Выплавка никеля в мире осуществлялась в 1850 году на 100 г, в 1900 году на 7500 г, а в 1950 году примерно на 12 млн г, но сейчас выплавляется около 40 млн г в год (за исключением Советского Союза).Ежегодная мировая выплавка кобальта составляет около 2 млн г (без учета Советского Союза).Цена Fe, Co, N1 на мировом рынке (i960) составляет около 1: 24: 12. 37) технически чистое железо («Армко-Фе») обычно содержит массу около 0,16.% Примесей (C <0,025, Mn 0,035, Si <0,05, P <0,015, S <0,025, Cu <0,05 мас.%). обладает высокой пластичностью и высокой коррозионной стойкостью.
Доказательством того, что подобная чистота метадолов была доступна в древней металлургии, являются знаменитые Столбы Дели (7 в высоту и 6 в весе), состоящие из 99,72% железа. Е изготовлено в 415 г. AD. So далеко, коррозия произошла. Из тысячи. ’50 Сто- 500 Ludo ’ 500°C рисунок XIV-15.Диаграмма была составлена из железа.
38) атомный радиус Fe равен 1.26 A, а электронная функция работы металла NS-4.7 eV. как указывает rns. XIV-15, при нормальном давлении железа, имеется 4 аллотропа. Из них, [д(Фефе) ««2.49), Р А Б кристаллизоваться в качестве центрального кубика, а y кристаллизуется в виде куба с центральной плоскостью [</(Фефе)=» в 2.57].Коэффициент теплового расширения железа увеличивается до 500 ° С. После этого он уменьшается до 769 ° С, а затем снова до 911 * С. Железо типа Е, образующееся при комнатной температуре под давлением около 133 тысяч атомных форм, имеет</(FeFe) −2,40 а, высокую плотность (9,1 г / см*) и повышенное (примерно в 2,5 раза) электрическое сопротивление.
39) переход при 769°С, который не изменяет кристаллическую структуру, соответствует резкому максимальному значению кривой теплоемкости металла(рис. XIV-I6) И потеря способности притягиваться к магнитам. Переход, происходящий при 911°с, сопровождается незначительным увеличением плотности (с 7,57 до 7,63 г / см9). 40) выплавка железа требует затрат в размере 3,7 ккал / г атомов, что приводит к незначительному уменьшению объема. Вблизи точки плавления плотность жидкого Fe составляет 7,0 г / см8, а давление пара-0,05 мм рт. ст. Искусство.
Теплота испарения железа составляет 84, теплота сублимации (25°C) — 97 ккал / г атомов. 41) стандартные атомные радиусы Co и Ni составляют 1.25 и 1.24 A, а электронные рабочие функциональные свойства металла-4.2 и 5.0 9c соответственно. Аллотропы этих элементов менее изучены, чем iron.
In кобальт, при нагревании (около 450 С), наиболее плотное заполнение шестиугольника превращается в куб с выровненным центром, и наоборот, в Никель(около 358 С с). неясно, чем вызвано такое противоположное поведение обоих металлов. 42) при приложении высокого давления температура плавления Fe, Co и Ni увеличивается, а электрическое сопротивление уменьшается (рис. XIV-17).
Теплота плавления атомов Co и N1 составляет 3,6 и 4,2 ккал / г соответственно, а теплота сублимации (25°C) — 83 и 81 ккал / г атомов. Wf Рисунок XIV-I6.Теплоемкости железа от температуры[KzhalKsh-атом• * рад) Дж. 43) со всеми 3 элементами и парой отдельных атомов были найдены n достаточно стабильных 2-атомных молекул. Их энергия диссоциации оценивается в 30, 39 и 55 ккал / моль, respectively. It интересно, что аналогичная оценка энергии диссоциации не-NiJ молекул составит 83 ккал / моль, несмотря на нечетное число electrons. It является более стабильным, чем нейтральные молекулы.
44) по отношению к магнитному полю все вещества можно разделить на 2 большие группы: диамагнитные и парамагнитные. Первые оказывают большее сопротивление прохождению магнитных силовых линий, чем вакуум, поэтому внешнее магнитное поле стремится вытеснить магнитные силовые линии из них. Под воздействием такого поля они перпендикулярны ему (A, rns. XIV-18).Второй, наоборот, проводит больше линий магнитного поля, чем вакуум.
Внешнее магнитное поле имеет тенденцию притягивать их и параллельно направлению (Б, рис. XIV-18). 45) на основе наиболее распространенных методов экспериментального исследования магнитных свойств веществ. Самый простой чертеж используемого оборудования показан на рисунке. XIV-19.Испытуемый материал в стеклянной ампуле а сначала калибруется с помощью весов В. затем включается электромагнит В, и втягивание или разряд ампулы определяется весами с весом Весов.
46) количественные свойства диамагнетизма и парамагнетизма обычно определяются величиной молярной (атомной, нориевой) восприимчивости (х).Для диамагнитных материалов преобладает первый nx <0,а для парамагнитных материалов-второй nx> 0.Формат номера-a-10″.Обычно он выражается только с коэффициентом 10 —.Например, x −13.0 дается для воды. О магнитных свойствах веществ имеются монографии и обзорные статьи. 47) различное магнитное поведение вещества обусловлено различием в природе самого внутреннего магнитного поля.
Если магнитные поля всех элементарных магнитов близки друг к другу, то возникает избыток магнитных моментов в частицах магнитного поля. matter. At в то же время сильно замкнутое внутреннее поле препятствует вхождению силовых линий во внешнее поле, и вещество оказывается диамагнитным. Диамагнетизм-это общее свойство материи, так как внутренние магнитные поля замкнуты друг на друга по крайней мере частично, причем каждая частица имеет более 3 электронов. Рисунок XIV-17.
Влияние давления (от тысячи) на относительное электрическое сопротивление. — Дольф Я. Г. Магнитные свойства и структура вещества М.. Гостехтеоретяздат, 1966. 376 С. П. Об Ат Magnstokhnmnya. At пар АЙГЛ. Идатьяллнт. 1968.457 секунд Гудааф Д. магнетизм я-химическая связь. С английского, Изд. Б, е, Левин Я с, с, перейти * relak. М.. Металлургия 1968.332 секунд * * Нюхолей Р. С. успехи химии, 1966, М4, 617、 48) полный диамагнетизм молекулы (x) может быть разбит на отдельные атомы (или связи) values.
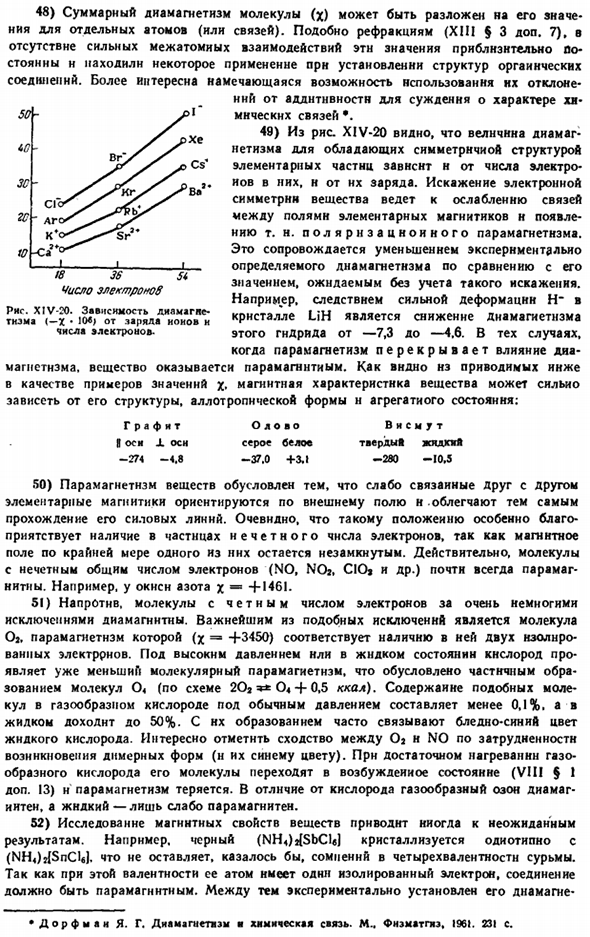
As с преломлением (XIII§ 3 add.7), при отсутствии сильных межатомных взаимодействий эти величины практически постоянны, и некоторое их использование можно наблюдать при установлении структуры органических соединений. Более интересным является появление возможности использования отклонений от аддитивности для определения природы химических связей 49) из рисунка Х1В-20 видно, что величина диамагнетизма элементарных частиц с симметричной структурой зависит от количества электронов в ней и их заряда.
Искажение электронной симметрии вещества приводит к ослаблению связи между полем и появлением основного Магнита. Поляризационный парамагнетизм. Это сопровождается экспериментально определенным снижением диамагнетизма по сравнению с ожидаемыми значениями без учета таких искажений. Например, сильная деформация H-в Кристалле LiH снижает диамагнетизм этого гидрида с −7,3 до −4,6.Когда парамагнетизм перекрывается с эффектами диамагнетизма. Вещество это paramagnetic. As на самом деле, они приведены в качестве примеров значений X.
Магнитные свойства вещества во многом зависят от его структуры, аллотропии и агрегатного состояния. Графит олово висмут I-axis JL-ось серо-белая сплошная ошибка −274-4.8 −37.0 +3.1 −280 −10.5 50) парамагнетизм вещества обусловлен тем, что основные магниты, слабо связанные между собой, ориентированы вдоль внешнего магнитного поля, тем самым облегчая прохождение его силовых линий.
Очевидно, что эта ситуация особенно выгодна из-за наличия нечетного числа электронов в частице, так как магнитное поле по крайней мере 1 частицы остается open. In дело в том, что молекула с нечетным числом электронов (N0, N0, CJ и т.) почти всегда парамагнитна. Например, для окна с азотом x = +1461. 51) напротив, молекула с четным числом электронов диамагнитна, хотя есть несколько исключений.
Наиболее важным из этих исключений является молекула Oi. Его парамагнетизм (x = +3450) соответствует наличию в нем 2 изолированных электронов. Под высоким давлением nln в жидком состоянии кислород уже стал меньше в молекулярном парамагнетизме. Это связано с частичным образованием молекулы(схема 20*** 04 + 0.5 ккал).
Содержание таких молекул в газообразном кислороде пола при атмосферном давлении составляет менее 0,1%, а в жидкостях оно достигает 50%.Бледно-голубой цвет жидкого кислорода часто связан с его образованием. Интересно, что Oj и NO обращают внимание на схожесть сложностей внешнего вида формата 1D (и его синего цвета).Если имеется достаточно нагретый газоксиген, то его молекула переходит в возбужденное состояние (VIII§ 1 add.13), парамагнетизм теряется. В отличие от кислорода, газовый Озон диамагнитен, в то время как жидкий Озон слабо парамагнитен.
52) исследование магнитных свойств вещества может привести к неожиданным результатам. Например, черный (Nha) a (SbCU) кристаллизуется таким же образом, как (NHA)^Sncla).Это, по-видимому, не оставляет никаких сомнений в отношении четырехвалентной сурьмы. При такой валентности соединение должно быть парамагнитным, так как атом имеет 1 изолированный электрон. Между тем, его ДНК была установлена экспериментально. Рисунок XIV-20.
Зависимость диамагнетизма (- X•10″ > зависимость от заряда Иона и количества электронов * Дорфмай Я. G. диамагнитные химические связи. М.. Fnematgie, 1961.223 секунд Это верно, [SbCl»] * — это не Ион, а равное количество структурно однородных некостных isbcm -и[SbCUJ-трехвалентная и пятикратная сурьма (добавлено IX§ 6.47).Косвенно такое толкование подтверждается также черным цветом рассматриваемого соединения (XIII§ 3 add.51). 53) единицей магнитного исследования атомов, ионов и молекул является магнитон, определяемый соотношением. Где m-масса электрона, e-его заряд (электромагнитная единица). A-это квант действия (III§ 4), А NA-число Авогадро.
Величина эффективного магнитного момента исследуемого вещества (1 Магнетон, г атом или Г Ион на моль) определяется по формуле M9ff = 2,84 Uhn•T (где G-абсолютная температура, при которой измеряется магнитная восприимчивость). Поэтому вместо Хо можно использовать значение х (представляющее собой нижнюю границу величины х), которое определяется непосредственно экспериментально, вместо Хо-вещество с неспаренным электроном, молекулярная масса которого не очень велика. ff = » 0,05 V%применяется (x получается без коэффициента IQ -).
54) предполагая, что полный магнитный момент частицы зависит только от спина неспаренного электрона, эти моменты выражаются формулой (Af) «= » (М0) V n (n-4-2) (l-число таких электронов).) Соответствующие точки в сплошной линии XIV-2I соответствуют аналогичным теоретическим расчетам, а значения, найденные в эксперименте, отмечены кружком (для ионов в водном растворе). как видно из рисунка, первое предположение generally. It это было подтверждено опытом.
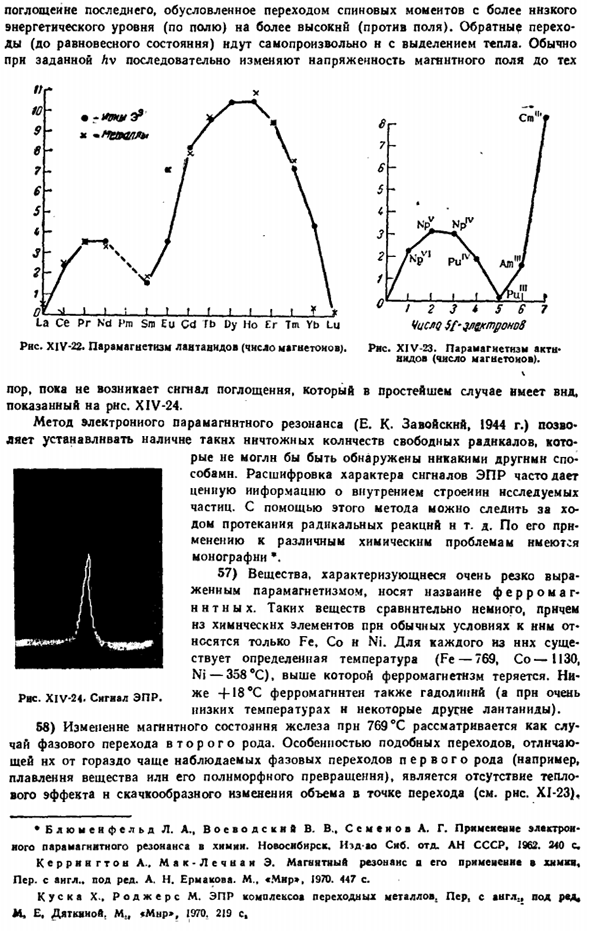
Отклонение отдельных экспериментальных данных от целых значений неспаренных электронов, очевидно, вызвано влиянием орбитальных магнитных моментов (VI§ 3 постскриптум 1).Для сои необходимо признать особенно сильное влияние, так как наличие 4 неспаренных электронов никак не может соответствовать электронной структуре этого Иона (2, 8, 15). 55) влияние орбитального магнетизма лантаноидов еще более значительно. Только они могут объяснить очень высокий эффективный магнитный момент в серии Dy-Tsh (рисунок XIV-22).
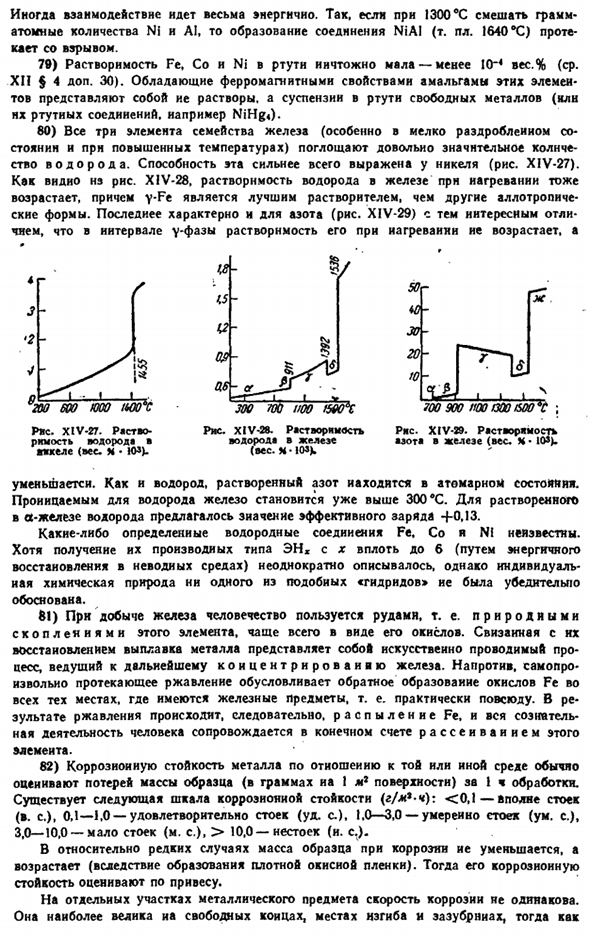
Близкое сходство магнитных свойств ионов и соответствующих им атомов е (металла) большинства лантаноидов указывает на то, что магнитные носители, экранированные электронами 4s, заполненные оболочками 5s и 5p, практически не подвержены влиянию внешней среды(причины отклонений Ec и Yb ясны из общего закона).XIV-23 показывает, что с увеличением числа f-электронов парамагнетизм актинидов изменяется примерно таким же образом. Как лантаноиды. 56) метод электронного парамагнитного (спинового) резонанса (ЭПР) дает большие возможности для изучения веществ, содержащих свободные electrons. As как видно из квантовой теории, спиновый магнитный момент электрона (VI§ 3 сложение.
И)во внешнем магнитном поле может занимать только 2 положения (в поле или на противоположной стороне поля), которые незначительно отличаются по энергетическому уровню. Если пучок радиоволн сантиметра направлен на вещество, содержащее свободные электроны в магнитном поле, то существует определенное соотношение между напряженностью поля и энергией радиоизлучения (H), и энергия резонанса уменьшается. Рисунок X1V-21.
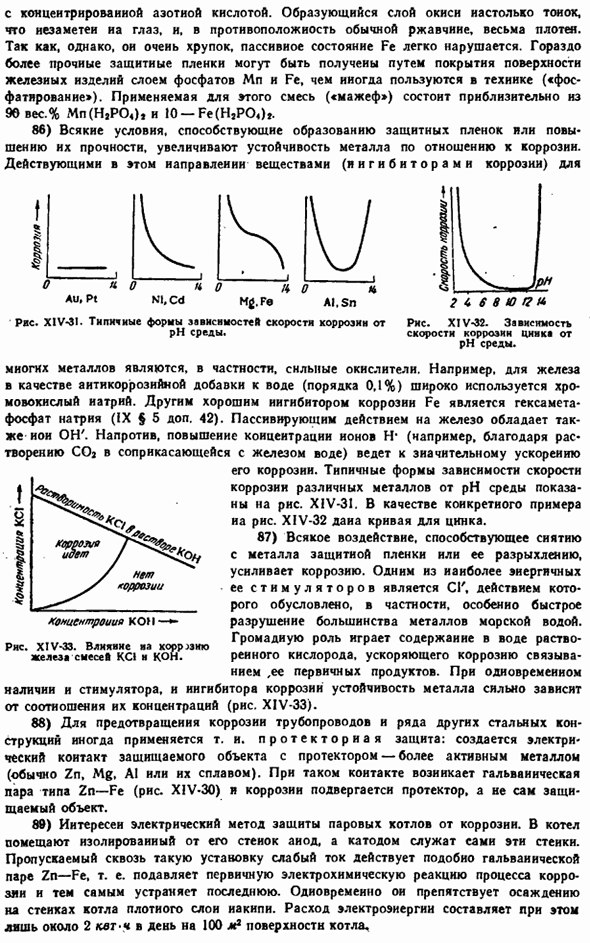
Парамагнитный нет.Поглощение последнего происходит за счет перехода моментов с более низких энергетических уровней(в поле) на более высокие энергетические уровни (для поля). Инверсионный переход (в равновесное состояние), естественно, протекает с выделением тепла. Обычно prn задается hv, который непрерывно изменяет напряженность магнитного поля. Цифры$ [- е Ряса. XIV-22.Парамагнетизм двери мирянина (число магнетонов).Ряса. XIV-23.Парамагнитный метод Вид (количество магнетронов). \ До тех пор пока сигнал поглощения не появится в RNS.
It имеет низкочастотный сигнал в простейшем случае. XIV-24. Метод электронного парамагнитного резонанса (Е. К. Завойский, 1944)позволяет установить наличие такого ничтожного количества свободных радикалов, которое не может быть обнаружено другими средствами. ■ Страшный. Расшифровка природы ЭПР-сигнала часто дает ценную информацию о внутренней структуре исследуемой частицы. Этот метод позволяет контролировать ход радикальных реакций и т. д. Существует монография*по применению к различным химическим проблемам. 57) вещество, характеризующееся очень выраженным парамагнетизмом, называемым ферромагнетизмом.
Таких веществ сравнительно мало, и среди химических элементов в нормальных условиях они содержат только Fe, Co и Ni. Каждый NNH имеет определенную температуру (Fe_769, Co_1130, Ni_358°C), при которой он теряет свой ферромагнетизм выше. Ни-РВС. ХIV-24.Сигнал ЭПР. Тот же самый ферромагнетик+ 8°C также содержит гадолиний (даже при очень низких температурах и другие лантаноиды). 58) изменение магнитного состояния железа при 769 ° с рассматривается как случай фазового перехода второго порядка.
Особенностью такого перехода, отличающей его от фазового перехода первого порядка, наблюдаемого чаще (например, плавление вещества или его полиморфный переход), является отсутствие тепловых эффектов в точке перехода и резкое изменение объема (см. RNS XI-23). * Блюмеяфельд Л. Д.
Воеводский В. В. Семенов А. Г. применение электронного парамагнитного резонанса в химии. Новосибирск 1д АО Сиб. Отъезд Академии Наук СССР. 196; 2. 340 секунд. А. Kerryagton .. Мак-Лечиай Э. магнитный резонанс и его применение в медицине chemistry. In английский. А. Н. Ермакова. М » мир. 1970.447 секунд Куска Х. Роджерс М. ЭПР комплекса переходных металлов. Пар от английского, Изд. М, Е, Дятькяноа. М «МНР», 1970.219 секунд Однако при переходе вида 2 происходят скачки некоторых других свойств (например, теплоемкости).
Следует отметить, что было обнаружено прерывание кривой нагрева чугуна при температуре 769°С, которое явно было вызвано скачком переходного тепла и теплоемкости (см. рис. XIV-16). 59) помимо притягивания их магнитами, важнейшей особенностью ферромагнетиков является то, что под действием кругового тока они сами становятся magnets. In в данном случае резкая разница в поведении чистого железа и стали интересна и действительно важна. Первые действуют как магнит до тех пор, пока находятся под воздействием электрического тока, но намагниченная стальная пластина действует как»постоянный» магнит.
Способность никелевой трубки периодически сжиматься и расширяться на частоте магнитного поля, создаваемого никелевой трубкой, используется для получения ультразвуковых волн (X§ 4 add.21). 60) ферромагнетизм обусловлен более или менее резким преобладанием отдельных малых (по диаметру) Приблизительно 0,01 мм) структурная область — «домен» — основное вещество параллельного расположения магнитов. Магнитные моменты самих этих доменов почти полностью погашены (рис. X1V-25.(-4).Однако внешнее магнитное поле относительно легко направляет их в этом направлении(рис. XIV-25,£>). это приводит к намагничиванию веществ.
61) если антипараллельное расположение основных магнитов в домене доминирует достаточно сильно, то возникает антиферромагнетизм. Антиферромагнитные тела не притягиваются к магнитам. Их особенностью является наличие максимального значения в Кривой зависимости парамагнетизма от температуры. 62) при нагревании тепловое движение частиц увеличивается, поэтому порядок взаимного расположения основных магнитов окончательно нарушается. Температура.
Теряется ферромагнетизм («точка Кюри») или антиферромагнетизм Тим Вайнер («нейел Пойнт»), в некоторых случаях. _ .. а. очень разные. Например, для марганца точка Нила равна −148 ° 42, для хрома+202°С. При превышении температуры Кюри и температуры Неля вещество сохраняет свои нормальные парамагнитные свойства, но переход может быть более трудным. Например, формий ферромагнетизма до 20°к. парамагнетизм в диапазоне 20-133°к, антиферромагнетизм и более 133°К. аналогичное поведение установлено для диспрозия.
63) интересен принцип работы магнитного теплового двигателя. Небольшой магнит прикрепляется вдоль края костюма, проходя между полюсами электромагнита, и когда 1 из них нагревается немного выше точки Кюри, он теряет свое магнитное поле properties. So, баланс нарушается, диск вращается, следующий Магнит подвергается действию нагревательного устройства, а первый Магнит является cooled. As в результате повторных процессов диск вращается. Модель такой установки была успешно протестирована. 64) в дополнение к элементам самого семейства железа ферромагнетизм также является особенностью некоторых из их compounds. It основано на магнитной концентрации железной руды в частности.
Схема такого обогащения показана на рисунке 1. X1V-26.As как видно из рисунка, дробленая руда, подаваемая на конвейер, разделяется магнитными компонентами, армированными железом и немагнитными отходами горных пород. 65) сообщалось, что магнитное поле влияет на рост и развитие растений. Имеются также сообщения об улучшении некоторых технических показателей водного объекта Болезнь 9 * Вт Фигура XIV. » Ферромагнитная схема. Электронный регулятор Магнитные части руды Ленточный немагнитный конвейер разделяет руду Рисунок XIV-26.Схематичный вид магнитного обогащения руды.
Воздействие магнитных полей(например, паровые котлы не образуют плотного слоя накипи); однако это относится только к воде, содержащей следовые количества железа, и магнитное поле не влияет на свободную воду. КС) антропогенное изменение магнитного состояния вещества сопровождается изменением температуры. Это обстоятельство нашло интересное применение в криогенной области. При охлаждении жидким гелием, воздействии сильного магнитного поля, такого как Хромисто-черствые квасцы, тепло, выделяющееся при намагничивании, расходуется на испарение helium.
By извлекающ его и быстро уменьшающ прочность электрического поля немедленно, температура квасцов может значительно быть уменьшена абсорбцией жары во время demagnetization. It интересно, что в этом случае размагниченное вещество само может выступать в роли термометра: температура позволяет судить о степени усадки по остаточному магнитному полю(в зависимости от постоянной силы последнего, она зависит только от температуры).
На основе этого принципа была создана непрерывная установка, поддерживающая температуру в диапазоне 0,3 ВК. Вместо хромовых и калиевых квасцов можно использовать много других веществ. Например, размагничивание Gd2 (SO«) j достигло температуры 0,006°K. 67) металлы Fe, Co и Ni, разделенные соединением NC в очень мелкодисперсном состоянии, обладают свойствами самопроизвольного воспламенения.
То есть он самовоспламенится в воздухе уже при комнатной температуре. Самопроизвольные пирофорные порошки металлов семейства железа получают восстановлением их оксидов водородом. Средний размер частиц пиролитического железа составляет всего около 5 мкм. Их огромная общая поверхность в контакте с воздухом обусловлена резким увеличением скорости окисления. Однако непосредственной причиной самовозгорания является
не столько развитие общей поверхности, сколько искажение кристаллической решетки частиц, по сравнению со стабильной структурой для соответствующего металла. 68) особая форма самовозгорания Ni, так называемый скелетный никель («Raney nickel»). его получают путем легирования prn 1200°C никелем и алюминием (20-50 МАС.% Ni), затем сплав обрабатывают концентрированным (10-35%) раствором NaOH для удаления AI, а остаток промывают водой и спиртом(в атмосфере Hj).
Полученный серо-черный порошок мелкодисперсного никеля, насыщенный водородом, является хорошим и часто используемым катализатором для различных процессов гидрирования и восстановления органических соединений. compounds. It следует отметить, что принцип, лежащий в основе получения скелетного никеля, может быть использован также для получения многих других металлов(Fe, Co, Cu и др.), которые находятся в каталитически активном состоянии.
69) в дополнение к гетаранам, описанным в тексте, при высоких температурах Fe, Co, Ni образуют соединения со многими другими элементами. Состав ЭЭС является наиболее характерным для карбидов, кроме того, он образуется из элементов эндотермически с поглощением 5 (Fe), 10 (Co) nl, 9 (Ni) ккал / моль. Fe * C изучен лучше, чем другие карбиды.
70) 3fe +CFejC область равновесия в системе оценивается диапазоном температур 600-00 ° C. At более низкая температура, цементит (плотность 7,7 г / с?) Неустойчив, но из-за крайней скорости распада он действительно не разлагается. Напротив, он стабилен при температуре более 1100 ° С и плавится при температуре 1650°С (и даже 1837°С по другим данным) без разложения.
Возможность получения чистого цементита была отмечена взаимодействием расплава NaCN в вакууме с железом. Очень твердые кристаллы Fe, C образованы трехгранной призмой атомов железа с атомами углерода, отделенными друг от друга вблизи center. As структурные элементы этого карбида, параметры</(FenC) 1 1.9,/ /(Fe * C) 2 2.1 A ’и плоские молекулы Fe C (Fe) j с дополнительными металлическими связями между обоими атомами были предложены Fe1 (d = 2.5 A).
Точка Кюри чистого фейка составляет 214°C. In разбавленная кислотами, она разлагается с образованием смеси водорода и углеводородов. Относительно неустойчивые карбиды в составе FcjC 、 Fe » C. Для последнего из них была установлена структура тетраэдра с атомом углерода в центре (rf (CFe)■= 1.78 A]. 71) кроме Co3C, его получают взаимодействием элементов при 500-800°C. В кобальте известен карбид Co * C (теплота образования составляет 4 ккал / моль).
Состав последних явно нестабилен. Когда он превышает 450 ° C, он разлагается на элементы. 72) равновесное состояние системы 3Ni — + — nini3c оценивается при 900-2100 ° С. NIJC практически стабильной при комнатной температуре (но самовозгорание) и разлагается на элементы выше 350°С. показано, что нестабильная ни с С могут быть сформированы в промежуточном порядке.
73)в отличие от карбидов, силицидов Fe. Co и Ni образуются из элементов, которые выделяют тепло. Теплота образования (ккал / г атома металла) и температура плавления (®С) типичных из них сравниваются следующим образом. FejSl F » 8SI / FeSl FcSij CojSl CoSl Cosj NljSl Nljsl Nljsl Nljsl Nljsl 7 12 19 19 14 14 25 25 17 17 21 1EOO(1195)1410(1210)1332 1415 1277(1150)1290(830)1000°С Данные в скобках соответствуют температуре разложения.
74) Fe2B был указан от Бора до C. FeB. Co3B, CojB. глыба. CO2. Ni3B, NiaB, NIB. Ni2Bj. Соединения типа E2B плавятся при 1389 (Fe), 1265 (Co) и I230°C (Ni). 75) распространенный способ получения серо-черного нитрида Fe. Co и Ni осторожны пиролиза амидов. В этом случае, Фейн (350), FesN (420°с), Фе Н (Колорадо) (150), CojN (200°С), карбонилирования Н (Co и Ni, П2) (362°С), Н, Н-никель. Нитриды над 640 (Fe N), 450 (CojN) и 585 eC (NljN) разлагают и производят элементы.
Образование всех рассматриваемых нитридов из элементов близко к 0.Точка Кюри наиболее стабильного нитрида железа-Fe » N — составляет 488 ° С. 76) фосфиды Fe, Co и Ni образуются из элементов с выраженным термогенезом (ккал / г атомов металла: F «jP Fe2P FeP F» P * Cojp CoP CoPj Ni3P Nlap Nlap NLP NLP J 13 19 29 43 24 38 69 17 21 22 38 45 Температура плавления фосфида E2P составляет 1365 (Fe), 1386(Co) и 1I00°C (Ni).что касается кислоты, она стабильна.
77) тепло, выделяемое из элементов, известно для некоторых Арсенидов Co и Ni, а также Fe, Co и Ni a и t и m и n и d (ккал / г атомов металла). CojAs Cojasj CoAs2 NlAs Fesbj Cosbj Cosbj NlsSt * NlSb NlSbj 7 14 17 22 13 −2 −4 10 13 7 16 18 Как видно из этих данных, только железная сурьма образуется при поглощении тепла. 78) значительное тепловыделение сопровождается образованием элементов Fe и некоторых металлов compounds.
As например, данные производных алюминия, олова и титана выглядят следующим образом (атом ккал / г элементов семейства FE): — Н’йял Н’ял Н’й а’Н ффрендиау, — сказал меддай.、12 20 27 26 35 39 12 28 36 Cosnijsn NljSnj NiSn F » Ti NijTl Nltlntlj 7 8 13 15 10 II 16 20 Иногда взаимодействие происходит очень энергично. Поэтому, когда Ni и AI граммового атомного веса смешиваются при 1300°C, образование соединений NiAl (mp 1640°C) протекает взрывчато. 79) растворимость Fe, Co и Ni в ртути незначительна. I0-менее 4 мас.%(см. XII§ 4 дополнительно 30).
Амальгама этих элементов, обладающих ферромагнитными свойствами, представляет собой суспензию их раствора, а ртуть (или соединение ртути, например NiHg) — свободный металл. 80) все 3 элемента семейства железа (в частности, в мелкодисперсном состоянии, при высокой температуре) поглощают значительное количество водорода. Эта способность наиболее выражена в Никеле (рис. XIV-27).
Как видно из рисунка XIV-28, растворимость водорода в железе при нагревании также возрастает, и y-Ft является лучшим растворителем, чем другие аллотропы. Последний также является характеристикой азота(рисунок X1V-29), и есть интересное отличие, что растворимость не увеличивается даже при нагревании в интервале u фазы.、
Пятьдесят 46 ′ Тридцать 20 августа J_I_L 700 900 ЮО ООО бу Т; Растворимость е (вес. К•10«). Рисунок XIV-28.Растворимость водорода в железе(мас. М-10 «)、 200 600 УОО МОТ Уик. XIV-27.Растворимость водорода в Никеле(вес. Н•Ю»). fi) Лоо ТОО Рисунок XIV-29.Азот в железе Подобно водороду, растворенный азот находится в атомарном состоянии. Когда железо уже больше 300 * C, оно передает водород. для водорода, растворенного в железе ct, было предложено эффективное значение заряда+ 0,13.
Конкретные соединения водорода Fe, Co и N1 неизвестны. получение их производных типа EN от x до 6 (вследствие интенсивного восстановления неводной среды) неоднократно описывалось, но отдельные химические свойства ни одного из этих гидридов убедительно не были продемонстрированы. 81) в добыче железа человечество использует руды, то есть естественные накопления этого элемента. Чаще всего его используют в виде оксидов.
Выплавка металлов, связанная с их восстановлением, является искусственно проводимым процессом, который приводит к дальнейшему обогащению железа. Напротив, ржавчина, которая течет естественным путем, вызывает обратное образование окна Fe во всех местах, где есть железные предметы, то есть почти везде. Поэтому в результате ржавления происходит распыление Fe, и вся сознательная деятельность человека сопровождается, наконец, рассеиванием этого элемента.
82) коррозионную стойкость металла на конкретной среде обычно оценивают по потере массы образца за 1 час обработки (1 грамм и 1 М7 поверхности).Коррозионная стойкость имеет следующую шкалу (г / м * — ч):<0,1-полное сопротивление («.Е.), 0,1-1,0-достаточное сопротивление(удельное), 1,0-3,0-умеренная стойка (т. е. Для 3.0-10.0 мал,> 10.0-не-распорку (т. е. это не так. В относительно редких случаях масса образца при коррозии уменьшается и увеличивается(за счет образования плотной оксифильмы).
Далее, коррозионная стойкость оценивается путем увеличения веса. В некоторых областях металлических объектов скорость коррозии не одинакова. Свободный край, место сгиба, будет самым большим в выемке, но、 Более гладкие части, при прочих равных условиях, менее подвержены коррозии. Имеются монографии по коррозии металлов 83) если химически чистый металл взаимодействует с влажным воздухом или водой, то образующийся в первую очередь водород несколько задерживается поверхностью, защищая ее от дальнейшей коррозии.
Когда 2 различных металла вступают в контакт, образуется гальваническая пара(V§ 8 add.2), так как водород выделяется из менее активных металлов, он защищен от corrosion. In напротив, более активные металлы в этом случае быстро разрушаются. destroyed. So например, если нарушена целостность защитного слоя, то будет протекать ржавчина оцинкованного железа с одной стороны и луженого железа с другой differently. In первый случай (а, рис. XIV-30) локального повреждения поверхности Рисунок XfV-ZO. Коррозионные схемы оцинкованного и луженого чугуна.
Дальнейшая эрозия защитного слоя цинка, в то время как ржавчина железа отстает. Во 2-м(5, Рис. XIV-30) дальнейшая ржавчина железа происходит под неповрежденным слоем олова, начиная с поврежденного места. Диаграмма стрелки с крыльями для обеих схем. XIV-30 показывает направление перехода электронов соседних металлов. Возникновение такой локальной гальванической пары является основной причиной относительно быстрой коррозии загрязненных металлов. Однако, вы можете увидеть интересные индивидуальные особенности.
Например, скорость коррозии магния (в растворе NaCl) резко возрастает под влиянием Fe, Co или незначительных примесей Ni (около 0,02%), но наличие значительных примесей Mn, Al, Cd или Sn на самом деле не влияет it. In в некоторых случаях, наоборот, микроаддиции другого металла (например, 0,2% Cu по отношению к Fe) защищают основной материал от коррозии. В качестве отдельных элементов (катодов и анодов) пары показаны только различные металлы, но многие другие разнородные компоненты системы находятся в тесном контакте друг с другом.
Например, при ржавлении обычной углеродистой стали роль катода играют зерна цементита, а роль йода-чистое железо grains. In напротив, высокая однородность очень чистого металла резко повышает устойчивость к коррозии. Высокая коррозионная стойкость также является особенностью сплавов со структурой твердого раствора (XI§ 3 add.6), особенно в нержавеющей стали характерно. 84) вообще говоря, чем более восприимчив металл к коррозии, тем более вероятно, что он будет расположен в ряду напряжений слева от него. Однако есть и отклонения от этого правила.
Они наблюдаются, когда поверхность металла легко покрывается несколькими плотными и эластичными пленками его соединений, которые практически не растворяются в воде. Эта пленка иногда бывает очень тонкой и прозрачной, поэтому она остается невидимой, но она способна защитить металл от контакта с окружающей средой и тем самым защитить его от corrosion. As например, есть пленка из металлического алюминия ABO.
Это связано с тем, что при наличии изделия из этого металла оно имеет слегка тусклый вид, а в нормальных условиях практически не подвергается коррозии. 85) образование плотной защитной пленки, характерной для алюминия, происходит даже с железом, но только при особых условиях, например, когда металл вступает с ним в контакт * Н. д. томатов.
Теория норлоя и защита металлов. М. Советская Академия наук, I960. 593 секунды. Розейфельд И. Л. атмосферная коррозия металлов. М.. Академии наук СССР. 1980.372 секунд Г, л. г. коррозия металлов, Trans. In английский. А. Б. Typxooccoi. Металлургия*** 1968.306 секунд」 В концентрированной азотной кислоте. Полученный оксидный слой очень тонкий, поэтому глазки острые и очень плотные, в отличие от обычной ржавчины. Однако пассивное состояние Fe легко нарушается, потому что оно очень fragile.
By покрывая поверхность Железного изделия слоем фосфатов Mn и Fe, можно получить гораздо более прочную защитную пленку. Используемая для этого смесь («majef») состоит примерно из 90 МАС.%Mn(Hjpoal) t и 10-Fe(H, P04)*. 86) условия, способствующие образованию защитной пленки или условия, повышающие ее прочность, повышают коррозионную стойкость металла. Вещества, действующие в этом направлении(ингибиторы коррозии ) Я-0. АУ, Пт, НЛ, компакт-диск Мг. Фе Ряса. XIV-3I. типичная форма, в которой скорость коррозии зависит от рН среды. 2 4 6 8 Ю Г? U. Рисунок XIV-32.Зависимость скорости коррозии цинка от рН среды. Аль. ЗП / * 0
Многие металлы являются особенно сильными окислителями. Например, хромат натрия широко используется в железе в качестве антикоррозионной добавки к воде (около 0,1%). Другим превосходным ингибитором коррозии Fe является гексаметофосфат натрия (IX§ 1 add.42). Ионы OH также оказывают пассивирующее действие на железо. Напротив, увеличение концентрации ионов Н * (например, СО2 растворяется в воде при контакте с железом) приводит к значительному ускорению.
Его коррозия. Типичная форма, в которой скорость коррозии различных металлов зависит от рН среды показана на рисунке. XIV-31.As в качестве конкретного примера на рисунке XIV-32 приведена кривая цинка. 87) эффект, способствующий снятию защитной пленки с металла или ее разрыхлению, способствует коррозии.1 из самых активных стимуляторов-CI. Его действие обусловлено особенно быстрым разрушением большинства металлов морской водой.
Содержание растворенного кислорода в воде играет большую роль, способствуя связыванию основных продуктов в воде. Если одновременно присутствуют как раздражители, так и антикоррозионные агенты, то стабильность металлов сильно зависит от соотношения их концентраций (рис. XIV-33). 88) для предотвращения коррозии трубопроводов и многих других стальных конструкций. Защита протектора: создает электрический контакт между защищаемым объектом и протектором (более активные металлы (обычно Zn, Mg, AI или их сплавы)).При таком контакте возникнет гальваническая пара типа Zn-Fe (рис. XIV-30), которая будет разъедать протектор, а не защитный объект.
89) интересным электрическим методом является защита парового котла от corrosion. An изолированный от стенок анод помещают в котел, а сами эти стенки выполняют роль катодов. Слабый ток, проходящий через такие установки, действует как электрическая пара цинка и железа. То есть он подавляет первичную электрохимическую реакцию процесса коррозии и устраняет коррозию process.
At в то же время, это предотвращает отложение плотного слоя накипи на котле walls. At в то же время, потребление энергии составляет всего около 100 кт в 1 день на поверхность котла g2 2. Honyemtroia кои- Рисунок XTV-33. Эффект ИА Корр. И Кох. 90) чтобы полностью удалить слой ржавчины с Железного изделия, не повреждая саму поверхность, обычно используют соляную или серную кислоту вместе со специальными добавками для предотвращения растворения металла. Монография в*может быть использована для ингибитора коррозии металлов. 91) упомянутая выше коррозия железа (так называемая электрохимическая коррозия), основанная на электродном процессе, является общим случаем.
Однако коррозия этого металла очень важна, так как она также происходит за счет его непосредственного взаимодействия с другими веществами (то есть химической коррозии).Чаще всего это происходит, когда нагретое железо вступает в контакт с определенным газом, главным образом air. As в результате такой (так называемой газовой) коррозии металл также разрушается. 92) при нагревании железа на воздухе происходит рост слоя ржавчины за счет движения частиц железа и кислорода друг в друга (вдоль пустот кристаллической структуры оксида).Основное значение имеет диффузия ионов железа и electrons.
As в результате FeO, Fe30 и (очень горячий) RegОз последовательно формируются с расстоянием от поверхности металла. Объем FeO в 1,8 раза, а объем Fe30 «и Fe» 03(почти идентичных) в 2,1 раза превышает объем того же числа атомов Fe. Эта разница в объеме обусловлена хрупкостью пограничной связи между железом и мембраной FeO и сцеплением последней с большей частью ржавчины (окалины). 93) за счет взаимодействия железа с водяным паром при высоких температурах образуются водород и оксиды железа по следующим уравнениям: 4Н * 0-+ 3Fe * * Fes04 +4На + 34 ккал (менее 570 ° с) и Н20 + Fe * * FEO + H » + + 5 ккал (более 570 ° с).
Оба процесса обратимы, поэтому каждой температуре соответствует определенное равновесное состояние. Например, при 700°с отношение парциального давления водяного пара и водорода составляет приблизительно 0,4.При дальнейшем повышении температуры это соотношение увеличивается. Наоборот, снижение будет его decrease. As в результате при относительно низких температурах кислород в основном связывается с железом и водородом при более высоких температурах.
Избыток последнего способствует смещению равновесия влево, то есть восстановлению оксида до металла (рисунок Х1В-34). Использование рассматриваемой реакции основано на одном из технических способов получения водорода. Этот процесс обычно проводят при температуре около 700 ° С. оксид железа восстанавливают путем накаливания в потоке воды или генераторного газа и возвращают в производство. 94) соединение с более низкой валентностью Fe, Co, Ni (чем+2), хотя свойства этих элементов относительно невелики, но число таких соединений очень велико. Простейшим представителем является Fe (CO)$, Coj (CO)^ h Ni (CO) 4-карбонильное производное
95) пентакарбонил железа-стабильная желтоватая жидкость в воздухе (Мп. При охлаждении до −20°С, Мп 103°с, 18°С, давлении паров 28 мм рт. ст.) −196°С образование Fe (CO)$сопровождается выделением около 50 ккал / моль. Обычно восстановленное железо (из водорода и FeO при 350°С) получают взаимодействием железа и CO при 150-200°С и 100 Ат. Структура молекулы Fe (CO)$соответствует треугольной b-пирамиде вокруг атомов Fe. Расстояние Fe-C базовой плоскости (d = 1.83 A) равно、 * Путилов И. Н.. Балезна С. А. Барайнк В. П. ингибитор коррозии металлов. М. Госхимнсдат. 19С8. 1 секунда S4 Альтсыбеева А.. Левин С. ингибитор коррозии металлов. Л., «Химия», 1968.262 Е. Рисунок XIV-34.
Восстановление оксида железа водородом. По вертикали к нему[d» » 1.81 A), и< * (СО) −1.14 a. энергия связи Fe-c оценивается в 59 ккал / моль. Для постоянной мощности значение равно 2,5.Пентауглерод железа диамагнитен. Его ионизационный потенциал составляет 8.53 Э. 96)когда (ко) пар Фе сжигается в воздухе, очень чисто и мелкодисперсных FeiO *, который используется в качестве активного слоя ленты и абразивные материалы.
В отсутствие воздуха, СЭ (удар выше 130°C) пар разлагается на окись углерода и металлического железа, частицы которого находятся очень мелкие(0,5-20 г * к), форма частиц сферическая, и твердость высока. В частности, рост металлического железа может наблюдаться в отдельных частях газовой горелки. 97) частицы карбонильного железа легко намагничиваются и размагничиваются. Это является основой конструкции муфты порошковой муфты сцепления.
Такая муфта охватывает 2 части вала, передающие движение, не Соединенные непосредственно друг с другом, заполнена карбонильным порошком Fe(предпочтительны примеси ZnO), представляет собой своеобразную замкнутую форму, находящуюся в зоне действия мощного электромагнита. Если последний не включен, частицы порошка перемещаются свободно, и движение от одного вала к другому не передается. И наоборот, когда электромагнит включен, намагниченные частицы склеиваются и прочно соединяют обе части вала.
Поэтому механизм, оснащенный электромагнитной порошковой муфтой, может быстро включаться или выключаться. Подобные устройства применяются, в частности, для ракет(например, для управления газовыми рулями). 98) пентакарбонильное железо почти не растворяется в воде (медленно гидролизуется), но легко растворяется во многих органических растворителях.
В разбавленном эфирном растворе с температурой −80 ° С молекулы хлора, брома или йода связываются непосредственно с Fe(CO) s. Fe (CO) sTt, который получают добавлением композиции желтого(CI) к красновато-коричневому (I), неустойчив и при нагревании pr 1 молекула CO удаляется и переносится в карбогалогенид общей формулы Fe (CO) I. Для серии I — Br—C1 температура перехода повышается до −35, −10, 0°С соответственно. Цвет (желтый) от (CI) до почти черного (I) карбонил Fe(CO)»r сам разлагается при различных температурах, в зависимости от природы галогена: 10(CI), 55 (Vg). 75°C (I). в присутствии воды они отсекают CO и дают соответствующую соль галогенида железа. Интересно, что в серии CI-Br-I теплота реакции равна: Fe (CO)$ +Г〜 — Fe (CO)»r,+СО + Q, и fer, + 4co = Fe (co), R, + Qi Для Q последовательность равна+ 46, + 34 и+17 / слал, для Q+ 18,+ 28. +39 ккал.
Также описан другой представитель карбонилгарида в составе железа: Fe (CO) 5r2. (Со) ИП АР. Fe (CO) ar, и Fe (CO) 2r. 99) существует много известных продуктов, которые частично или полностью замещают монооксид углерода в Fe (CO) j другими нейтральными молекулами. Примерами являются Fe(co), что ГСЗ и Fe (со) з (SbClj) Дж. Особый интерес представляет производная от (СО) с Фе-(ПФС) X-тип. Его получают нагреванием смеси Fe (CO) s и PFS под давлением (14-34 АТМ) в течение длительного времени до 150-280°С. 100) Fe (PF5)$, крайний член этой серии, представляет собой сжатый PFS (140°C. 500 атм), синтезированный индивидуально путем нагревания смеси безводного порошка Felj и Cu в атмосфере.
Бледно-желтое кристаллическое вещество(Мп.45 ° C), диамагнитная, Летучая, высокая растворимость в органических растворителях. Вода Fe (PF) разлагается медленно. Соответствующее бесцветное производное гидрида, Hjfetpfj’H(mp. At −80°C), атомы водорода могут быть заменены N в металле(K) и n в галогене(CI, Br, I).
Из смешанных перфорированных организмов представляет интерес красное железо (NO) 2 (PF), (mp 72, bp 97°C). 101) в жидком хлористом водороде ферропентакарбонил может связывать протоны, и при низких температурах были выделены соли состава[Fe (CO) sH] PFg. Из других его реакций схема Fe (CO) s +2СС1″ =» Взаимодействие FeClj•+5с0 с четыреххлористым углеродом c2cu+.
Уравнение Fe (CO) s + H9SO4 = FeS04 + + + Hj + 5CO показывает, что реакция, протекающая плавно в растворе эфира, при разложении кислотой железа, содержащегося в угле, ведет себя аналогично металлу Fe. 102) Пайта Карбо масла под действием щелочи в утюг (в вакууме), например, утюг (со) з + Ба (О) и BaCOj 4- + Fе (со) 4Н в соответствии со схемой, утюг Карбо-нет-drinded формируется. Это бесцветное вещество(Мп.-70°С) испускает неприятный запах, а если он уже превышает −10 * С, то начинает разлагаться с удалением водорода.
Пространственная структура HaFe (CO) 4 соответствует тетраэдру группы CO вокруг атома Fe [<*(FeC) −1.8 A], по-видимому, вводя protons. To электронное облако центрального атома[d (HFe) α= 1.1 AJ. Для константы прочности связи Fe-C приведено значение k = 4.1. Под влиянием кислорода воздуха, hjfe (CO) 4 самопроизвольно ignites. In напротив, в отсутствие кислорода его водный раствор стабилен.
Кислотная функция водорода в рассматриваемых карбобиновых связях представлена очень четко(/(、= «4-10» *、Kt — = * 410-u): известны N кислых и средних солей, например NaHFe (CO) 4 и NatFe (CO 4.At в то же время Fe (CO) 4lt образуется под действием йода на Fe (CO) 4H2, поэтому гидрированный угольный ангидрид может быть заменен как металлом, так и галогеном. Продукт замещения водорода может быть отнесен к определенному циклу (например, — SiH.).!
Из индивидуальных металлических производных гидрированной угольной кислоты интересен диамагнитный красный SnlFe (CO) 4] 4, а его молекулярная структура показана на рисунке 1. X1V-3S Гонка XIV-Zb. Структура молекулы Sn / Fe (CO) » l4. РНС. Xiv-Св. Структура молекулы Fej (CO).」 л </(SnFe)■= » 2.54 а). HgCI * + H2Fe (CO) 4α= HgFe (CO) 4 +2НС1 также необходимо обратить внимание на желтые ртутные соли, образующиеся в соответствии с scheme. It устойчив на воздухе, не взаимодействует с кислотами и разлагается при нагревании (только Hg, Fe, CO) только около 150°С.
- Однако эта соль реагирует с йодом по схеме 21 * + HgFe (CO) 4-e Hglj + Fe (CO) 4lj. Последние соединения известны своими цис-и транс-формами и могут обратимо мигрировать друг к другу. 103) пентакарбонил железа легко растворим в жидком аммиаке. Pr 20°С (под давлением) они реагируют по схеме: Fc(CO) 5 + 4NH3 =(NH4) 2Fe (CO) 4 + CO (NH.),.Взаимодействие металлического натрия с Fe (CO) 5 в аммиачной среде протекает количественно по уравнению Fe (CO) 5 + 2Na = NaaFe (CO) 4 +СО. Этот процесс (где нет избытка Na) является наиболее удобным способом получения Na»Fe (CO) 4.
В отличие от HgFe (CO) 4, эта соль нестабильна и нерентабельна. Храня 104) Fe (CO’J $в свете, он частично удаляется из CO. Выделяются оранжевые кристаллы в составе Fe*(CO). 105) Рентгеноструктурное исследование кристаллов Fei (CO) e привело к молекулярной структуре, показанной в RNS. XIV-36 (с параметрами: a 1.9, b-1.15, s-1.8、
Нелетучие, почти нерастворимые в воде, эфире и бензоле, слабо растворимые в спирте и ацетоне, слабо растворимые в пиридине и толуоле. Людмила Фирмаль
/ «1.3, х = 2.46 а; Заб = 180°, Зед = зде = Зи = 78°, Заа = 94°. Зее = 87°).Центральная карбонильная группа имеет структуру » с » 6, которая связана с атомом железа валентностью, в то время как крайняя, как предполагается, имеет нормальную структуру углеродного окна, которое связано с атомом железа донорным акцептором. Соединение.
Волновое число карбонильной группы вокруг (III§ 6 add.12) обычно находится в диапазоне 2100-g-2000 см1,а в среднем-1900 — f-1800 см -*. Поскольку внешний электронный слой каждого атома железа содержит нечетное число электронов(25), днферрон-нопакарбонн должен обладать очень выраженным парамагнетизмом. Однако на практике oi является диамагнитным. Это может быть связано с сопряжением спинов обоих изолированных электронов с непараллельными (без взаимодействия) или образованием прямых связей между атомами железа.
Расстояние, разделяющее эти атомы (2.46 а), приблизительно равно характеристической длине металла (2.48 а), поэтому обычно принимается 2-я интерпретация. Однако ядерное расстояние металла всегда намного больше атомного расстояния соответствующей двухатомной молекулы(например, Cu и Cut, есть 2.55 и 2.22 A). отсюда следует, что подобие ядерного расстояния самому металлу не является доказательством существования валентных связей между атомами в комплексе. 106) комплексное (совместное) » СЭ(NHhFe (2 Центрального imidyl групп, удара, заняли 3 Центральный карбонильных Групп) напоминает распространенный тип ионов Fe2 (co), что электронной.
Оранжево-желтого твердого вещества (Мп 82°С) имеет характерный запах, сублимируется в высоком вакууме и растворяют в органических растворителях. Наличие большого дипольного момента (q = 3,28) указывает на нелинейность molecule. In в этом случае атомы железа имеют четное число электронов, поэтому они, вероятно, отсутствуют. 107) интересным производным Фе *(со) е-это белое вещество Fс2 (co), что судья по административным делам, который имеет оценочную структуру (Колорадо) IFEFEL (Колорадо)*, и нагревается за счет йода, плавление при нагревании выше −5°С, плавления и дал красную жидкость. Его цвет, по-видимому, обусловлен наличием отдельных молекул FeI (CO).«Растворы димеров в органических растворителях бывают только бледно-красными и диамагнитными, что указывает на важность диссоциации.
108) 1, из продуктов пиролиза ВЭД (со) при относительно низких температурах является ВЭД(со).Как правило, по схеме 3H2Fe (со)+ + + 3MnOj Дж = ионов FE3 (co), что ИА +ЗМпО4-3hjo, ч, Fе (со) 4 (потенциал системы [fefcohpvlfefcobb и [ГФЭ (Со) и J-Е0) л (со) 4li значения обозначаются −0.74, и −0,35 соответственно. Рассматриваемый Карбонель состоит из черных кристаллов, которые обладают значительной летучестью (60 ° С, давление паров 0,1 мм рт. ст.) и очень чувствительны к действию воздуха(окисляются до Феджоя). 140°C задается как температура пиролиза, но на практике он начинается earlier. In вода, Fej (CO) jj неразрешима и стабилизирована(ее можно также дистиллировать с водяным паром). она также упорна к сильным кислотам и алкалическому solutions. In Fej (CO), органический растворитель, растворяется лишь незначительно(образуется темно-зеленый раствор). * 109) структура молекулы Fej (CO), j пока не ясна.
Рентгеновские исследования кристалла показывают треугольный массив атомов железа (d (FeFe)» 2.8 A], а инфракрасные спектроскопические данные указывают на тип (CO)§Fe (СО)$ Fe (Fe) JFE (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (Fe) (2) (co) (co) (Co) (Co) (Co) (Co) (Co) (Co) (f 2.8 A) и инфракрасную спектроскопию данные показывают, что тип (Co) § Fe (Co) $ FEFE (со) (со) JFE (FEFE (со) (FEFE (Fe) (Fe) (Fe) (Fe) (Fe3) (CO) (2) (Co) (4), а также другие 2 двух атомов углерода железа также возможно, Fe3 Fe3 Fe3 110) спиртовой раствор щелочей реагирует с Fea (CO) и Fej (CO) по схеме 3:Fem(СО)»-f4кон = kacoj + kaffcm (со) n-i] + 2нао. Похож на оригинальный баллона, светло-коричневый ЕР ионов Fe2 (Co) и коричнево-красный (ионов FE3 (co), что является диамагнетиком.
Соответствующая свободная кислота нестабильна, и ее соль является vol Единичный катион соединения был выделен. Примерами являются умеренно растворим в воде[Н (NН3) eIFes (СО)]] и 1Ni (Нью-Хэмпшир)Эдж (РТП, (со) МИБ. Также была получена соль [Co (C9H5) aJJFe *(CO) 15].Карбонил получают из Fc «(CO) i » и еще не был выделен. 111) Fes (CO) благодаря действию на него йода можно получить бесцветные кристаллы FET (CO) alt, которые неустойчивы на воздухе(mp-5°С). при комнатной температуре пары этого вещества почти полностью диссоциированы и имеют красные молекулы Fe (CO) 4I. 112) из-за взаимодействия Fe (CO) с ацетиленовыми углеводородами (СЗНтС «СН) углерод-углеродные производные железа с составом, в котором Fes (Co) является C, были получены очень мало. Он разлагается при нагревании до 110°C и более. Это вещество диамагнитное.
Структура его молекулы основана на четырехугольной пирамиде, образованной атомом железа (d (FeFe)= 2.64 A).Каждый NC связан с 3 молекулами CO(средний d(FeC) 1,75 и</(CO)= 1,17 A).Атом углерода расположен несколько в плоскости дна пирамиды, а расстояние от вершины до атома Fe (1,96 а) несколько больше друг друга на 4 атома(1,89 а).Авторы исследования считают, что этот атом углерода является пятой конфигурацией. Видимо, для такого решения есть достаточные основания. 113) Тетракарбонил никеля (Ni(CO))) представляет собой бесцветную жидкость (mp 19, mp 43°C).Относительно легко прогрессирующее образование этого соединения иногда используется для отделения никеля от сопутствующих руд в других металлах.
Для этого ток углеродного окна заливают в предварительно восстановленную руду, нагревают до 80°С, а полученный Ni (CO) удаляют. Реакция протекает по следующему уравнению: Ni + 4CO = Ni (CO) 4 + 39 kcal. In в свою очередь, газовая смесь нагревается до 200°C, в результате чего происходит разложение Ni (CO)<очень чистый никель выделяется, а оксид углерода возвращается в производство. 114) структура молекулы Ni (CO) 4 соответствует тетраэдру с атомом Ni в центре[d (NiC)= 1.84, d(CO) −1.15 A].Данные отдельных авторов о мощности Co участка связанной дивергенции: K (NiC)= 1.95-g-2.95; to (CO)= » 16.0 Н-17Д то же самое относится к энергии связи Ni-С(39, 53, 68 или 73 ккал / моль). Потенциал ионизации молекулы Ni (CO) 4 составляет 8,35 э. Янкель карбон это diamagnetic.
It практически не растворяется в воде и не вступает в реакцию с разбавленными кислотами и щелочами, но хорошо растворяется в органических растворителях. Храните Ni (CO) 4 в герметичной трубке, он будет стабильным и постепенно окисляется на воздухе. Смесь пара и воздуха взрывоопасна. 115) токсичность никелевого углерода значительно выше, чем углеродного окна. Отравление может быть вызвано не только вдыханием паров, но и всасыванием во время прогулки, а его симптомы(одышка, синева кожи, лихорадка) часто появляются еще через 12 часов. Есть признаки этого. Ni (CO) 4 является канцерогенным веществом. Следы этого carboy El в сигаретном дыме / / порядка 0 * $Weight.
It стоит обратить внимание на наличие 116) расположение энергии связи NiC служит хорошим примером сложности таких оценок. При взаимодействии никеля с 4 оконными и углеродными молекулами (39 ккал / моль) хорошо устанавливается теплоемкость, с учетом теплоты сублимации металла (81 ккал / г атомов), в газообразном состоянии получаем Ni + 4CO Ni (CO) 4 -+. 120 ккал / моль таким образом, энергия каждой связи Ni-C должна быть равна 120: 4■ = » 30 ккал / моль.
Однако неявно предполагается, что энергия SW CO в карбониле равна энергии свободной молекулы монооксида углерода (257 ккал / моль).Но последний характеризуется d(CO)= 1.13 A и k (CO) −18,6.Таким образом, при переходе к карбонилу происходит увеличение ядерного расстояния и уменьшение силовой постоянной. И это тоже. Другой показывает небольшой, но постоянный сдвиг электронной плотности от связи CO к связи NiC (III§ 5 добавление 8). Это сопровождается соответствующим уменьшением начальной энергии NNH и увеличением 2-й энергии (степень неизвестна). 117) взаимодействие щелочных металлов в Ni (CO) и жидком аммиаке привело к тому, что HJ (CO) e-состав никеля закончился carbon.
It растворяется в спирте, ацетоне и пиридине при низкой температуре. Его кислотная природа очень слабо выражена, поэтому в аммиаке он производит не соли аммония, а HiNi) (CO) e’4nhs ammonia. By в результате действия последнего образуется Н *. N1 и Ион lHNi » (CO) e) — и (Ni4 (CO) FLP-темно-красный раствор, содержащий соли катионных[Ni (NHj) P P \ Другим способом образования таких соединений является LiJNI, (CO) СО]. МЮ {Ni4 (co), что®} (М Na, К) и MG [NI4 (co), что»]- это действие амальгамы этих металлов на основе Ni (co), что решение tetrafuran. Благодаря взаимодействию Н3Р04 с Li и соли на соответствующий нестабильной гидрокарбонатно-нуар были получены: темно-красный
Привет (ну(со) I]и черный фиолетовый Н * [Н «(со) е].В дополнение к вышесказанному, несколько других солей Н * М4(со)), например, компакт-дисков [ни ((со) е]) красновато-коричневый цвет, как известно. Все они очень чувствительны к окислению. ) д) предложена структура, в которой N1 атомов, расположенных в вершинах J-тетраэдра, удаляются друг от друга путем сшивания карбонильных групп, и еще 3 атома с 1 больше (свободная электронная пара-композитная со-группа, и четвертая смонтированная).
118)смешанного карбонильных производных никеля и Ni(со) м (pfv-максимальное прямое напряжение) 4-Ж, Н(для pf5)4(Д(НПВ)-2.10 д (ПФ) −1.56 а].Это вещество представляет собой бесцветную жидкость(Мп.- 55. Mp. 71°C). Niffcuk Ni {P(CH5) j] 4 и Ni [P(CeHs) i] 4 также были получены. Последнее соединение интересно для them. In раствор эфира ниже −35°С, он взаимодействует с молекулами кислорода до l (C. форма hsbbbni(0.). 119) комплекс этилена с аналогичным составом-[(С»Н$) sPbNi (С*Н4)—исследовали рентгеноструктурным методом analysis. As это видно из рисунка X1V-37.Атомы углерода этилена расположены симметрично относительно комплексообразователя, а связи между ними по длине находятся между двойными (1,34 а) и простыми (1,54 а).
Плоскость CNiC вращается на 12°относительно плоскости PNiP. Эти данные относятся к кристаллам (структура отдельных молекул может быть искажена), но тем не менее они свидетельствуют о наличии прямой валентной связи Ni-C. По-видимому, поскольку HjO *образуется при гидролизе (в эфире, насыщенном водой), прямая валентная связь Ni-O также присутствует в вышеуказанных комплексах С Oa. 120) избыток Ni (CO) при 0°С 4 и взаимодействие дифосфата с тетрафосфатом образуют твердый желтый P * CI4Ni (CO) sli, который стабилен только при низких температурах. Аналогично, вы можете получить P4OJNi (CO) s] 4 crystals. In во всех рассмотренных случаях в качестве донора выступает атом трехвалентного фосфора. замена молекул CO без изменения значения nnkel. .121) карбонил кобальта получают взаимодействием CoCOj со смесью Ne и CO под высоким давлением (-300 атм) при 160°C.
It диамагнитен и имеет оранжевый Кристалл (Мп.51°C), не растворим в воде, но хорошо растворим в органических растворителях. Кристаллы этн слабо летучи и могут сублимироваться в вакууме (давление паров при 15°С при 0,07 мм рт. ст., 45°С при 10 мм рт. ст.). было отмечено, что карбонил кобальта значительно менее токсичен, чем углерод Ni и Fe. 122) потенциал ионизации числителя Co *(CO) a равен C. его структура соответствует формуле (CO) jCo (CO) jCo (CO) s, а общий вид показан на рисунке. XIV-38.Сшивка карбонильной группы d (CoC) 1 1,92 а, а внешняя длина-1,80 А. Рисунок XIV-37. [{CeHshPlfNKCaHd.
Экологическая фигура атома N1. Однако молекулы (CO) 4CoCo (CO) с изомерной структурой 4n также существуют только между атомами кобальта[rf (CoCo) 2.54 A, энергия связи 13 ккал / моль), форма II отличается по теплу только от формы I только 1.3 Al /моль, что указывает. Смесь обоих изомеров содержит кристаллы, найденные в растворе пейтана, в котором равновесное содержание составляет 43% I 4 ~ + 57% II при комнатной температуре, или −104°C 84% I 4 ~ 16% II. 123) при контакте с воздухом Co»(CO)$постепенно окисляется до фиолетового основного карбоната кобальта.*
Бесплатные галоида полностью превращается в винтик. 6со * (со) разлагают сильной щелочью по схеме. (OH), 4-4-4HCO(CO) 4 4-8CO. Кислоты и почти никакого эффекта. В случае ацетилена(и его алкильные производные), реакция протекает по схеме со ((СО), 4-НССН=2СО4-4-(со) соссоснсо (СО)%. 124) нагревание Coj (CO) » чуть выше точки плавления, приводящее к частичному расщеплению CO с образованием xiv звезды. Схема состоит из черного карбоила Co4 (CO) c, который расщепляет Содсо). Над металлом 60 С и окисью углерода. Равновесие устанавливается в равновесном пространстве между обоими углеродами, расположение которых зависит от температуры.
Для структуры Co4 (CO) c была предложена модель с тетраэдрическим расположением атомов кобальта, в которой каждый из них соединяется с 2 сшитыми карбонильными группами и в то же время непосредственно связывается с другими атомами кобальта [(CO) m1 (M = LI, Na, K) получают взаимодействием Co (CO) a с соответствующим щелочным металлом в эфирной среде. 126) L—НСО (СО) 4-содержащий карбонил кобальта, образующийся при взаимодействии со щелочью G и другими щелочами, может быть получен прямым синтезом по схеме 2co4-8c0 4-HF (при нагревании под давлением).Схема 2Co (OH) 4-8KOH 4-11CO-3KjCO * 4-2KSo (CO) 4 4-6H, 0 и KCO(CO) 4-H, S04-KHS044-HC0 (C0) 4. В присутствии KCN первая реакция протекает в нормальных условиях. 2-й должен быть выполнен с сильным охлаждением.
Ниже точки плавления(-26 X) гидрокарбонат кобальта представляет собой бесцветное кристаллическое вещество, которое при плавлении становится желтым из-за инициирования разложения ia Ht и Co *(CO)®.иногда его используют для получения карбокарбонатов кобальта без использования высокого давления. Изменение давления пара по температуре HCO(CO) 4 (II§ 6 add.6) от 4 до 10 точки кипения рассчитывали по потоку монооксида углерода, который можно перегонять без выраженного разложения. Газообразный HCO (CO) 4 воняет и является высокотоксичным.
Кобальт в своей молекуле тетраэдрический и окружен карбонильной группой (rf (CoC)-» 1.81 A», непосредственно связанной с водородом[rf(CoH)] 1.59 A, ионами K〜 2D[Co (CO) 4J — (CoC) — 3.6.Л Растворимость HCO (CO) в воде составляет 0,06 моль / л. Если нет кислорода, раствор очень стабилен, а карбонилгидрин действует как сильная кислота. Потенциал восстановления системы 2 (Co) 4G * * (Co) 4b 4-2e составляет −0.4 об. 126) HCO(CO) 4 из металла (Na, Ag, Zn, Sn, Pb, Tl и др.), комплексных соединений ([НЛ(НГ.) » Ф [со(C5H^), Р,[СО(СН, СП.), П, и т. д.) или радикалов (CH * SJH, [Ml (CO)5) и d}). для их получения их часто получают не из гидрида кобальта, а из карбоксильного кобальта.
Например, когда винтик (со) взаимодействует с ртутью (гексан и Co в атмосферу), HgfCo (Колорадо) 4) J является сформированной. А в аммиаке формула 3Co ((CO) 4 4-I2NH, — 8CO 4-2 [Co (NH.) eJ(Co) 4b. Большинство рассматриваемых соединений обладают свойством ковалентных связей, таких как соли, которые очень чувствительны к окислению, но термическая стабильность может быть очень разной.
Например, CHjCo (CO) разлагается уже выше −35°C, в то время как CFjCo (CO) 4 перегоняется при 91°C без разложения. 127) оранжевые кристаллы HgfCo (CO)] 2 fd (CoHg) 2,5 2,50 A] особенно стабильны и не растворимы в воде, но легко растворимы в органических растворителях (например, из HgFe (CO)).Это вещество служит удобным исходным материалом для получения многих производных углерода (например, путем обменного разложения с сульфидами других металлов). Исходя из этого, в частности, была получена интересная производная типа Hg (Co (CO) s (3R$) 2li (здесь E_P, As, Sb и R_C» H5) с необычным координационным числом кобальта 5 obtained.
In на самом деле это не так, и 6-е место занимает атом ртути, который образует прямую валентную связь с обоими атомами кобальта. Эти вещества очень стабильны и нерастворимы в обычных растворителях. 128) нужно быть осторожным с несколькими другими соединениями. Таким образом, бесцветное NaCo (COJ) «растворяется в эфире(при 18 ° С при 14 г / л), что характерно для типичных солей и получается азваратизацией эфирного раствора Co» (CO)$натриевой амальгамы, не характерной. И хотя трехвалентный металл (подобный T1*) нерастворим в воде, соль комплексного катиона, наоборот, обычно растворима в воде.
Интересно, (Рен(Колорадо) Дж Джойс Кэрол Оутс (СО) 4]также известный как Рен 60 ° С (Ре (со) СЗ (со))), полученных методом пиролиза. Этот красно-оранжевый комплекс диамагнитный (Мп 66°С) разлагается только при 148°C. Это, вероятно, содержит прямое сотрудничество облигаций. Аналогичная связь между 3 различными металлами явно обнаружена в комплексе (C $ H$) (CO) jFeHgCo (CO) который. It представляет собой кристаллическое вещество оранжево-красного цвета, которое устойчиво в воздухе. 129) продукт замещения водорода HCO (CO) 4 галогеном неизвестен, а состав g_i, Br и R_C $ h $были получены галогениды nCofCOhPRsl. Они представляют собой диамагнитное твердое вещество, легко растворимое в визоле, светочувствительны и окисляются на воздухе. Амальгама натрия легко превращает их в NaJCo (CO) jprj. Тип комплекса (PR3) iCor (где Γ-CI, Br, 1)Mфφ= 3.1 и.
Очевидно, тетраэдрическая структура. 130) производное трнофторфосфида кобальта — [Co (PF.) 4] * — обладает свойством полимера и представляет собой фиолетовый Кристалл. 130) аналогичный Гндрокарбоинл HCo (PFe) был получен реакцией Coif-f Cu и PFj (2S0 атм, 200°C).Это зеленоватое вещество(Мп.-51, Мп. 80 ° С) разлагается постепенно в воздухе, но его пиролиз происходит только при 250°С или more. In в водных растворах он ведет себя как сильная кислота и дает слаборастворимый сольват, содержащий большой катион. Светло-желтый ч(Колорадо) (pfv-максимальное прямое напряжение) с) также известен(Мп 67, Мп 81°с).Он имеет такие же свойства, как Охс (ПФ) 4.By действием амальгамы калия на эфирном растворе, бесцветные кристаллы к(ко) (pfv-максимальное прямое напряжение) были получены. ПФС)4J.
At в то же время известно и коричневое Co (PF$) 4I, то есть водород HCo (PF$) 4 может быть замещен не только металлом, но и галоидом. (Pfv-максимальное прямое напряжение)>(Мп.-92, депутат. 81°с). 131) нитрозильные производные во многом сходны с карболами Fe, Co и Ni. Это связано с известным сходством оксида углерода и NO в качестве донора. Однако между ними существуют существенные различия.
Если 2 электрона вносят вклад в электронное облако центрального атома и общей молекулы CO, то ни одна молекула с наибольшим из них не вносит 3 электрона. them. In кроме того, из-за наличия неспаренных электронов. Оксид азота может также функционировать как положительный (NO*) или отрицательный (NO -) non, который обычно исключается в углероде monoxide. In NO-это формат, который включает в себя один или other.
In в большинстве случаев это трудно установить, и в этом вопросе все еще много неясностей. 132) замещение некоторых групп со группы NO приводит к образованию нитрозокарбонила. Это, например, реакция по схеме CO2 (CO) » + — f 2NO = 2CO-f 2Co (CO)» NO. At при нормальной температуре она прогрессирует медленно, но при температуре около 40°с прогрессирует очень быстро. Возможно выполнить обратное замещение NO на CO, и при 55°C или более расщепление NO начинается с образования Co«(CO) C.
В потоке азота при 50°C рассматриваемые карбоксилы могут быть дистиллированы без разложения. 133) Co (CO) «никакая молекула не диамагнитна, полярна (q 0.43), тетраэдр с атомом кобальта около своего центра (<*(CoC)= 1.83,d (CoN)=» 1.76 A].N0 (1,10±0,04 а) в нем является серединой между характеристической молекулой NO (1,15 а) и ионами N0 *(1,06 а).Для силы постоянной связи, дайте значение k (CoC)= 2. 9, к(Кон)= 3.9,к(СО)= 16.6,*(не)= 14.0. В нормальных условиях Co (CO) 3NO представляет собой летучую темно-красную жидкость (20°C, давление пара 65 мм рт. ст.).Твердое вещество(Мп.- I°C) является yellow. In вода, Co (CO) 3NO нерастворима(очень стабильна при хранении под ней) и смешивается с большинством органических растворителей в любой пропорции. 134) взаимодействие со схемой Fe( CO) s + 2NO = * ЗСО + Fe (co)2 (No) 2, медленное при комнатной температуре и быстрое при нагревании (не более 50°С).как видно из этой формулы, 3 молекулы донора 2 электронов (N0) замещают 2 молекулы донора 2 электронов (Co). Структура Fe (CO) 2 (NO) 2 соответствует почти тетраэдру, где атомы Fe находятся вблизи центра (<(FeC)= 1.84,d(FeN) −1.77,d (CO) −1.15,), аналогичные анионы[Fe (PF) » нет] \ 136) Fe (CO) » (ниже 45°C) слабо нагревается с оксидом азота под давлением с получением тетратрозильного железа, Fe(NO) 4.
На основе его молекулярной структуры и данных инфракрасной спектроскопии предложена формула (0 «N)» Fe (N = 0) «3 doior и 1 акцепторная группа N0.Это черное кристаллическое вещество неустойчиво и очень сильно реагирует. Когда H2SO добавляется в раствор для разбавления, он быстро распадается, образуя (Fe (NO)] SO. Последний комплекс также получен прямым взаимодействием No и FeSO и может быть отделен в виде нестабильного Красного Кристалла. 90 и<o (NO) 1745 см〜1, обычно считаются доказательствами наличия N0 *и Fe *(то есть восстановления железа оксидом азота).Образование ковалентных связей Fe * * — как и отсутствие связывания первых формальных зарядов частиц. Me Fe + NO — (FeNO)〜+ 11 ккал иногда используется для поиска оксида азота или веществ, которые могут выделяться в процессе разложения.
137) для части нитрозильной группы Fe (N0) известны различные продукты замещения. Из них галогениды типа Fe (NO)»r нестабильны(кроме того, стабильность снижается в серии I — Br-C1).Для нитрозильных групп, содержащихся в них, k (NO)= 14,0.Аналогичное значение (k (NO)) в 14.2 было найдено в{Fe (NO) * Ilt. It является наиболее стабильным представителем Димерного Галогенида{Fe ^ ’ohn **и показывает структуру его молекулы на рисунке. XIV-39. Димерен также [Fe(NO) 2NHJ2 с сшитым нмидом group. In контраст, Fe (NO) 2 (PF») 2 Monomer. It диамагнитная, Летучая красновато-коричневая жидкость, которая разлагается только при 18°C. 138) Красная Na (Fe (N0) 2SJ-4H20 и желтая kjfefnohstoj соль HjO известны с древних времен, первые соли получают обработкой продукта щелочью. 12 Б, В. Данные » СОА N0, 2-й взвешенный диоксид серы в растворе Na2S образуется при пропускании NO в раствор FeSO, содержащий KiSjO.
Такие производные кобальта и никеля имеют несколько иной состав KJ3 (NO) 2 (S20$) a) и представляют собой бронзовые (Co) или синие (Ni) кристаллы, которые легко растворяются в воде. Они образуются при хранении смеси солей соответствующего металла и NaaStO. Они относительно стабильны в атмосфере N0 n, поскольку могут быть растворены в воде и повторно отделены от раствора без разложения. 139) димерное производное черного (Fe (NO)^ CtH»] t μ= 1,88 (в бензоле).Диамагнитные 2 ядерные комплексы (NO) 2fel(C» H») tbFe (NO) 2, −2.53 (I) кобальтовые соединения аналогичного состава (|i■■1.67), в случае никеля получен красно-коричневый тетрамер[Ni (NO) PR2] 4 (R-CeH$).
Под действием прямых солнечных лучей смесь Co2 (CO) и N0 образует черные кристаллы Co (NO).Они термически стабильны до 100°C и быстро разлагаются на воздухе. Кобальт-triirosnosol молекулы, очевидно, имеет четыре рисовых структуры. ХIV ^ Фик ^ » 5дра молекула, любой угол бесплатно Электронная пара центрального атома. Она является хорошим донором и образует стабильный бор-метил с воздушным Кристаллом (ON) 2CoB (CH>). 141) простейшую формулу Co (NO) нитрозогалида ir получают взаимодействием CoHz и N0 в присутствии металлического цинка(C1,Br) или без него (I).
Они представляют собой черно-коричневые кристаллы (mp 101, 116, 131 ° С), которые могут сублимироваться потоком азота и постепенно разлагаться с удалением воздуха и NO. В парах и растворах соединений это димеры(в бензоле с = » 1,0), а в твердом состоянии димеры характерны только для хлоридов, и их кристаллы состоят из молекул (no) 2COC1CCO (no) s с хлорным мостиком (</(СоС1) 2. 40 A. ZCoCICo » = 90°].Кристалл бромистого состоит из цепочки типа-со (нет) 2.60 а («Кобра«)<и<CoBrCo 109°-со (нет) с 2 спальнями.
Цепная структура твердая. Состояние и йодид характерная длина этих соединений составляет k (N0) 14,7. 142) за счет взаимодействия ICofNOJaClb и PF, в присутствии меди (350 Ат, 50°С), получают диамагнитный Co (NO) (PFA) a * Oi, представляющий собой красновато-коричневую жидкость (mp.-92, депутат.81 °с), пара желтых, легко переходящих, почти вонючих. Это вещество очень стабильно для воды и воздуха, оно чувствительно к действию света. Пиролиз только при 163°С. его аналогами являются биполярные мономерные соединения типа Co (NO) (PR*) «(здесь R-C » H » и др.). 143) молекулы 3R®(E-P, As, Sb, R-C ` H » и др.) объединяют тетранд фриум (Co (no) iClJi, даже при комнатной температуре) с образованием со-типа черных МО изомерных диамагнитных соединений. (NO) » 3R * CL бромид и йодид реагируют одинаково.
Изотоп carbinoid производных со (нет) (Колорадо) (3Р*) т Тип Ко (но) (Колорадо) * 3Р тоже estesthen. Растворим в 130 ° С и бисольном Красном Co (NO) (СО) 2р (с»н*)«. 144) при взаимодействии Ni (CO) и оксида азота в различных средах образуются различные ионные производные (NiNO), и при повышении давления нитроксида реакция протекает в основном по следующему уравнению: Nl (CO)4-f 4NO-4CO-F + Ni (N0) N02 + N20.Синий порошок Ni (N0) N02 растворяется не в воде, а в хлороформе.
Установлено, что его пиролиз (90°С и более) сопровождается «сильной люминесценцией».» 145) в присутствии воды или спирта взаимодействие Ni (C0) и N0 протекает по-разному. То есть общая формула Ni(NO) (OR) n(OHb-n, где R сопровождается образованием синих соединений органических радикалов. Эти соединения имеют тетраэдрическую структуру с атомами. Никель рядом с центром. Для Ni (NO) (OH) найдите эффективный магнитный момент 2.97.It соответствует 2 неспаренным электронам на атом никеля (см. Рисунок XIV-21). в то же время оказалось, что волновое число, характерное для валентной связи оксида азота, равно 1828 см-(это означает, что он поддерживает положительный заряд этой молекулы. 14€) Ni (NO) jCl2 образуется из жидкого хлористого водорода из Ni (CO) и NOCI, а серо-зеленый порошок с композицией Ni (NO) Cli термостабильен до 150°С за счет взаимодействия паров исходного материала (в атмосфере аргона).Исследования магнитных свойств показали, что это вещество содержит 2 неспаренных электрона для каждого Ni Atom.
It нерастворим в бензоле, а при взаимодействии с растворителями, совместимыми с растворителями, он не расщепляется. Действие трифен-фосфина на него(в герметичной пробирке при 100°С) приводит к образованию синих игл в составе [(CfH*) 3P] 2Nl (no) CI. Диамагнитный I (C » H5) jP) aNi (NO) 2 также известен. q ’ составляет 4,26 (в бензоле). 147)ититрозонодид в составе Ni (NO) I получают взаимодействием Nil2 и цинковой пыли в NO и нагревают atmospheres. It представляет собой кристаллическое вещество зеленовато-черного цвета, слабо растворимое в воде и постепенно разлагающееся ею.
По-видимому, oin является тетрамером, и молекула{Ni (NO) Г] 4, по-видимому, построена как тетраэдр с атомом Ni на вершине и атомом G в центре плоскости. для #c (NO) указаны значения 14.3 и 13.9.Эти вещества могут вступать в реакцию с молекулами 3R(E_P. As. Sb, R_CeH5 и др.).Например, диамагнитный [Ni(N’o) (PRi) IJt был получен из ndnd n P (C * H$) с безводным спиртом. 148) низковалентные ионные внутренние производные известны для всех 3 элементов семейства железа. Основными типами самого Fe являются: Fe (NO) t (CNR) j, Fe(CO) 4CNR и Fe(CO), (CNR) 2.Здесь, R-CH», CBH и так далее.
Они являются красновато-коричневыми (с N0) или светло-желтыми (с CO) кристаллическими веществами. 149) карбонил кобальта взаимодействует с нзоинтриламином по уравнению: Co *(CO)$ — f 5CNR-4CO +(Co (CNR)$ HCo (CO) 4J. Желтая катионная соль (Co (CNR) sf. Координационное число равно 5, оно очень устойчиво в диамагнетизме и известно для многих анионов 1 валентности. Этот катион имеет структуру тригонального bprramnda с атомами кобальта в центре[rf (CoC) −1.87 A).Также красные (Ко (но) (Колорадо) (КНП)»] и[co (Колорадо) (КНП)»], где r-CBH4CH. 150) прогрессирование реакции инкель-карбонелей с CNR зависит от природы R.
поэтому фенилизоцианид замещается всеми 4 карбонильными группами, и только метилизоцианид становится 3.Они гидрофобны, поэтому устойчивы к действию водных растворов кислот и щелочей. Молекулярный кислород перемещает их в производное композиции (Oa) Ni(CNR) 2 (см. Дополнительные 118).Карбонильный лизоцианид Ni (CO) (CNCHj) интересен тем, что карбонильная группа, содержащаяся в его составе, очень сильно удерживается никелем.
151) инцеллюлярное производное канамида представляет собой диамагнитный комплекс состава Nij (CO) 2 (NCNR2) j (R CH»), который получают взаимодействием диметилниамида с избытком Ni (CO)<.OI-это оранжево-красный кристалл, чувствительный к действию воздуха, и при нагревании под вакуумом он распадается на Ni, CO и (CHj) 2NCN. Каждый атом никеля этого соединения может регулироваться двумя сшитыми группами CO молекулы idn и двумя атомами азота. 152) основная производная низкой валентности от элементов семейства FE является наиболее характерной для никеля.
Основными представителями являются KJNi (CN) 4,K4lNia(CN) J J и K <(Ni (CN) 4J. первое из этих соединений было получено восстановлением Kilnifcnj с гидразином, высокощелочной средой. Его магнитные свойства указывают на структуру миомера (в атоме Ni имеются неспаренные электроны). Производные ацетона аналогичного состава являются диамагнитными, то есть имеют размерную формулу K (Ni2 (C2R) e] (где R-Н, СН3.С » н 3) это интересно respond. In влажный воздух, KilNi (CN) 4) 4KJNi (CN) 4] + 2H20-fO «—4k2fni(CN) 4] -F разлагается на 4KOH и существует равновесие в его водном растворе (в отсутствие кислорода): 2lNi(CN) 4] » * [Ni2 (CN)f «„- f 2CN ’“- f 2CN’.
153) исследование цианида Ni41 в составе K 11 Ni (CN) e]лучше его называют первичным продуктом взаимодействия металлического калия и KJNi (CN) 4) в жидком аммиаке (также полученном действием водорода и Ka (Ni (CN) 4) при 390°C. размерность структуры этого красного кристаллического вещества соответствует структуре диамагнитного Анона[NIJ (CN) i) 4—типа (CN), NiNi (CN) t. то есть барренит включает в себя Ni-Ni связь(D = 2.32 a).в водных щелочных растворах Ka[NIA (CN) E) очень стабильна. При соединении с этим раствором осаждается оранжевый NiCN (возможно, полимер), который может поглощать монооксид углерода и образовывать Ni (CO) CN. 154) в водном растворе K <[Nia (CN) e) может связывать монооксид углерода с диамагнитным Ka (NI2 (CN) e (CO) 2].
Это желтое кристаллическое вещество в щелочной среде устойчиво и разлагается при соединении. Уравнение 2K „[Ni2(CN)e(CO).) — f 2HCI-2KCI + 3Ki (Ni (CN) 4] + Ni (CO) “ + H2.Окись углерода легко заменяет окись углерода, образуя красно-оранжевый диамагнитный Ки. (Ni (CN) jNO]. 155) более сильное восстановление металлическим калием раствора аммиака (Nl (CN) 4) ка приводит к образованию kjnifcn желтого^).Когда выделяется избыток аммиака, он приобретает медный цвет. Анон этой соли имеет тетраэдрическую структуру с атомом никеля в центре. Соль очень нестабильна, она быстро чернеет на воздухе и реагирует с водой по схеме 2K(Ni(CN)] -f-2H& — + K [[Ni2 (CN)]] + 2KCN + — f-2KOH-f H2.
Взаимодействие к „позицию[Ni (СN)“] и окиси углерода[или Ni (СО) 4 с цианистым], [KJNifCNbCO], KJNi (СN) 2 (со) 2]и К(Н (СН) (СО) з).Среди других производных Ni° следует упомянуть те, которые образовались при взаимодействии ацеталида K <(Ni (C2ff)]»] и жидкого аммиака K4 [Ni (CN) 4] и E (C2H5)». As, Sb) соединения ni (3R3) 4-типа. Белый кристалл Co {P (C2H5) 3] 4 также известен. 156) KJCofCN)»] под действием металлического калия был получен K ^ Co (CN)»].Это бледно-желтое вещество становится красно-коричневым при нагревании до комнатной температуры. Даже небольшое количество воздуха может быстро сломаться. Диамагнитный Ki [Co (CN) t], полученный аналогичным способом, несколько хорошо изучен, так как он имеет связи Co — Co в структуре iowaum.
Естественный коричневато-фиолетовый порошок, который сразу же выделяет водород из воды. 157) KtICo ^ CNJtCO], K из известного карбонильного занида кобальта?(СО2 (Чнб (Колорадо) 3J. K3lCo2 (СП)и (СО) 5].KJCoj (СN) 2 (co), что второй, KslCo(СN), СЮ и растворов na2 (со (СN).].Диамагнитный KICo (CN) (NO) (CO) также упоминается. 158) дипропильные производные низших частиц кобальта — [CoDipy3] CI04 и CoDipys — представляют собой синие кристаллические вещества, которые быстро окисляются на воздухе. То же самое относится и к черному Fe Dipy3.It также окисляется водой и спиртом и затем становится Федипым. в то же время известно черное Т ^ афе (ДИПИ) 3, а железный Цион равен −1.
Для никеля указан синий Ni (Dipy) 2, который имеет характеристику самопроизвольного воспламенения. 15. таким образом, столбец col2, [столбец col2], FeL2, (FeL2)и похожие на них, оранжевый c ч ч ч ч Фе ТЭК»(Мп 104°с), как известно. Все они очень чувствительны к воздуху. 160) из «цепи «[C5H5Fe (CO) 2] 2 известно C5H5Co (CO) 2. C5H5Co (PF3) 2, CsH5CoNO. CsH $ Ni (CO) t. когда последнее соединение нагревается до более чем 130°C, оно нагревается (CeH5bNii (COh. 161) как видно из приведенных выше материалов, производные Fe.
Существует ряд Co и Ni с характеристиками атомов от +1 до −2, но они все еще относительно слабо изучены. Все они несколько неустойчивы в нормальных условиях. Однако химия этих соединений очень интересна, и некоторые из них (например, карбонил железа и никеля) уже имеют различные применения. 162) значение+2 — это 1 из 2 наиболее характерных элементов семейства железа. Радиус Ионов Eu в кристаллах серий Fe (0.83), Co (0.82) и Ni (0.78 A) несколько уменьшен. Стандартный потенциал перехода E * a 2e = E, Fe Co и Ni составляют −0,64 соответственно. −0.28 n −0.23 дюйма (в кислой среде) или −0.88. −0,73 и −0,72 дюйма (щелочная среда).
Для константы диссоциации кислоты (e (OH2))•(E (OHa) n-iOHJ- + I• приведены значения 510®(Fe), 6-10 «(Co) и MO40 (Ni).Очевидно, что в Fe5 * n N1 это n = 6, но в Co ’это только 4. 163) теплота образования оксида ЭО из элементов составляет 64 (Fe), 57 (Co) и 57 ккал / моль(Ni).Оксид железа получают нагреванием ВЭЖХ с потоком H *или CO, кобальта и оксида никеля путем сильного обжига карбоната nx в отсутствие воздуха.
Согласно кристаллической структуре, все 3 закиси азота принадлежат к типу » / (EO) NaCl. 2.17, 2.12, равный 2.10 А. Их температура плавления составляет 1369, 1805 и 1984 ° C соответственно. Для теплоты сублимации FeO задается значение 108 ккал / моль, и пиролиз элемента начинает быть заметным, когда он превышает 2500 СС. 164) в процессе нейтрализации кислого раствора гидрат закиси азота Fe, Co и Ni выпадает в осадок при значении рН около 7.
Вследствие действия щелочи на соли кобальта вначале образуется синий осадок, а затем переходит в розово-красный цвет Co (OH) A. гидроксид железа, смесь Fe (OH) 2 и FE (OH) j между 1 или другим промежуточным составом, образуется сразу же под действием щелочи на смеси солей железа с железом. 165) растворимость вновь осажденного («активного») и уже кристаллизованного («инертного») гидроксида E (OH) 2 различна: LY-14 и 8-10 — » (Fe).2-S-5 и 2-10 «| in (Co). 2 и 610», in (Ni).Для константы диссоциации по схеме Eon * * * E «- F OH ’приведены значения MO» 4(Fe), 4-U» 5(Co), 3-U » 5. (СФ.)Гидроксид никеля удаляет воду по схеме Ni (0H) 2 = H2O + Ni0 только при 255°C, Co (OH) 2 работает аналогично(170 ° C в вакууме), о гидрате оксида железа 150 °
С разлагается по уравнению: 3Fe (OH) 2 ″ = «FejO» + «FejO» + Н2+2HaO. At в то же время, действие смешанного газа 混合+Н2 на железо при температуре выше 1300 ° С позволяет получить стабильный и Летучий Fe (Oh) в этих условиях. 2 (XII§ 4 add.52) то же самое верно для Co (OH) 2 n Ni (OH) 2.In кроме того, оказалось, что энергии связей E — OH равны (ккал / моль): 98 (Fe), 92(Co ).91 (ни). 166) кислотная функция рассматриваемого гидроксида выражена очень слабо. Однако взаимодействие с высокотемпературным концентрированным раствором сильных щелочей позволяет получать гидроксо-соли типа M} [E (OH) 4]и M | g [E (OH) b].Производные железа (гипоферрата) в чистом виде бесцветны, кобальт красновато-фиолетовый, Celtic-yellow-green. By вода, все гидроксозолы полностью гидролизуются.
Средство для сушки (Мп. Сухой Баомог, полученный при 1250°С) устойчив на воздухе. 167) большинство солей двухвалентных элементов семейства железа получают растворением металла(или его оксидов) в соответствующем растворе. acid. In в этом случае, что интересно, производные железа-железа образуются за счет взаимодействия разбавленного раствора сильного окислителя, такого как HNO *НСУ, с Fe в холоде. 168) eg4 безводный цвет Галогенида сильно зависит от природы аниона, как видно из следующего цветового сравнения: Ч ’ СГ Бесцветный красновато-синий желтовато-коричневый Зеленовато-желтый зеленый Тёмно-коричневый Красный, коричневый, черный. Черный
Некоторые константы этих желез приведены ниже: Тепло образования. ккал / моль Температура и температура. «С«••••• Коф, Collf «Кобра», Коль, 168 7Б 61 Си 1200 740 687 620 NIFt MCI * NjBr, nil, 167 73 62 23 II®1000 963 797 FeFt Р * ТЛТ Рабр Фельд Сто шестьдесят восемь 34 БВГ Шестьсот шестьдесят семь Одна тысяча сто Я ем Путем сублимации веществ (например, NiCl * M. 970°C) можно определить некоторую температуру плавления под давлением. Когда со сублимируется в вакууме, частично образуется менее стабильная желтая форма.
169) пары хлорида железа (ВР.1012 ° С), 2feci, * * FejCI * равновесие происходит при относительно низких температурах (около 400°С) и сильно перемешивается с левой стороны. Предполагая, что в этих условиях существуют только миомарные молекулы feg с энергией связи Fe-G, были найдены следующие анестетики: 96 (C1), 82 (Br), 66 ккал / моль (I). при повышении температуры восстановленное равновесие смещается вправо. То есть он увеличивает относительное содержание димера в паре(см. X $ 1, доп. 6).
170) фторид 3F, слабо растворимый в воде, но остальные железы хорошо плавятся. Они отделяются от раствора воды различным количеством кристаллических вод (обычно −4 или −6), но кристаллические гидраты характеризуются 6-кратной координацией пяти атомов. Например, Kryastadl CoC1g-6H, 0 — это [CoC1, (OH, M-2H, C>.Это включает в себя следующее: NiC! Основой Кристалла является 4H, 0-тример (NI (OHt) eWNiCUl. И FeC1, — 2H, 0-это тип цепи 3… СЭ (о) fClaFe (о>) отк… каждый атом железа Т-октаэдра имеет 2 уникальные молекулы воды (<(FeO)=-2.07 A}и 4 атома хлора (tf (FeCI) 2.49 A). 171)Как уже упоминалось в тексте, цвет кристаллических гидратов отличается от цвета безводных солей.
Изменения окраски prn вследствие непрерывного обезвоживания особенно выражены в CoCI, 1N, 0: 6/4 2 | ’ / с Копать тебя * краснее фиолетовый темно-синий фиолетовый Синий фиолетовый бледно-лето синий Н * * цвет Частично обезвоженный Кокл, даже при нормальной температуре-6ч, 0 приобретет 1 или другой цвет, в зависимости от степени влажности. Это является основанием для использования влагомера, то есть устройства, используемого для измерения влажности воздуха (в данном случае грубой), ваты или ткани, смоченной в ней solution.
At при высоких температурах потеря ионов кобальта в некоторой части связанной с ним воды происходит даже в растворе, сопровождаясь изменением цвета последнего ПРН heating. In в этом же направлении добавление различных веществ (например, CaClf, концентрированный HCl, спирт) способствует дегидратации Co **и замещению не-C1 молекул воды во Внутренней Сфере.«Различные соотношения CoC, — H / D и NiCI» — от H * 0 до ацетона (первая соль растворима, а вторая соль почти нерастворима) могут быть использованы для разделения кобальта на никель.
172) комплексное комплексообразование исследуемых желез ЭГ с галогенидами щелочных металлов, обладающими незначительными свойствами, и производными типа М * ЭГ удобнее получать в неводной среде. Поэтому при смешивании спиртового раствора [N (CH5) 4) C1 и FeCl он неустойчив на воздухе и осаждает бледно-желтые кристаллы^(CHibWFeCU), которые разлагаются только при температуре 280°C. Согласно магнитным данным(M, φ = 4,9), атом железа содержит 4 неспаренных электрона. 173) в серии F — — — CI» — Br—I», прочность связи E2 *с анионами decreases. In разбавленные водные растворы, не только сложные анионы EG и EG, но и катод ER диссоциируют очень сильно.
[Например, ионы * P » имеют тетраэдрическую структуру. Из продуктов замещения интерес представляют галогенные комплексы никеля следующего состава: [Nir, (PR») tl. Здесь Г-CI, Вг, 1 и R —с » н.」 Хлорид обеспечивает следующие структурные параметры: 4 (NiCQ-2.27, d (NiP)= 2.28 A, ZClNiCl-123*, ZPNiP 117 *.Голубое соединение Co (A1C1<) S, полученное слиянием cocjjj и A1CU, кристаллизуется как интересная шпинель (XI§ 2 ext.36): атом Мола образует плотную упаковку, его октаэдрическая пустота заполнена атомами алюминия, а тетраэдрическая пустота заполнена атомами кобальта.
174) цианид двухвалентного элемента семейства железа образуется в виде желто-коричневых (Fe), розовых (Co) или зеленых (N1) аморфных отложений путем прямого добавления KCN в раствор соответствующей соли. За пределами KCN эти осадки легко растворяются с образованием сложных цианидов, и их свойства значительно отличаются во всех 3 измерительных элементах. 176) осадок цифиндвквкели в присутствии избытка CN растворяется с образованием » желтого комплекса вниоио [N1 (CN)».F. Они соответствуют солям щелочных металлов. Например, пожелтение Пе ^ с Ni(СN) 4) обезвоживается и легко растворяется в воде. В сильных кислотах, разрушается выходом из Ni (СN).
Сначала зеленый осадок в приблизительном составе Ni (CNb-250hao после полного обезвоживания (pr * C)) становится серовато-желтым. Этот цианид представляет собой полимер типа (Ni (CN)] B, в объеме никеля он окружен 4 внутренними углеродами, а другая половина окружена 4 внутренними углеродами цианидной группы. Прямая 420 x схема N1 (CN)= Ni + 2C + N 17c) комплексное число Anon[Ni (CN)] * — квадратная структура, содержащая атом никеля в центре [rf (NiC) −1.86,</(CN) −1.17 A и k (NIC) −2.6 J. сумма этой нестабильности в водном растворе равна I * 10-A.
При добавлении цианида калия в KJNi (CN) » J цвет жидкости изменяется от оранжевого до красного. Это изменение цвета связано с обрезанием комплекса non-IN1 (CN)$) «„и является стабильным только за пределами CN’.КДж (ни (КН) 5)-2хто, соответствуя клетка калия, было отделено, и ККН постепенно было отключено от шара под условиями сильного cooling. It также было показано, что в ваннах типа INI (CN) 4XF ’(где X-NCS“, I»,
Br) могут образовываться смешанные комплексные ионы. Возможно, во всех этих случаях слабая кудрявая не-CN (CN〜или X -) и 1 молекула воды дополняют квадрупольную структуру (Ni (CN) 4p-к Октаэдру). 177) среди более сложных производных цианида никеля особый интерес представляет KtfNifCNBF*], реализуется донорно-акцепторная связь N — + — B. Это аморфное вещество выделяется под воздействием влаги в воздухе в различных растворителях. Но сама демонстрация довольно stable. In кроме того, примерный состав Ni (CN) t-NH | C» H»клатрата получают путем встряхивания суспензии цианида никеля в смеси аммиачной воды и бензола.
178) розовый осадок цианида двустворчатого кобальта, примерный состав-Co (CN)s-2,3 HtO. It вероятно, правильнее выразить это соединение формулой CoJCo (CN) J-7HjO. После обезвоживания он продолжает стонать и при нагревании по схеме 2CoJCo (CN)»] −3 (CN),+ 2CorfCo (CN) el (при 450 eC) и 2C0JC0(CN)»)-2CoJC + 4C + 3Nf (при 580 #C).
179) при обработке Co (CN) 2 цианистым калием (холодным) образуется зеленый раствор, после чего он постепенно становится красным. Раствор содержит комплексные соединения соединения K * 1Co (CN) J и K4Co (CN) » (с избытком хлорида калия).Первый тип этих комплексов-диаменит (%—0,20), который соответствует димерной структуре KJ (CN)$ CoCo (CN) s], имеющей прямую валентную связь между атомами кобальта. Мономер со 2-м перамигнитом(%-+1240). в твердом состоянии он не отделяется. 180) напротив, известен состав соли K » (Coi (CN) io] — 6HaO.
При промывке спиртом и эфиром (для удаления воды) его можно сохранить в целости», только если нет кислорода, содержащего Co**, он легко окислится и Co * 1.In вода, Kj {Co » (CN) io]хорошо растворяется(жидкость становится красной) и постепенно разлагается по следующей схеме. К «{кроватка (СN) Ио] +НОН — Ки(Со (СN) § ч] + KJo (СN) » ohj.
По-видимому, водород первой Внутренней Сферы Форма продукта разложения — H*.И H〜, то есть происходит гидролиз исходного комплекса, а кобальт окисляется протонами воды по схеме:2Co * a-H * * = 2Co * * — f H-C, что также совпадает с возможностью окисления исходного комплекса в воде(или спирте) и молекулярном водороде: K [Co, (CN), ol + H, * 2KJCo(CN) 5H.
Бесцветные ионы (Co (CN) eHp) также могут быть получены по более простой схеме:2Co » + 10CN ’+ H» = » 2 (Co (CN) jHp. NaCsjfCo (CN) в составе$ H (соответствующая соль) isolated. In твердотельная и щелочная среда, она стабильна. В то же время в высокощелочной среде происходит равновесие[Co(CN)sH)» + +ОН ’Н20+ [co (CN) s)».То есть процесс протекает внутри Анона по схеме Co * +Н. Ч * + Со*.Полученное производное одновалентного кобальта является сильным восстановителем (нормальный потенциал системы [Co (CN) e)/ / ’ 7lCo(CNS))’ в 12 л! KOH, приведено значение −1,2 в).
181) Fe * * когда соль цианида калия действует на раствор соли, первый осадок становится Fe(CN)(чистый белый).фактически, цианид железа соответствует формуле FerfFe (CN) e).Это связано с характером взаимодействия щелочи 3Fe (CN) t + 4KOH-2Fe (OH) i-f K <[Fe (CN)«].Пиролиз этого цианида происходит только при температуре выше 500 ° С и протекает по схеме 3Fe (CN) 2—Fe, C +5С+ 3N. 182) выше KCN осадок цианида железа растворяется за счет образования комплексного аниона{Fe (CN) e].
Ферроцинанд калия отделяется от раствора в виде желтых кристаллогидратов K [[Fe (CN) e] −3H20, теряет кристаллическую воду при 120 ° С и разлагается по схеме:3K [Fe(CN) e] — Fe «C + 5C-f 3N» + 12KCN. Ранее эта соль получалась путем слияния различного мусора со скотобойни (особенно крови) с поташем и железными обрезками, с техническим названием»Желтая кровяная соль».В настоящее время основным исходным продуктом для производства ферроцианида калия является очищенная масса газовых установок, в которой накапливаются цианистые соединения, выделяющиеся при сухой перегонке угля.
Ферроцианид калия диамагнитен. 183) Ион[Fe(CN) f) 4 — имеет октаэдрическую структуру с атомом железа в центре ((CN)-1.15 ,(CN) -15).Теплота образования Иона компонента NS по схеме Fe2 * — f-6CN » — [Fe (CNe))〜оценивается в 86 ккал / моль. Этот анион очень силен(общая константа нестабильности составляет 4 × 10″) и поэтому раствор ферроцианида не реагирует ни с Fe», ни с CN’.он также устойчив к воздействию воздуха, кислот и щелочей и нетоксичен. 184) крепким раствором Ка[Fе (СN) е) под действием концентрированной соляной кислоты, белый осадок железо в виде свободных кислот могут быть разделены.В сухом состоянии она устойчива, и когда есть влага, она частично окисляется воздухом и постепенно становится синим.В воде и спирте, ч»[Fе (СN)») легко растворяется.
Согласно первой 2 диссоциации водорода, он относится к очень сильной кислоте,но дальнейшая диссоциация протекает уже значительно слабее (/(«5-1CH, K4-510» 5).Плохо растворимый. 185) некоторые особенности простейшего ферроцианида очень interesting.So, для производных щелочных металлов характерен необычный ход термостабильности: LI K > Rb> Cs(ср. XIII§ 3 add.41).Раствор соли обычно содержит сильную связь между более или менее noi [Fe(CN) e) «» и соответствующими катионами. Например, константа диссоциации по схеме Ca [Fe (CN)«] «Ca» + — f [Fe (CNe) r» равна только 2-I0 ″ 4. 188) из трехвалентных катионов некоторые образуют железокислые анионы и плохо растворимые соединения.
К ним относятся, в частности, соли железа глубокого синего цвета в составе Fe <(Fe (CN)» b- * HjO (растворимость 2-10 ″ * моль / л).Fe * * * часто используется в химическом анализе для поиска ионов эта соль пиролиза идет по схеме: 3Fe4fFe(СN), Дж, 6 (СN)а + 7Fej (Fе (СN) 4) (на 200 ЕК), затем ВЭД (Fе (СN) е]-чистотой 3n2 + Фе, с + 5С(560°с).
Ferroxanides основного состава Фе » канал LFE(CN), который ebД°Kfeбыл {Fе(СN)»] также используются в качестве минеральных красок под названием «Железный синий».С увеличением содержания калия, их цвет меняется от темно-синего до светло-голубого. Лазурь железа почти нерастворима в воде и разбавленных кислотах, но легко разлагается щелочью. 187) кристаллическая структура смешанного ферроцианида KFe {Fe (CN) e] — HjO показана на рисунке. XIV-40.Из этого рисунка видно, что атомы Fe и Fe111 находятся в пределах одного типа решетки, но для атомов Znide、
Они не эквивалентны группе, они имеют тенденцию помещать Fe11 между атомами углерода, а Fe111 преобладает среди атомов азота. Очевидно, что одновременное присутствие атомов железа с разной степенью окисления обусловлено. Интенсивная окраска железа темно-синяя (XIII§ 3 add.51). 188) характерными свойствами H <(Fe (CN)]] являются ярко выраженная тенденция к комплексообразованию(например, кристаллический продукт, добавленный с серной кислотой в составе H [[Fe(CN) e]- 5H2SO<рисунок XIV 40.Структура и H » lFe (CN) e] * 7h2so. In добавление к неорганическим соединениям, KFe (Fe \ CN)* | * HjO. Железо Синозиновая кислота также связывает различные кислородсодержащие органические вещества(эфиры, спирты, альдегиды и др.).
Из них бесцветный кристаллический комплексов и использование эфира ч [[Fе(СN) » Ж * * 2(C2H5) 20.В какой-то степени, склонности для дальнейшего комплексообразования сохраняется в Солт-ч-α[Fе (СN) И. наиболее интересные из этих аддуктов является Каффе (СN) эж — * 6BFi (ср. МФ. Добавьте его в список. 177).
Для кислот железа и их производных существует монография 189) Родииды 3 (NCS) 2 легко растворимы в воде. Обычно его отделяют от раствора в виде Fe (NCS) 2ЗН20 (зеленый), co (NCS) 2—3H20 (фиолетовый) и Ni (NCS) 2-’/ gngo (желтый).Комплексные соединения типа Mj {3 (NCS)<] и M <[3 (NCS) e] легко образуются с щелочными металлами и тиоцианатом аммония. Для кобальта более характерно первое, а для железа и никеля-второе.
Связывание центрального атома с родиндовой группой обычно осуществляется через азот[d (3N) 2 2.15 A].Кобальт также, как известно, имеет комплексы с серной опосредованной bonds. An пример-ярко-зеленый[Co (PR.) 2 (SCN) j] (R-C * H5). Комплекс Родена Fe2 *. Co2 *и Nj2 *являются относительно хрупкими[3ncs * константы диссоциации ионов составляют 0,05 (Fe), 0,03(Co) и 0,02 (Ni)].Из них наиболее интересны производные кобальта, и большинство из них очень синие в безводном состоянии.
При растворении в небольшом количестве воды этот цвет сохраняется, а разбавление водного раствора превращается в розово-красный, характерный для со. Метод обнаружения кобальта, часто используемый в аналитической химии, основан на образовании комплекса thiocyanate. To для повышения чувствительности реакции обычно используют экстракцию полученного продукта смесью нзоамнол-спирта и эфира. Вместо того, чтобы создавать отдельный слой осколков, вы можете добавить ацетон в раствор.
Чувствительность реакции все еще улучшается. -Не знаю, правда ли это. В. Се Афер Г. Б. Харитонов Ю. И. .. Кузнецов В. Г. Корольков А. П. химия феррозмаккдо.»М. .»Наука»1971.320 сек、 100) Ni(NCS) a реагирует с раствором KNHa в жидком аммиаке с образованием красного слоистого осадка wickeramide-Nl (NHj).в вакууме ov стабилен до 120°C, а Ni (OH) » I NH *разлагается водой. 191) перхлорат е * выделяют в виде кристаллогидратов высокорастворимого е (CU ®.Нитрат меди (XIII§2, add.139) напротив, бледно-фиолетовый Co (NO») a и бледно-зеленый Ni (NOj) j являются энергонезависимыми. 194) если в кобальте нет влаги, то Ион[Co (NO»)^ i [Co (NOi)» J *(например, NO (Co(NO») iJ и[a $(CeNd) <ССо (Ж)») 4]).Каждая группа » N0 » координируется с кобальтом двумя кунелидами.Таким образом, в Ионе[Co (NO$)»]* кобальт имеет координационное число 8.
195) при нагревании Ni (NOi) часть кислорода отделяется и становится нитритом.Этот тип пиролиза, характерный для наиболее активных металлов из всех остальных металлов (IX§3), наблюдается только для nickel.In другим способом его нитрит получают реакцией Ni(CO) 4 + N204-Ni (NOi) » + 4CO, которая легко протекает в газовой фазе.Бледно-зеленый NI (NO> h) разлагается только в вакууме * prn 220 * C, стабильный до 260°C в аргоне atmosphere. No получены нитриты безводного кобальта и железа. То есть сложные нитриты известны как очень много производных N1, но очень мало производных Fe11 и Sop.
Основным типом является Mj [3 (N0a)]. 196) ацетат отделяют от раствора в виде кристаллогидрата E (CHjCOO) j•4HjO: бесцветного (Fe), красного (Co) или зеленого (N1).Они легко растворяются в воде и подвергаются сильному гидролизу. Ионы Chgcon1 * умеренно диссоциированы(/ C = 7-10″*).Все 3 ацетата были также получены с безводной композицией Инка. 197) карбонат Fe * , в то время как Co и N1 * несколько отличаются по способу их образования.
Углекислое железо (ReCO$) осаждается в виде белого осадка под действием растворимых промежуточных карбонатов (например, NaaCO>) на растворы солей Fe*.Во влажном состоянии он быстро зеленеет на воздухе, а затем становится коричневым, поскольку гидролиз и окисление протекают с образованием Fe(OH).в воде, содержащей углекислый газ, из-за образования бикарбоната Fe * карбонат растворяется замечательно. Известный только в растворе Fe (HCO » h), CO * n вода легко удаляется(особенно при нагревании) и легко разлагается снова, а FeCOj (практически нерастворимый в чистой воде) переходит в Ft (OH) на воздухе. Дело в том, что природная вода часто содержит расплавленное железо.
Дальнейшее разложение этого соединения (наряду с разложением гидрокарбоната кальция и гидрокарбоната магния) приводит к образованию накипи. FeCOi 3FeCO3-2CO в форме Si-минерала,+ FejO » + CO. По данным термической диссоциации этот карбонат составляет около 400 ^ 0. 198) под действием умеренных карбонатов на растворимые производные N1 Co осаждаются их основные карбонаты. Только при воздействии раствора бикарбоната щелочного металла осаждаются нейтральные карбонаты обоих элементов (в виде пурпурно-красных и бледно-зеленых кристаллогидратов состава ESOb-bNeO).Коко «(розовый) и Никой безводный (голубой)
Кристаллогидраты могут быть получены нагреванием до 140°С в герметичной трубке. Карбонат Co и Ni1 *со щелочным металлом и карбонатом аммония образует водорастворимую двойную соль типа M ^ E (CO») s], и в основном выделяется в 4 молекулах кристаллической воды. 199) кристаллогидрат 3CjO » — растворимость в воде оксалата, которая характеризуется 2HjO, очень мала(г / л): 1(Fe), 0,007(Co), 0,003 (Ni). Константа электролитической диссоциации по схеме ES составляет 04 Oe «4-CaO * 2-10» 4 (Fe), 2-10 *(Co), 5-10〜 * (Ni).Пиролиз оксалатов в Co и Ni в атмосфере азота протекает по схеме ESaO-2COa + E, а оксалаты железа разлагаются на оксиды. Комплекс щавелевой кислоты характеризуется типом M * [E (C * 0«) 2].
Двойные оксалаты Co и Ni плохо растворимы в воде, но соответствующие производные Fe почти легко растворимы. На фотографии использован состав Ki(Fe (C204hl-2H20. 200) сульфат исследуемого элемента обычно отделяют от раствора в виде кристаллогидрата 3S04-7H20.Бледно-зеленый FeS04-7H20 («железный сульфат») уже упоминался в трудах Альберта Магнуса(i§ 1 дополнение.
14).Кобальтовая соль красная, а никелевая-темно-зеленая. Сульфат никеля также характеризуется кристаллогидратом в составе MBO ^ bNgO, известным в 2 формах синего и зеленого цвета. 1 отделяют от раствора в диапазоне 31,5-53,3°С. 2-й-это prn при более высоких температурах. Вследствие электролитической диссоциации сульфаты всех 3-х элементов находятся близко друг к другу (/С-я 10«*).До около 60°C (Fe, Co) или 100°С (Ni), растворимость в воде увеличивается из-за нагрева, а затем начинает уменьшаться. Около 200 * C будет близко к нулю. В безводном состоянии Фесо «Белый, косо» красный, Нисо «желтый».
В серии Fe-Co-N1, термическая стабильность сульфата немножко увеличена. Разложение солей железа протекает по формуле 2FeSO < Fe2Oj-так ф * -ф soj, и давление диссоциации достигает 760 мм рт. Искусство. Около 680°C В сульфатах щелочных металлов рассматриваемый сульфат легко образует двойные соединения типа шеаита-Mj [3 (S04) i] −6H70.К последним относятся, в частности, бледно-зеленые соли железа, которые используются в химическом анализе-(NH4) alFe (S0″) 2] −6H20 («молярная соль»).Сине-зеленые никелевые соли аналогичного состава служат обычным исходным материалом для никелирования. Рубидиевая соль используется в виде К.
Поскольку она наименее растворима в Никель-шените, содержащем Rb и Cs, ее перекристаллизация может служить методом очистки для этого element. As для железа также выделяли свободную комплексную кислоту Hj {Fe (SO») aJ (соответствует связи). Сульфаты Fe, Co и Ni редко встречаются в природе, которые образуются в результате окисления соответствующих сульфидов. 201) сульфид Fe * \ Co и(NH)) при добавлении 2S в раствор соли nx в черной форме Ni осаждается и фактически нерастворим в осадке воды. Сразу после осаждения все сульфиды 3s легко растворяются в разбавленных кислотах, даже если они так же слабы, как уксусная кислота.
Стоя под раствором, CoS и NiS немедленно превращаются в растворимые модификации, но соотношение FeS и кислоты остается unchanged. In воздух, влажные сульфиды железа легко окисляются до FeSO.»Сульфиды кобальта и никеля имеют тенденцию образовывать коллоидные растворы. Все 3 сульфида находятся в природе, в дополнение к осадкам из водных растворов. solutions. It может также быть получен путем насильственного взаимодействия элементов во время нагрева. Oii кристаллизуется в соответствии с типом NiAs(rns.(См. XIII-79.)
Практическое применение в основном FeS(mp.1193bC) и служат обычным исходным материалом для производства сероводорода. Сероводород железа (Fe (SH) J или соответствующая соль основания (Fe (SH) OHJ) является важным компонентом некоторых лечебных грязей. 202) помимо сульфидов Fe14, Co1 и NI1 3S, некоторых других производных серы и ее аналогов, особенно селена 3Se, теллида ETB、 Сульфид 3Sj. Сравните теплоту их образования от элементов со следующей (ккал / моль): FeS Cos NISI FeS » CoSe NlSe | FeTe Cote NlTe I FeSj CoS2 NlSj 23 19 22 I 18 10 10 | 19 9 9 f 44 34 34 Все эти вещества характеризуются наличием кристаллической фазы с некоторым изменением состава (XII§ 2, см. Дополнительно
73).Например, фаза FeS стабильна при 50-55. 5 Ат.%Сера. 203) наиболее важным представителем рассматриваемых соединений является минерал пирит (FeS2).Годовой объем мирового производства составляет несколько миллионов тонн. Структура кристалла показана на рисунке. XIV-41. CoS2 и NiSj кристаллизуются равномерно. Ядерные расстояния E-S и C-S (A) изменяются интересным образом с этими кристаллами:2.26 и 2.18(Fe), 232 и 2.12 (Co). 2.40 и 2,07 (никель).Примерно при той же сумме последовательно удлиняются связи E-S, А связи S — S укорачиваются(приближаясь к длине молекулы H2S2-2,05 а). 204) в безводном состоянии большинство солей Fe, Co1 *и Ni * 4 могут добавлять до 6 молекул аммиака.
Термическая стабильность сложного аммиака, образующегося в этой серии, например, увеличивается, как видно из температуры ниже (°С), где давление аммиака достигает 500 мм рт. ст. ул.: lFe ) J-и (Ni (NHj) e]) составляют 8-10 — *и 2-10〜* соответственно. Рассматриваемый аммиак рассматривается в схеме[3(NHs) e] CI2-f 6HjO * * E (OH) 2 + 4NH4OH + 2NH » Cl. Поскольку стабильность аммиака увеличивается с серией Fe * — Co * * Ni, производное fe24 подвергается наиболее полному гидролизу в растворе. Однако даже при очень высоких концентрациях аммиака и солей аммония аммиак железа может быть получен из водных растворов (в отсутствие кислорода).
В случае Co и особенно Ni* равновесие под действием избытка аммиака и солей аммония смещается влево еще легче. Это связано с тем, что, в частности, аммиак (в отличие от сильной щелочи) не полностью осадить гидроокиси э (Он) 2, а в присутствии солей аммония в достаточной концентрации, осадков может не наступить вовсе. В дополнение к задержке в гидролизе солей аммония, солей аммония способствуют растворению гидроокиси э(Он) 2 за счет простого увеличения концентрации ионов NHj по схеме 3 (О) а + 2NH. 2NH4OH + 3 .
Действие кислорода в воздухе оказывает различное влияние на рассматриваемый аммиак. В зависимости от характера E2. Поскольку Fe (OH) j быстро окисляется до почти нерастворимого Fe (OH) j, равновесие вышеуказанной реакции гидролиза всегда смещается вправо, что приводит к полному разложению аммиака. Когда окисление от Co **до Co3 *протекает легко в аммиачной среде, содержащей кислород в атмосфере, образуется очень стабильный 3-валентный кобальтовый аммиак. Наконец, кислород не влияет на раствор аммиака никеля. Из них соли состава fNi (NHj)]] (CI04) j очень слабо растворимы, поэтому их можно использовать для определения никеля.
При особых условиях можно даже получить М Что ж… / «>В Ч?? »*- Фе-О-С Это хорошее место для начала. XIV-41. Структура кристалла FeS2. В воздухе фиолетовый кристаллогидраты свободных баз неуравновешенности-1 ни (ня) е](о) — 8HjO. Интересная производная от mannamate никель Гекса заключается в том, что polynodine-позициюNi (NН3) е)?Для константы связи прочности никеля hexaek задано значение(NiN)= 3,6. 205) кроме аммиака известен ряд комплексных соединений с различными органическими веществами: Fe2, Co2 и Ni.
К ним относятся, в частности, производные пиридина (X§ 2 add.51).Наиболее типичный октаэдрический комплекс общего типа [ERU » X2].Где X — это G».NCS -.НКО » и так далее on. In Кристалла[NiPy4X2], было показано, что CIOJ и BF7 non занимают необычное для них положение во Внутренней Сфере этих комплексов. Рентгеноструктурным исследованием хлоридов был октаэдр дислокаций, занятых атомом хлора, который давал следующие значения параметров: d(NiN) −2.00.РФ (Ники) » 2.39, д (Кон) 1.99.д(Упс!2.32 A. соответствующие производные железа представляют собой желтые кристаллы, и [для fepy4 (NCS) J родинидов известны 2 формы-желтая и фиолетовая.
Аналогичные кобальт-никелевые родиндные связи и D-молекула 12 не занимают независимых координационных сайтов, но образование комплекса состава (3Py4 (NCS) 2 (I2) 2), связанного с атомом серы комплекса Канифольной группы[CoPy2X2], также известно для кобальта. NCS)2]. в водной среде композитная связь ’ E_Py не особенно устойчива: константа диссоциации Ионов CoPy и NiPy равна 5 10 *’и L0-1 соответственно. 206) Этнлендиамнский комплекс (x§ 2 доб.50) известно для всех 3 элементов, кроме того, от 1 до 3 молекул этилового эпдиама (каждая из которых занимает 2 координационных сайта) могут быть объединены совместно с E2.Ниже сравниваются суммарные константы неустойчивости для ионов с различной степенью замещения. Коэны * ’ Сайт feen «5-10-5 | .10〜* 2-10 »» 2 «| 0»
Как видно из этих данных, стабильность этилендиаминового комплекса очень высока, что увеличивает количество Fe2 * — Co2 * — Ni2. в синем [NiEn2 (NCS) 2] расстояние rf(NiN) составляет 2,10 а(En) и 2,15 а (NCS).Состав комплексов аналогичен (NiEn2 (N03)2]и (NiEn2N03) CI0, «группа N0 интересна тем, что занимает первое корректирующее положение nnh 1, второе корректирующее положение 2». 207) характер координации с этлендиамином y близок к димеру, а glnox совпадает с m. последний имеет формулу CHj-C (NOH)-C (NOI I) — CHj (сокращенно H2Din) и представляет собой бесцветное кристаллическое вещество(mp.235 ° С), растворяется не в воде, а в спирте или эфире. Многие катионы (такие как Ni2, Fe2, Cu2) позволяют образовывать комплекс compounds.
So при взаимодействии с ионами никеля в водной валентной среде образуется большое количество розово-красного осадка в виде сильно плохо растворимого и стабильного комплекса, структура молекулы которого плоская. Это показано на рисунке. XIV-42. Dnmethylglyoxnm был первым органическим реагентом. Используется в неорганическом анализе (Л. Л. Чугаев, 1906 г.). широко используется при обнаружении и количественном определении никеля. 208) ацетон ацетонат (x§ 2 доб.80) характерен для кобальта и никеля.
Интересно, что в кристаллическом состоянии первый из nnh является тетрамером, а второй-тримером. Структуры (Co (C5H702) 2ja и[Ni (C5lb02) 2b) схематично показаны на рисунке XIV-43.In решение, полная константа нестабильности E (C и H202) 2 равна 3 * 10 «(Co) или 2 I0-«(Ni ) 209) циклические и производные-3(CsHs) 2 оранжевого цвета (Fe).Фиолетовый (Co) или зеленый (Ni).Последнее свойство обоих NlEn ’* 3.10- » Текст Коэнов NlEn ** Того 3.10- НЛ: 9-10 3 место Два — ВТОРОЙ. Один — ЕСТЬ. Три — К. 2-значения i0 ′
Рисунок X1V-42.Приведена схема структуры никелевого красителя хехрометра. О-о-н© — С О-Н Эти соединения похожи на Ферро-сыворотки (X§ 2 add.34).Для Никельсена даны d(NiC)—2.20 и d(CC)= 1.43 A. 210) для железа, слабостабильного оранжево-красного катионного[FeL «P (L — 1С гексаметилбензол» (СН8) c). t. pl. 164. т. 264eCJ. Темно-фиолетовый [FeLj] * (отделяется как IFeLjJPFe) и может быть сведен к коричневому FeLj. Последний имеет структуру d-бензольного хрома chromium (x§ 2 add.32), а его эффективный магнитный момент (3,08) соответствует 2 неспаренным электронам. Fholj катионов] ’ *и tCoLJv также известны. РНС. XIV-43.Ацетилацетонато » схема строения кобальта и никеля.
211) ионы Е * 4 могут быть комплексно связаны с нитрилами или isntrnl до 6 молекул (x§ 2 add.40).В качестве примеров комплексов могут быть использованы соединения типа (E (NCCH8) e] [3l4]. EはFe. Со (Н (NCCH.)) ((Чио)) 2J является синий, Н (NCCHs) 2 (Кло б) ярко-зеленая. в конце nnh, каждая группа СУ7 занимает 2 места регулировки. 212)из изонитрильных комплексов наиболее интересными являются производные cobalt. So зеленый[Co (CNCHj) «I2″в твердом состоянии диамагнитен(x = −180).в растворе он парамагнитен(x = +1050).это показывает мономерную природу этого комплекса в растворе и димеризацию при его переходе в твердое состояние (образование связей Co-Co).
С другой стороны, аналогичные бромиды и хлориды также являются мономерами в твердом состоянии (x,+ 1230 n 1250 соответственно).Известны твердые (Co (CNCH3) 5] (C10a) 2-2 формы парамагнитного синего (нестабильного) и диамагнитного красного (стабильного).Благодаря рентгеноструктурному исследованию последнего, параметр [(CH3NC) sCoCo (CNCHj) 5] ClO») » < / (CoCo)= 2.74.< Ф(Сос) » 1.88.РФ (СN)= я, 15. D (NC)= 1.50 A. при растворении связи Co-Co разрушаются парамагнитным образованием. Под действием восстановителя мономерного катиона, характерного для синей формы, этот комплекс олова легко переходит в стабильное производное соответствующего одновалентного кобальта (add 149).Для зеленого ICo (CNCaHs) 5 2 такой переход происходит даже при нагревании раствора.
213) интересна комплексная производная рассматриваемых элементов общего типа 9 (HN2S2) 2[ранее им была обусловлена Формула 3 (N’s) 4).Это черные (Fe) или темиобиолет (Co, Ni) кристаллы, устойчивые на воздухе и нерастворимые в воде, например, полученные взаимодействием S N <с металлическим карбонолом в бензольном растворе. Молекулярные мономеры были установлены в растворах в органических растворителях. Производные Fe и Co являются парамагнитными (соответственно, M, fp 2.94 и 1.90) и Ni (HN2S2) 2(decomp. At mp 155°C) является диамагнитным. Молекула 3 (HN2S2) 2 плоская и имеет структуру из 2 5-членных колец с общим атомом E.
Они, вероятно, образованы типом E (N (H)= S = * N — S—) 2. 1 ковалентная связь и 1 акцептора Дорно облигаций. 214) радиус не-е » *равен 0,67 а (Fe) или 0,64 а(Co).Переход Fe°+ e = Fe * a соответствует нормальному потенциалу+ 0,77 в (кислотная среда) или −0,56 в (щелочная среда). Аналогичный потенциал Co очень положительный, на+ 1.84 и + 0.17 дюйма.
Для никеля в кислой среде приведено значение+ 2.08. 215) в организме железобактерий происходит интересное использование процесса окисления от двухвалентного железа до трехвалентного железа. Последние поглощают соли Fe1 * N кислорода из окружающей среды; кроме того, реакция протекает внутри организма, приближенная формула * 4Fc(HC03) 3-f-2Н20-f Oj = * ■ = 4Fe (OH) s + fiC02-энергия помогает бактерии поддерживать свои жизненные функции. Таким образом, окисление железа является дыхательным актом железобактерий и вытесняет для них окисление углерода высших организмов. Железные бактерии в основном выращиваются в железистых источниках воды.
Болота, пруды и др. Часто в водопроводных трубах происходит масштабное развитие колоний. После гибели бактерии гидрат оксида железа, накопленный в оболочке, оседает на дно водоема и становится живой средой водоема, а со временем»болотная»или» озерная » железная руда превращается formed. In в частности, это происхождение Керчи, одного из крупнейших месторождений СССР.
216) FC / 0 $ ns теплота образования элемента составляет 196 ккал / моль. Природный оксид железа (обычно в виде «мумии»), в частности Д. И. помогает в приготовлении предложенного Менделеевым и широко применяемого«!В химической лаборатории Менделеева шпатлевка. Последний получается путем слияния 100 Весов. В расплавленную массу при перемешивании добавляют 25 частей кайфола и 25 частей воска, добавляют 30-40 частей пекарской мумии и 0,1-1 часть олифы (или льняного масла).Шпатлевка Менделеева хорошо прилипает к стеклу, металлу и др. (особенно при легком подогреве).
217) литературные данные о высоких оксидах кобальта и Инселя весьма противоречивы. Например, сообщается, что темно-коричневый Coj03 и серо-черный NijOj были получены путем тщательного нагревания соответствующих нитратов(согласно схеме 43 (N03) = > = 2E «Oz + 8KO» + O»).Эти данные не подтвердились. Еще менее вероятна точность отчетности о поступлениях в безводном состоянии оксида, такого как ЭО*.По-видимому, » в нормальных условиях максимум Co30 «(тепло, выделяемое из элементов 216 ккал / моль) и NiO могут существовать стабильно.
218) при нагревании CoO до 700°C на воздухе образуется черно-серый смешанный оксид Co * 0 <, и снова, когда он превышает 900°C, он возвращается к CoO. Интересной особенностью Co30 является способность к «хемосорбции» и кислороду (хотя перехода на CojOa нет).Этот оксид иногда используется для окрашивания стекла в различные оттенки синего цвета. 219)в процессе нейтрализации кислого раствора соли Fe * гидрат оксида железа осаждается вблизи рН = 3.Продукт растворимости Fe (OH) 3 имеет порядок 10 m. 2-J * 11 и 2-10 «.
Очень слабая кислотная функция солей Fe (OH) 3-феррита известна как в состоянии гидратации, так и безводном. Например, почти бесцветный Na5fFe (OH) eJ-5HjO отделяли от 50% раствора NaOH при нормальных условиях, а красный NaFeOj отделяли от кипящего 60%гидроксида натрия solution. As как правило, феррит различных металлов получают сушкой в воде и нерастворим.1 образование каустической соды основано на образовании (ПР по схеме Na3C03-f Fe203 » — COjf 4-2NaFc03 1100°C) и последующем гидролизе NaFeOj.
Ферриты общего типа M (FeOj)имеют шпинельную структуру (XI§ 2 ext.37) — нормальная (например, Ni), инверсия(например, Zn) или смешивание (например, Mn).Это полупроводники с очень разнообразным магнитным полем properties. It широко используется в машиностроении. 220) железная кислота в качестве основания(HFeO ..Ферромагнитный черный минерал магнетит-Fe30″(mp 1594°C) следует рассматривать как производное Fe(OH).
Оксид железа-оксид, соответствующий его составу, может быть получен сильным раскалением Fea03 (рис. XIV-44), образующимся в виде окалины (а также путем сжигания порошка Fe и воздуха) при горячей обработке стали ingots. So … Природный магнетит (иначе говоря, магнитная железная руда) нерастворим в щелочах и кислотах, обладает достаточно высокой электропроводностью, поэтому его используют для создания электродов и используют в различных электрохимических процессах. 22!)
Химическая формула магнетита Fe, (Fe, llOib и обратная структура шпинели. То есть половина атомов Fe111 находится в тетраэдрических пустотах, а другая половина и атомы Fc11-в октаэдрических пустотах. Это формула Fen, (Fem .Фень} 0″.Оксиды того же типа, что и Co30<магнетит, имеют явно различное валентное отношение-Co ^ Colv04.It используется формула Co’mso, которая кристаллизуется с тетраэдрической пустотой Colv и октаэдрической пустотой Co11)©*), как и в обычной шпинели. 222) гидрат оксида кобальта, полученный осаждением из водного раствора после сушки при 100°С, соответствует формуле Co (OH) 3.Около 150°C, он входит в CoO (OH), в C03O4 около 250 * 0.
Для продукта растворимости Co (OH) приведено значение 3-10-4. Из-за большого избытка сильной щелочи гидрат оксида кобальта может образовывать гидроксо-соль. Некоторые из последних были выделены в кристаллическом состоянии. Примером может служить зеленый калий кобальт-Kz (Co (OH) b).Некоторые безводные соли кобальта, такие как LiCoO, Ca (Co02) 2 и LaCoO, также были получены сухим способом. 223) произведение растворимости никеля (Ох, кажется, порядка 10-т).
Осадок гидрата оксида никеля, полученный в щелочной среде, явно имеет основной состав NiO (OH) и содержит различное количество адсорбированной воды. Нагревая сухой осадок, он теряет воду и кислород при температуре около 140°C и превращается в NiO. Черный, MN10 *(M Li. Na) и BA * NijO$, полученные сухим методом. 224) превращение Ni (OH) 2 в гидраты оксида может быть достигнуто не только чисто химическими средствами, но и электрическим окислением в щелочной среде.
Этот процесс лежит в основе действия щелочных аккумуляторов, наряду с использованием мощных окислительных свойств Ni (OH) 3 для генерации обратного тока. Последние включают электроды, сформированные из металлических порошков Fe, и электроды, сформированные из гидроксида никеля. Опустите оба электрода, чтобы сделать его мощным раствором KOM(добавление LiOH увеличит емкость аккумулятора).Химические процессы, происходящие при разряде и зарядке, могут быть перенесены по схеме. Разрядка Вт Fe + 2Ni (OH)s h-заряд Fe (OH),+ 2N1(0H)、
Напряжение на клеммах щелочной батареи во время разряда составляет около 1,8 вольт при времени зарядки 13 э. В настоящее время при изготовлении щелочных батарей вместо железа часто используется кадмий. Свинец (x§ 6 add.61) в отличие от щелочных аккумуляторов выдерживает перегрузки и длительный разряд. Благодаря этому он не только относительно легкий и ударопрочный, но и часто используется для обслуживания различного мобильного оборудования. Основным недостатком щелочных аккумуляторов является их низкая эффективность. Поэтому для крупномасштабной установки желательно использовать свинцовую батарею.
225) бесцветность Fe-ионов может быть установлена визуально, если создаются условия, существенно исключающие гидролиз. Такие условия выполняются, например, путем растворения Fe (C104) в молярной концентрации HC104.Получается бесцветный раствор, который при разбавлении становится желтым. Появление цвета связано с реакцией на Рисунок X1V-44. Равновесие термической диссоциации Fe2O3. Схема: [Fc (OM.)«]-[Fc (OH2) sOH] — + H — * * (Fc (OH2) 4(OH) 2] — + 2H \то есть замена в непосредственной среде молекул воды Fe3 * на легко деформируемые ионы OH.
Для значения кислотной константы диссоциации не-Fe* -, значение A’i = 610 «3 и 226) безводный галогенид ReH3 может быть получен взаимодействием железа с соответствующими свободными галогенами. Теплота их образования составляет 235 (F). 96 (С1), 63 (ВГ) ккал / моль-это йод, и в момент его измельчения образуется порошок с железным порошком. Это соответствует формуле Fe3le (или 2Felj Fclj).Это включает в себя трехвалентное железо и железо. Его разложение Поташем с реакцией Fe3le-f4K2C03= 8KI + Fe304 +4С02 может служить техническим способом получения йодида калия из свободного йода.
227) безводный FeF3 (т. е.> 1000°C) имеет зеленоватый цвет. Его пар (около 750°C) содержит как мономер, так и димер molecules. At воля, ФЭФ $немножко солубле(0.9 г / л), но легко солубле в разбавленном ХФ. 4.5 N Zn 0 2 кристаллогидраты перечислены. И то, и другое, по-видимому, может существовать в разных формах (обозначался розовый, бесцветный, зеленый), потому что даже чисто внешними символами-цветами-данные разных авторов сильно расходятся.
Для постоянной непрерывной электролитической диссоциации молекул FcF3 приведены следующие значения: — A ’ (■=2-10A / C?= 110 »./ C3 = 5-10 дюймов. В щелочных (и других) фторидах металлов FeF3 в основном образует стабильные двойные соли типов MjfFeFs]и M *(FeF «].Получено бледно-зеленое соединение в составе H3FeFe-3H20.И его оксоиновая соль ((ибобфефель или кристаллический бифосфат гидрата железа[Fe (HF2)3-3H20]. 228) при нагревании смеси FeF3 и Fe2O3 до 950 * 0 получали нерастворимый в воде черный оксо-фторид-Офэф. Его водонерастворимый рентгеновский аморфный гидрат OFcF-nHjO образуется путем обработки супер-осадка Fe (OH) 3 сильным раствором NHF F. 。
229) интересным является нерастворимый в воде кристаллический гидрат смешанного железа смешанного фторида-желтого FeFiFcF3 ′ 7Ha0 и темно-красного FeF2 FeF3ЗН20.При длительном нагревании до 180 см3 в потоке азота образуется синевато-серый безводный смешанный фторид Fe2F5. Старение смеси FeF3 и KFeF3 при 700 ° С образует «бронзу» типа K * FeF3 (VIII§ § 5 add. См. раздел 44). Установлено, что он характеризуется 0,18-0,25 (I), 0,40 ^ х ^ 0,60 (II) и 0,95 ^ х ^ 1 (111) 3 кристаллическими фазами со стабильными областями.
230) черно-коричневый FeCl3 (mp.308, Мп.315°C) может быть очищен сублимацией (при отсутствии воздуха).Плотность паров вблизи точки кипения соответствует 750 * С, что более чем в 2 раза превышает формулу (Fe2Cle).Для плоских молекул FcCI3 приведено значение d(FeCI)= 2,14 а, а увеличение температуры кипения спиртовых и эфирных растворов показывает простую формулу для содержащегося в них хлорида железа. Раствором fecl3 легко распространяется в воздухе. В водных растворах, он очень сильно диссоциирует (§в 5 добавить.18).Магнитные свойства не-Fe * указывают на наличие в нем 5 неспаренных электронов. Структура пары молекул Fe2Cle соответствует структуре, показанной на рисунке 2.Параметр D (FeCIKp»ftH)= 2,11 a, XI-21 * * U из ZClFcCI … = 128°, d (FcClcpea ..) = 2.28 а, zclfcclaayrp = 92°, то есть структурно аналогична молекуле aljcu.
При нагревании твердого хлорида железа до 500°С и более в вакууме начинается частичная диссоциация по схеме 2FeCl3 + 32 ккал * * 2FeCl2 + C12.Аналогичная термическая диссоциация красновато-коричневого FcBr3 протекает значительно легче(давление брома в атмосфере достигает 139°С), а йод-железо неустойчиво даже при комнатной температуре temperature. It не было получено в твердом состоянии, но оно явно было получено в газовой фазе с избытком йода. Может быть.
231) по хлориду многих других элементов FeCl3 в основном относится к типу X [FeCl, например, Na (mp. Соль 163°С), К (Мп.249 eC), NHJ (mp. Двести девяносто семь、 t. 390°С), (PCM *(mp 332°С).|ОРС1 ″ 1 * (МП!! 9°С).Теплота, получаемая по схеме MCJ + FeCI3 M[FeCIJ — это для натрия только 1 ккал / моль, тогда как калий-уже 7 ккал / моль. Исследование магнитных свойств желтых кристаллов prn 250vC, которые еще не расплавились[N (CH3) 4](FeC! Ил имеет 5 неспаренных электронов в атомах железа » = 5,98)и рентгеновскую структуру 4 800 * 0 Нафек!4 Иона в кристалле этого соединения (FeCI») — обнаружен искаженный тетраэдр с атомом железа вблизи центра[rf (FeCl)» » 2.18-t-2.22 A. ^ CIFeCI-105-t-113°].
Свободная кислота, соответствующая всем этим солеподобным веществам, может быть выделена в виде HFeCl4-3 (C «H») 20 действием газообразного хлористого водорода на раствор FeCl3 в полностью обезвоженном эфире. Изучение солей CsjFejCl *, свойства которых сходны с вышеупомянутыми солями, показало, что это вещество существует в 2 модификациях, 1 из которых включает Fe2ClJ-Анон(rns. По сравнению с VIII-38).
Еще 1 представляет собой двойное соединение типа 2Cs (FeCI»] CsCl. 232) feci3-6H20 (mp 37°C) при слиянии feci3 получается красный оксокрондо OFeCl. При температуре выше 300°C он разлагается на Fe2O3 и FeCl3. 233) получено взаимодействие Fecl3 и LiAIH ((в эфирной среде pr-78®С) твердой коричневатой железо-аланиновой кислоты-Fe (AlU) b. Его характеристики не описаны в разделе detail. It сообщалось, что он стабилен при комнатной температуре.
234)было отмечено, что обработка воды и Fecl3 гидротехнических сооружений имеет ряд преимуществ по сравнению с обработкой Alj (SO«) i (XI§ 2, дополнительно 62).Применяют ОИ в диапазоне рН от 4 до 8 сырой воды. 235) fecl3-6h20 сильный (20%) водный раствор является 1 из лучших ртутных эмульгаторов. При смешивании с этим раствором вся масса сразу превращается в серый порошок, а капельки ртути покрываются тонкой пленкой Hg20(при хранении она превращается в HgCl2 и превращается в HgO). 236) как было указано ранее (x§ 1 дополнение.24).Хлорид железа может проникать в графит. Когда этот встроенный продукт обрабатывается раствором металлического натрия в жидком аммиаке, железо восстанавливается до металла.
Полученный «ферромагнитный графит» может содержать до 22% Fe. It имеет лучшую силу сжатия, чем чистый графит, и может выдерживать длительный контакт с концентрированной соляной кислотой. 237) из трехвалентных галогенидов кобальта в отсутствие влаги светло-коричневый CoF3 стабилен. При температуре 250°C теплота, выделяемая элементом, оценивается в 185 ккал / моль. В кристалле CoFj атом кобальта окружен атомом фтора С d (CoF)= 1,89 a из 6.
Известны также некоторые его комплексные производные-голубая соль типа Mjfcofa] (где M-Li, Na. К. Rb. Cz). Ba3 (CoFeb и (CoF3 (NH3) 3).Щелочные соли По состоянию на 5.4, аммиачный комплекс является диамагнитным. Ярко-зеленый кристаллогидрат 2CoF3-7H20 выделяется охлажденным иратиевым анодом во время электролиза 40% раствора HF HF CoFa. То, что я нашел, = 4.47, что является более последовательным Билл 2 [CoF3 (OH2) 3] H20, чем[Co (OFI2) e] [CoF»] H20.It полностью гидролизуется водой с образованием Кофоли) * очень нестабильный темно-зеленый CoCl3 получают обработкой c5go3 хлористым водородом в темном месте под сухим эфирным слоем при −0°C.
238) можно получить NiF3, в результате фторирования безводного NlClj prn 150°С, было отмечено, что примерно дымясь в воздухе, образуется коричневое вещество с примерным составом Ni2Fs. Смесь ZKS1-J-NiSO-340°C фторировали с получением фиолетового K ^ NiFe), который относительно стабилен на воздухе и разлагается водой. Его магнитные свойства= 2,5) соответствуют 1 неспаренному электрону атома никеля с учетом возможного вклада орбитального момента. Нам удалось получить аналогичные комплексы извести и Na3 [NiFe), Rb и C$. 239) простой второй цианид железа неизвестен.
Напротив, производные ферросиликоновой кислоты хорошо изучены. Комплекс non[Fe (CN)»] 3 ″ очень стабилен. Теплота, выделяемая из отдельных ионов, оценивается в 70 ккал / моль. Исследования магнитных свойств показали, что в железе имеется 1 неспаренный электрон atom. To получают K[Fe (CN) e], мы обычно используем K «LFE (CN) e) окисленный в хлористоводородной кислоте средний свободный хлор.
Благодаря взаимодействию HCL с концентрированным раствором KaIFe (CN) e} получается свободная железо-железная кислота(в виде коричневых кристаллов), но ее трудно очистить от примесей. При диссоциации всех 3 водородов эта кислота очень сильна. Ferrantunide образует красно-коричневые кристаллы калия, при растирании он превращается в желтый порошок, легко растворяется в воде, и жидкость приобретает зеленовато-желтый цвет. На самом деле, кДж (Fе (СN) е]в основном используется в качестве сильного окислителя, и особенно активно в щелочной среде 8.
Например, вольфрам легко преобразуется в раствор по следующей формуле: W + 6Kj | Fe (CN) el 4 * 4-8KOH = 6K «[Fe (CN)$ l + KjW04-f4HjO. K3 (Fe (CN)«нагревание и концентрированный раствор KOH (1: 1) нагревание сопровождается образованием кислорода и образованием K «[Fe (CN) el. An интересной реакцией является схема Ba02-f 2Kj(Fe(CN) e)= KeBa [Fe (CN) eb + 02, которая может быть использована для определения перекиси бария. Имеются также признаки сильной токсичности железа.
240) облучение водного раствора Kj (Fe(CN) e]рассеянным солнечным светом вызывает резкое повышение РН с последующим постепенным снижением рН при помещении в темное место. Это, наверное, из-за чувствительности равновесия по схеме KslFe (СN) 4 — Н20 * * К2 [Fе (СN)sOH2] 4-цианистого калия и цианистого калия 4 — Н20 * * ГКН 4-Пхи. 241), а также ферроцианид(дополнительный 185).
Некоторые Фелицианы диссоциируют относительно слабо в растворе. Например, константа диссоциации La [Fe (CN)], Ca(Fe(CN) J J и Tl [Fc(CN) e]равна „2-U’ 4.1-u ’5 и 6-U’ 4. 242) из солей двухвалентного железа раствор Ka (Fe(CN) e) сразу дает железу синий осадок(добавьте 186). это смешно. Fe114 — [Fcn, (CN) e]К Fe1114 * [Fen(CN*)“, что валентная перегруппировка в l происходит почти мгновенно (обратный процесс может быть выполнен при 300°C в вакууме).Рассматриваемая реакция используется в аналитической химии для обнаружения Ионов Fe.
Железо, кроме Fe, может существовать только в растворе железо-водородного калия (соединения Fe, l, (Fe, n (CN) e)). 243) кроме сложного цианида железа, содержащего 6 CN-ноннонов, во Внутренней Сфере известно много соединений, в том числе только 5 таких ноннонов、 В-шестых, мы можем видеть, что другие ионы заняты NOJ, NCS», NCO〜, N’J, AsO,, SOj») или нейтральными молекулами (NO, СО, NHJ, Н20).
Подобные комплексы железа объединяются под названием прусских соединений. Последний может иметь сложный коллектор и железо 2 и 3 валентностей. Например, известны светло-желтый NajFe (CN) sNIIj] — 3H20 и темно-желтый Na2 | Fe (CN) sNHj] H80.В зависимости от заряда комплексообразователя и группы атомов заместителей CN » полная валентность аниона prcidium находится в диапазоне 2-5.An примером последнего типа является бледно-желтый Nas [Fe (CN)5S03) — 9H20.
244) общего типа растворов na2 (Фе (CNbNO), п = 2, 3, 4) является наиболее интересным. Железо, вероятно, принимает 2 значения во всех из них, но по мере увеличения n ковалентно связанный оксид азота изменяется в порядке NO * -NO-N0′, из которых только Na2 (Fe (CN)$ NO]является стабильным, а другие 2 соединения, полученные его восстановлением, нестабильны.
В кристаллах Na2 (Fc (CN) jN0)-2II20 комплексный Анон имеет искаженную октаэдрическую структуру, а атом железа находится вблизи центра(4 атома C смещаются на 0,2 а в сторону N0 относительно плоскости) и параметр D (FeC) 1,90 h −1,93. д (КН) — 1.14-Джей-1.19. d (FeN)= 1,63, d(NO)= 1,13 A. отсутствие связи характеризуется высоким значением o>(NO) » = «1940 cm’ x и k(N0) = 10,4, что совпадает с выражением. Для некоторой положительной поляризации N0 рассматриваемого вещества. По некоторым данным является диамагнитным, а по другим данным является M, ff да 1.4.
245) только что исследовал соединение прусида-Naj [Fe (CNbNO] −2!- BO) технически называется Нитропруссид натрия и используется в химическом анализе в качестве реагента Иона S «и так далее».Легко растворим в воде и alcohol. In S-Ион, раствор нитропруссина натрия, становится красно-фиолетовым, а в SO-Ионе он становится розово-красным. Есть обзорная статья на Нитропруссид натрия. 246) за счет взаимодействия KCN с солями двухвалентного кобальта в присутствии окислителя образуется цианид трехвалентного кобальтового комплекса.
Высокая концентрация kjlco (CN)] решение пенясь ss свет-желтые кристаллы. Интересно, что prn 240 ° С адсорбирует водород газа (без реакции), а prn 350°С десорбирует его. Октаэдрического Иона (со (СN) eJ3«, д (КП) « 1.90 А. / С (Сос) » найден значений 1,8 и к(КН)= 16.8. Когда KNO [Co (CN) e]выпаривают до сухости с HNO или H2SO4, а остаток выщелачивают водой, свободный кобальт, * синеродиновая кислота, Hj [Co (CN) e)-5H20 получают в виде бесцветных кристаллов. Последний также растворим в спирте, с сильной трисобиевой кислотой.
Большая часть его соли слегка растворяется в воде. 247) в дополнение к Hj[Co (CN)e].в случае трехвалентного кобальта известна комплексная кислота H [Co (CN) 4 (OH2) 2]и ее соответствующие соли (обычно красные).Когда свободная кислота нагревается до 120°C в течение длительного времени, образуется синий цианид кобальта-Co (CN) S, а когда он вступает в реакцию с водой, он становится красным гидратом состава Co (CN) s-2HaO. Когда соль H [Co (CN) 4 (OH2) 2]нагревается в тех же условиях, M-тип (Co (CGh’) ’ 1.
Анионная соль [(NCbCo-A-Co (CNb)» — t, где A-S02 или SnCl2. 248) подобно соединению железа Пруссия, известно также несколько комплексов кобальта. Они характеризуются замещением только анионных (G», H», OH-и др.) и no-цианидных групп. Водорастворимый желтый KalCo (CN) 5N01-2H20 диамагнитен. Найденное значение<o (NO)= 1125 см Интересно, что в Ka [Co (CN) 5SCN|, тиоцианиды прилипают к кобальту через серу, а не азот (обычно).
249) трехвалентный тиоцианат крови красного цвета легко образуется при взаимодействии Ионов Fe * и ионов NCS и может быть отделен от раствора в виде черно-красного кристаллогидрата Fe (NCS) j-3H20. Родановое железо образует относительно слабое соединение, примером которого является темно-красный KslFe (SCN)]] 2H20.Внутренняя сфера необратимо изоизомна, и когда она возвращается к связи Fe-N, она возвращается к своему первоначальному состоянию.
Интенсивное окрашивание роданового железа используется в качестве очень чувствительной реакции при обнаружении Fe-и NCS-ионов. Зависимость константы диссоциации раствора от ионной силы (pr-25°С) и от температуры (pr-25-ji-1,2) можно видеть из следующих данных:11 0.2 0.3 0.5 0.8 1.2 |°C 10 20 25 30 40 k-10 * S. 2 5.0 6.8 7l 7.7 | K-U* 6.7 7.2 7.7 8.0 8.4 250) нитрат железа (Fe (NOjb) получают растворением Fe в 25% азотной кислоте acid. It отделяется в виде почти бесцветного кристаллогидрата (обычно при 6 или 9H20). легко растворяется в эфире. •Б рнште А и б, н » Беляков В. Г. успехи химии, 1961, Си 2.532. Если он находится в воде, получается коричневый (гидролизованный) раствор.
Если добавить достаточное количество HNO, то он обесцветится* для константы диссоциации ионов FeNO ’ 3 приведено значение K 1.0. В безводном состоянии Fe (N03) 3 неизвестен. Однако Fe (N03h-Na0″, его структура соответствует формуле N0 [Fe (N03)»] композиция аддуктов может быть получена действием избытка N * 0 и порошка железа. С бортовым номером 03)»].
С водой они все растворяются. 251) в отличие от кобальтового железа, известен безводный Co(N03) 3.Атом Со в его молекуле регулируется 6 атомами кислорода(по 2 штуки от каждого NO r rpyn-py).Это вещество слабо парамагнитно и неустойчиво. 252) взаимодействие NiClj с избытком NaOj привело к образованию светло-зеленого комплекса NOj(Ni (NOj)»). Он имеет Л1, фф = 4.5 и переходит в NI (noj) 3 под вакуумом. 253) обычный ацетат железа может быть отделен только от концентрированной уксусной кислоты. При растворении в воде он подвергается очень сильному воздействию hydrolysis.
In в среде хлорной кислоты для константы диссоциации CHjCOOFe—Иона найдено значение K■= 3-10. 254) зеленовато-черный ацетат трехвалентного кобальта был получен электролитическим окислением Co (CH3COO) в среде уксусной кислоты. При нагревании только около 100°С не разлагается зеленый раствор Co (CH3COO) 3 в уксусной кислоте или спирте, остается стабильным в течение длительного времени, а в водной среде он медленно гидролизуется. 255) железный оксалат Fe состав?(Caoa) J-5HaO получают в виде желтого (зеленеющего на воздухе) микрокристаллического порошка.
Для кобальта подобные производные не являются known. In напротив, некоторые сложные оксалаты известны для обоих элементов. В качестве примера можно использовать золь аммония типа (NHa) 3 (3 (Cj04) 3] — 3,а константе диссоциации ионов FeCjO ^присваивается значение 4-10 Дж*. 25С) калиевые производные железа сходны по составу (и зеленому) и обладают интересными фотохимическими свойствами.
Его раствор (обычно содержащий около 0,01 Af и 0,1 H * SO»), под действием света X <4900 A, 2Ks [Fe (Crf>«) 4 = «2KJFe (CaO») a)+ KaCa04-f 2COa. Эта реакция протекает в строгом соответствии с количеством поглощенной энергии излучения, поэтому ее можно использовать для измерения последней. 257) 1. один из способов копирования чертежа основан на том же самом reaction. To для этого бумагу, пропитанную смесью раствора Ki (Fe (Cao α) 3l (или соответствующей лимонной кислоты) n K3 (Fe (CN) e]), наносят на кальку с рисунком, а затем подвергают сильному освещению.
Превращения железа в железо. Когда бумага опускается в воду, открытая область покрывается слоем железа-синего цвета, а белая линия остается вдоль линии, соответствующей чертежу, в результате чего получается синий чертеж(то есть синий).Покройте все детали оригинального рисунка. 258) соли цитрата железа и трисобазы-CHjCOOH-C (OH) COOH-CH3COOH (mp 153 ° C / (, = 710- *./ Ca-2U » / / Се4 * 10-7) — хорошо растворим в воде. Благодаря тому, что этот цитрат железа диссоциирует очень слабо(K = MO*»), 3-валентное железо прочно связывается с лимонной кислотой, с помощью которой можно удалять пятна ржавчины.
259) получают карбонатное производное трехвалентного железа, но, по-видимому, образующееся в сильном растворе щелочи carbonates. In при окислении двухвалентного кобальта перекисью водорода в присутствии избытка NaHC03 осаждается карбонатный комплекс koava Na3 (Co (C03) 3)-3HaO, плохо растворимый в воде. Это зеленое вещество (т. е. разложение 93°C) не теряет воду под вакуумом при 80°PA PaO, поэтому более точным может быть описание Na3 [Co (HC03) 3(OH) 3].Рассматриваемый карбонат служит удобным исходным соединением для синтеза других комплексов трибарного кобальта.
260) ангидрид сульфата железа отделяется в виде белого порошка при обработке концентрированной серной кислотой FcjOj. Вместе с водой образуется ряд кристаллических гидратов, из которых желтый Fe?(S04)s-9Hj0 является наиболее распространенным. Иногда он встречается естественным путем. Когда кристаллогидрат тщательно нагревают, они обезвоживаются, а когда безводный Fea(SOk) j дополнительно раскаляется, схема Fej(SO3) 3-f 135 kcale heg03-f 3S03 (давление диссоциации 760 мм рт. ст. 709°с).
Используя щелочные металлы и сульфат аммония, Fej (SO «b легко образует двойные соли типа квасцов-M [Fe (SO») j] — 12НзО. Наиболее распространенными железоаммонийными квасцами являются NH <(Fe (SO<) d’12нзо. It представляет собой почти бесцветный бисульфат в составе Na3 (Fe (S0″) 3] −3H} 0, так как он очень плохо растворим в воде. (Минеральный папоротник Атриум).Эта формула может быть более точной для описания Na3lFe (HSO») s (OH) j].Раствор Fej (SO») может растворить CujS и CuS (XIII§ 2 add.14).Для цистита диссоциация ионов FeS04, значение 2 I0 ′ 4 дается(v§ 5 add.19).
28!) При электролизе насыщенного раствора Косинуса в 40%серной кислоте 3-валентность сульфата кобальта может быть obtained. In в этом случае ОИ в аноде, охлажденном до 0°С, выделяется в виде зеленовато-голубого кристаллогидрата Coj (SO») 3- * 18Н} 0.Последние неустойчивы не только в растворе, но и в твердом теле state. In сульфаты щелочных металлов, Coj (SO) j образуют темно-синюю двойную соль квасцового типа. 262) трехвалентный сульфат ИТИЛА неизвестен.
Однако, когда Ni (OH) j обрабатывают раствором KHSO, образуется розовая жидкость, цвет которой отчетливо проявляется. Никель содержится в нем.」 263) оксид железа, практически нерастворимый в воде, осаждается в виде черного осадка вследствие действия растворимых сульфидов на Fe5 * salts. In во влажных условиях oi быстро разрушается в воздухе, что приводит к образованию Fe (OH) и выделению свободной серы. Разбавленный HC1 легко растворяется в соответствии со следующим уравнением. FejS+ 4CH1 2fecllj-f 2HjS +S. кристаллический Fe » Sj » представляет собой суспензию Fe (OH) j под давлением. При температуре около 200°C Fes и FeS разлагаются.
Сплавление Fe » S3 с сульфидом одновалентного металла дает кристаллическое бинарное соединение общей формулы M [FeS>].Кристаллы classio Violet-KFeSj образованы анионными цепями типа, между которыми расположен катион калия. 264) интересным производным железа является его композит nitride-LijIFeNJ. In отсутствие лития, Fe связывается непосредственно с азотом. Напротив, если нагреть смесь железа и лития (или Ллена) в атмосфере N, то получится нитрид вышеуказанного состава. В отличие от других производных Fes, продуктом легкого гидролиза Lle [FeNi] является Fe (OH) и оксид Черного Железа.
266) желто-оранжевый Ион Co (NH3) P * характеризуется эффективным радиусом 2,5 А и со-нестабильностью 3-10-ze. Длина связи кобальта и аммиачного азота составляет 1,94 А. Кроме того, данные для этой выходной константы очень противоречивы(5.4 и 1.1).Этот Ион разрушается концентрированной серной кислотой, и его термическая диссоциация происходит только при температуре около 200°C. In анионы, oi образуют более или менее сильный компаньон. Поэтому константа диссоциации[Co (NH3) e] SO равна только I-10-8.Для аналогичного внешнего диапазона регулирования в 3-валентном кобальтовом комплексе имеется обзорная статья. В дополнение к большому количеству солей, полученных из рассматриваемых ионов, было также получено свободное основание 1Co (NH3)e.
Очень сильный (/C3 MO -’).Большая емкость и высокая прочность [Co (NH»)»] позволяют использовать * + ’M’ о V R. успех химии*, 1970, M 4, 70S. Необходимо стабилизировать многие нестабильные отрицательные ions. An примером может служить кристаллогидрат низкой растворимости[Co ^ H3LeOe(C03)c]-12H20(XII§ 1, см. Приложение 61). [Co (NH3bJIj) образует непрерывный ряд твердых растворов[Co (NH3bJI2)и [XII§ 2, добавлено. См. раздел 70).
286) [Co(NHs) 4] ’ * продуктов частичного замещения аммиака на катионный, моно-замещенный [Co (NH|) sX] известен конкретно, и X занят в качестве нейтральной молекулы(например, H20).Анионы заряжают до 3 ионов (например, PO|〜).Вследствие контакта кобальта и кислорода, образующегося при замещении, соединение имеет цвет от розового до красного, фтор-розовый, хлор-красный, бром-фиолетовый, йод-зеленый, азотистый азот (например, аммиачный азот) или оранжевый. 267) некоторые из этих соединений очень interesting.
So катион (Co (NH3bOH2) «является слабой кислотой (/(«710»)).[CofNHsbNO] 1 производные катионов известны в 2 формах: черной и красной. Оба являются диамагнитными, но первоначально они являются мономерами. Первая форма имеет 4 молекулы аммиака (d (CoN)) в плоскости»1.93 A», 5-я молекула (d (CoN)) «1.99 A»в транс-положении до оксида азота. Последний параметр[д (нет) 1.26 А.» (п0)^ » •= 1170 cjt и характеризуется как нет. Запуск F (NHS) » Coon NOCO (NHJ) S) 1.Очень неустойчивый Кристалл железа [iron [NH»BNO] Cl2], это соединение группы ntrorozo имеет отрицательный заряд. 268) среди других комплексных соединений рассматриваемого элемента в трехвалентном состоянии следует прежде всего упомянуть общее производное общего рода (C5Hs) 23*.Образует соль синего цвета (Fe).
Цвет желтый (co) или оранжевый (ВБИ).Катоной (С$Н3) 2Соф характеризуется исключительной химической стойкостью (не подвержен воздействию щелочи, кислоты или царской водки), и (cshj) jcooh является сильным основанием. 260) для кобальта и железа известен изотолильный комплекс и ацетилацетонат. Общая константа нестабильности красного железа (CsH7Oj)>(mp187°С) составляет от 6 до 10″.в комплексах типа [3r3 (PR3) 2] (Γ-CI. Br. a R-CH $и так далее. 。) Магнитный момент соединений никеля соответствует 1, а кобальта — 2 неспаренным электронам. Темно-синий хлоридный комплекс никеля(содержащий R-C2H3) плавится при 63°C, в то время как кобальт плавится при 104 ° C. тип NiEn2rs (G-C1.(Br) комплекс трехвалентного никеля.
Nas{Ni (ONCH2#)] типа также известен как производное оксима льда (HONCH2, температура кипения 84°с), интересен как своей прочностью ичневой краситель, так и окисляющим Na2 [никель (ONCHab]уже в атмосфере кислорода, последнее соединение действует (230 * антимагнитный с) (X -… −102) и не легко растворим в воде, но не растворим в органических растворителях. 270) начиная с ацетилацетоната кобальта, n2co [P (C» Hs) 3] 3 и n2co (H) (P (C $ Hs) ab синтезировали комплексы, содержащие молекулы азота в виде ligands. It очень устойчив к бензолу и эфиру.
Первое из этих соединений в растворе взаимодействует с молекулярным водородом в обратимой реакции: N2ColP(C» Hj) 3b-f Ha * * H | Co {P(QHsb} » -l -.) Оранжево-желтый — фн2. Рентгеноструктурные исследования 2-го кристалла показали, что молекула N2 является однокоординатной жесткой, а координация кобальта тривиально пиламандальна:3 атома Р в основании, N и H атомы в вершине (d (CoP) 2.2, d (CoN)= 1.8 d (Con) = 1.6 A). Для железа синтезированы аналогичные комплексы с составом N2Fe [P (C2Hj) 3]) и N2Fe (H2) (PRsb).2-й из них Н2 или PR3 группы PR3 1[R3-C2Hs(CeH3) 2J, чем N2 Для никеля получены темиолированные комплексы состава N ^ NKPRabb (R = C » Нц). в бензольном растворе он диссоциирует на n2ni (PR3) 2 и Ni(PR3) 2.
271) по-видимому, пероксиды железа получают обработкой в концентрациях выше −50% HiOj и 30% спирта KOH в эфирном растворе PeCI.Это соединение представляет собой красный порошок, который стабилен только при низких температурах. Структурная формула Hoo(OH) FeOOFe (OH) ooh обусловливает серо-зеленые пероксидные производные никеля, образующиеся при аналогичных условиях, обладающие еще худшими свойствами. Кобальт характеризуется наличием пероксидной группы в комплексном катионе.
272) если раствор Co(NCS)сильно насыщен аммиаком и воздухом, образуется коричневый пероксиновый комплекс [(NHjbCoOiCo(NH|) 8) (NCS) 4.Здания Соответствующие катионы схематично показаны на рисунке. XIV-45. 273) наиболее интересной является зеленая производная катиона [(NH3) 8CoOiCo (NHj) 8) * \аниона известной длины (SG, N0 «СУ〜SOJ», SIFF) с магнитным моментом, соответствующим одному «неспаренному электрону«.Рентгеноструктурное исследование этого катиона «d(OO) -» 1.32 A. f-o 0 ^ co 97 cUpeR0, ss’DN0MU H0UI O.」 Долгая и неясная проблема ва Райса. ХIV-45.*
Лености кобальта в данном типе комплексов со схемой » система»( [(NHJ » CoOaCo и сине-черного cscoj04 (Af»$ # = 1.1) были отмечены препараты.Для никель-черный к » Ниос (А1, ФФ 2.1) и удобно.Свойства этих соединений аналогичны свойствам производных железа. 277) при взаимодействии Ni (NOj)*и диметилглиоксима (HjDm) в сильно щелочной среде под действием атмосферного кислорода образуется темно-красный раствор.
Предполагается, что его цвет обусловлен комплексным анионом[NiDm»} 1″.4, включая никель. 278) общая формула 3S8, формально 4-валентные Fe, Co и Ni в сульфидах (дополнительно 203).Однако в природе эти сульфиды являются солями сероводорода (H3S>), а элементами семейства железа в них являются divalent. In природа, только FeS®обнаружено от сульфида под рассмотрением. Черный порошок CoS » образуется при длительном воздействии избытка расплавленной серы.
Темно-серый NIS * май Его получают путем обжига смеси Нико и серной кислоты и Како.* Эти дисульфиды и FeSj, при нагревании, отделяют часть серы и перемещают в соответствующие sulfides. In в случае пирита реакция со схемой FeSj + 21 ккал * * FeS-Fes-F S замечательно обратима в диапазоне 550-700 ° С. 279) производные пятивалентного состояния рассматриваемого элемента известны для железа и кобальта. Черный K * Fe04 был получен сплавлением FejOj и оксида калия в атмосфере кислорода при определенных условиях. Магнитный момент 3.7 близок к значению спина 3.88.
Характеристики Fe5 *(рисунок XIV-21).Взаимодействие этого соединения с водой сопровождается диспропорционированием по схеме 6K * Fe04 +8Н20=■2Fe (OH)3-f 4KjFe04-f-YuKON. In как производственные методы, так и свойства, сине-черный KZCO04 подобен производному железа. 280)в дополнение к реакции, показанной в тексте, можно получить соли трехвалентного железа сплавлением Fea03 и NasOj, действием хлора на суспензию Fe (OH) j в концентрированной щелочи или анодированием железа в щелочной среде.
Для KtFe04, найдено M≒2.8.Это согласуется со спиновыми свойствами шестивалентного железа. Автолиз этой соли в растворе следует следующему уравнению: 4K * Fe04 + UNaO = 8KOH-f-4Fe (OH)» — fЗО,. ПЭ-аш над 10 Фео довольно стабилизирован. Окислительный потенциал систем FeT,/ Fe и n в кислой среде, вероятно, составляет около 2,0 дюйма. В Бафеой, при нагревании, соли железной кислоты легко разлагаются путем удаления кислорода (пиролиз бафе04 происходит уже выше 120°С, в то время как Каре04 происходит выше 198°с).
Имеется обзорная статья * о производных высокой валентности железа. 281) расплавленный KF-3HF никелевым анодом (VII§ I ext.28) электролиз предполагает образование ярко-красного NiF. Это вещество, которое еще не было изучено, нерастворимо в жидком HF; выше 100 ° С (или вакуум) фтор удаляется, и NiFi разлагается с водой. HF и озонированный кислород.
Смотрите также:
| Подгруппа меди | Платиновые металлы |
| Поляризация ионов | Комплексные соединения |

