Оглавление:













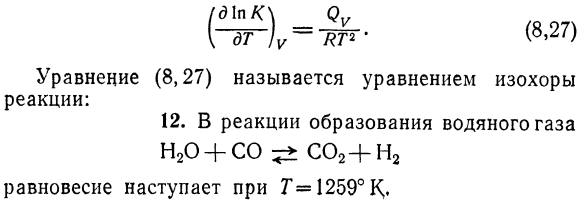

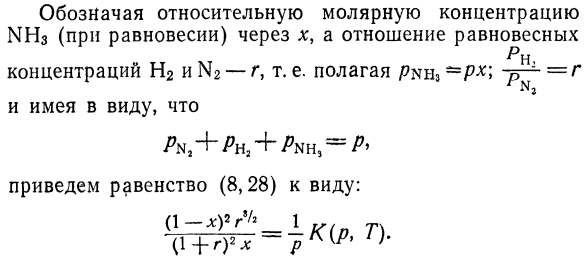


Растворы и смеси. Условия равновесия разбавленных и идеальных растворов.
- Растворы и смеси. Равновесное состояние Разбавленный идеальный раствор Термодинамикой, точным Определение смесей и растворов. Решение Однородная система, твердая, жидкая или газообразная、 Состоит из 2 или более химических веществ Вещество. Для твердых веществ взаимодействуют 2 вещества Растворимые, они образуют общие кристаллы Решетка (или решетка), где узел частично занят атомом Молекула) 1 вещества, частично-другими атомами Другой.
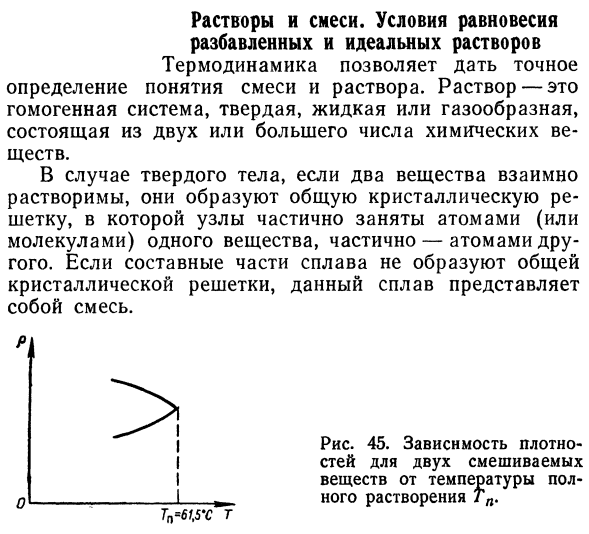
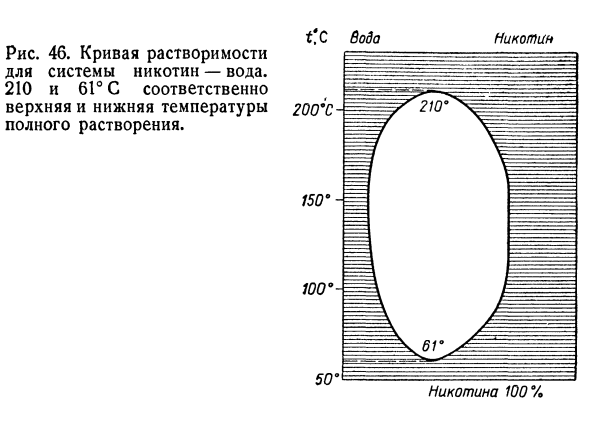
Если компоненты сплава не образуют общего Кристаллическая решетка, этот сплав Смесь. ТН = 6Т, 5 ′ С Т !Девяносто шесть Я думаю, 45.Зависимости жесткие У меня есть 2 смешанных стилей I половина температуры от вещества- 1 растворение ТП. Рисунок 46.это вода. 210 и 61°C соответственно Верхние и более низкие температуры Он полностью растворяется. Вода Никотин 200х Никотин 100% Аналогичная ситуация и с жидкостями.
Кривая растворимости Никотиновая система Людмила Фирмаль
Истинная раса* Существо представляет собой однородную систему, которая характеризует Характеризуется равномерным распределением молекул, их состав Составные части для всего тома. Для газа, нет никакой разницы между решением и Почти все газы растворяются полностью, поэтому смесь Или смешать в любом соотношении. Примечание 1 Но недавно обнаруженные ограничения Растворимость аммиака и водорода, аммиака и метана、
Тысячи атмосфер серы и азота Атмосфера Существует разница между твердыми и жидкими веществами* Потому что растворимость полная и частичная、* Полная нерастворимость. О многих веществах、 Выше-критическая температура смешивания Наблюдается полное взаимное растворение、 А именно, единообразие системы. Например, смесь метила Гексан и спирт при комнатной температуре Граница между метиловым спиртом и Гексой
- Гексан, то есть их смешивание неполное. При температуре 61,5°C Интерфейс исчезает и полностью растворяется (Рисунок 45). Температура, при которой происходит полное растворение* Reium называют критической температурой- Температура смешивания. 14 В. Ф. Ноздрев Сто девяносто семь Из опыта, двухфазный В жидкой системе исчезновение 2 фаз является Понизьте температуру.
Минимальная температура Двухфазная система становится однофазной Понижение температуры называется понижением Критическая температура смешивания. Оказ. Такие как В системе кривая растворимости является эллиптической(рис. 46、 Никотин-вода). Самая простая система в группе решений Разбавленный раствор, то есть、
Вы можете видеть, что многие системы имеют как верх, так и низ Критическая температура плавления. Людмила Фирмаль
Количество молей растворителя значительно больше, чем количество Растворенный моль, т. е. — ^ <C [1«, где n- Растворенных молей, а N-число молей Solvent. In в случае разбавления раствора, применимого Закон массы в виде формулы(8.17). В процессе получения раствора происходит взаимодействие Это приводит к появлению молекул различных компонентов Для различных механических и термических симптомов. Именно поэтому иногда выделяется «тепло растворения».
Внутренняя энергия решения не равна сумме внутренней энергии Внутренняя энергия основного вещества расы Вы также можете использовать во многих случаях, объем будет уменьшаться Формирование раствора. Однако, если химическое сходство-это состав Если компонент большой, то эти эффекты невелики Это несущественно. Идеальное решение строго Не количество а внутренняя энергия Различные печали, чтобы получить решение. Идеальный Решение-полезная абстракция
Насколько близки к нему свойства многих реальных веществ Собственность. Утверждает, Согласно определению идеального решения* Дождитесь разбавленного раствора、 Ярмарка для perfection. At в то же время, идеал Идеальный раствор может быть практически не разбавлен. Разбавление, то есть отношение количества растворенных молей Вещество и растворитель в нем могут быть любыми. Как идеальное решение, закон массового действия Он также применяется в форме (8.17).
Задачи и упражнения 1.На основе состояния общего равновесия (8.9) для 1 компонентной системы, получить Уравнение Клапейрона Клаузиуса D, 23). Решение. Запишите состояние равновесия Для однокомпонентных трехфазных систем: /> 1 = * /> 2 = /> s>(8.18) Hl = M <2 =нет. Куда? — (ди Последнее равновесное состояние можно переписать в виде: Диг _di_di Внутренняя энергия фазы системы、 Удельная внутренняя энергия U, СФП, США:
Соотношение (8.19) можно заменить уравнением Удельная энергия фазы: топор = У2 ^ УЗ. (8.20 утра)) Например, подумайте о жидкости Кость твердая(рис. 29, кривая CB).Для некоторых Очевидно, что некоторые M этой кривой верны Равенство (8.20) Их(8.21) Тогда для точки M на той же кривой с координатами (p + dp, T-bdT) выполняется следующее уравнение: Их+ dux = u2 + du2. (8.22) Из равенства (8.21) и (8.22) получаем: Дукс = Гуф(8.23)
Энергия коэффициента 14 * 199、 Функции энтропии и объема системы : Затем перепишите отношение (8.23) в виде: Или Вы легко узнаете это из отношений G, 6) и G, 7). Уравнение (8.24) принимает вид: Г ^ — Т2) ДС =(РХ-Р2) дв (8.25) Как известно: а = — г * Так… Маркировки Мы получаем: — Ля、- Или… Гр Ар Х 1-З-У2-вл• 2.Внутри герметичного контейнера Жидкости и их пары, а также инертные газы. Давай посмотрим.- Парциальное давление пара, а р-общее pressure. By Покажи мне. ДП П2 ′
Где Vi-удельный объем жидкости, а u2-удельный объем жидкости Количество пара. Решение. В случае равновесия системы Термодинамический потенциал жидкостей и паров То есть она должна быть Φ1=Φ%.Тогда T = const co 200. В соответствии с равенством G, 22) при увеличении Соответствует общему давлению жидкости Р Повышение парциального давления пара: = vldp и D02 в- Если система продолжает оставаться в равновесии、 Ф{+иФх = Ф2 + D < T> 2 или d0x = tfф2、 Это даст вам желаемый результат непосредственно.
3.Гиббса правило фаз Предположение, что каждый компонент включен во все Фаза. Как меняется правило фазы, если не все Входит ли компонент во все фазы? 4. используйте ter для получения правила фазы Динамический потенциал Гиббса. 5. Через 2 условия равновесия 1 компонент фазы системы, показывающий ее темп Диапазон кипения жидкости зависит от давления. 6.Определите температурную зависимость
Зависимость давления насыщенного пара от твердых веществ Тело. Показания пар следует считать идеальным* Газ, твердое тело, газ — как объект для владения Постоянная теплоемкость. * Используя формулу термодинамики Вместимость: для пара Фх = n ^ r +inininр-nicplt в KT-n № r И для твердого тела φ2nf2 = N2E0i2-N2c2T в кт + N2c2T в、 80-это энергия, выделяемая на 1 молекулу、 Ni-число молекул пара, N2-число молекул Твердый,&? —
Непрерывная интеграция; h-постоянная Планка, co — » среднее геометрическое» Частота колебаний твердого тела в геометрических » осцилляторах Твердое тело. Потому что давление относительно небольшое、 Насыщенный пар, pV можно проигнорировать И мы предполагаем, что Φ равно Повторить п я = const и т к э т Двести один 7. Определить равновесное состояние 2 Фазовые системы различных веществ. Решение. Система находится под следствием. Шахта, например, представляет собой водно-керосиновую систему. Энтрос.
Энтропия такой системы Внутренними параметрами системы являются НВ N2i ВВ В2%УФ-U2t Соответствовать требованиям: ПХ = const и; Н2 = const и; Ui + N2 ^ 2-U = const; NXVX + N2V2 = V = const Итак, из 6 независимых параметров Например, 1/4 и 1 / b Найти равновесное состояние из равенства dS = 0 Дополнительные условия dN \ — dN2 = Q: NldUl — \ — Ndi2 = 0; Или Т. ^ я в 2 секунды; •= у、 Откуда А = 7Й> А = А- С химическим потенциалом условия не даются
В этом случае он не перекрывается для разных веществ Обмен частицами невозможен. 8.Отображение действительных законов Масса, представленная парциальным давлением, равна Смотреть: Пра ^ КП(П, Т). Рассмотрим случай знака идеального газа 9.Постоянная зависимость Равновесие давления определяется следующим уравнением: [д \ ПКЛ 2В ’ \ ДП)т-п Решение. Из Формулы (8.17)
При повышении давления при постоянной температуре Константа химического равновесия может быть зависимой Ev * увеличиваются, уменьшаются или остаются от знака суммы Это не меняется. если общее количество МО уменьшается и реакция продолжается* Рэй.: 2H2-fо2± ± 2Н2О, то 2v; <0 ″ То есть, когда давление увеличивается、 Конечный материальный продукт (BH2O) реакции* Плавиться.
Если общее число увеличивается, реакция исчезает Диссоциация молей, например аммиака: И затем… То есть повышение давления приводит к снижению Количество образующегося продукта реакции. Если 2vi = * 0(например, 2HJ; (д \ НКС \ = 0 То есть, константа равновесия не зависит от давления. Равенство логарифма (8.17) приобретает следующий вид: \ Т-0 в /? Т-Конст.: ддлнк \ ?; \ др) т р П 10.
Показать зависимость константы определено температурное равновесие при p-const Уравнение: А / К (8.26) Двести три Решение. Из Формулы (8.17) (д \ НКЛ <б, б + Щ д0 я (%Вт, ви \ [- ДФ-)п—РТР ^ Т — = = ТРР-т-т \ — б ^ ZlVi) ’ Или после правильного преобразования、 Qp-q + q ^будет: Где Qp-тепловой эффект реакции при постоянном давлении Давление. Уравнение (8.26) называется изобарным уравнением Реакция. Изменение температуры при постоянном давлении По формуле(8.26)、
Химическое равновесие постоянное и большее Более тепловое воздействие реакции. Если Qp <0, то есть реакция равна Поглощение тепла (эндотермическая реакция), а затем Константа равновесия уменьшается с повышением температуры* Латора. Наоборот, в случае экзотермической реакции、 Qp> 0, то Γ=φc)> 0, и константа равновесия возрастает При температуре. 11.Указывает, что зависимость является постоянной V = постоянная температурного равновесия в константе const*
Задается уравнением: (д \ ПК \ гв ) Уравнение (8.27) называется уравнением равенства Реакция: 12.In реакция образования водных газов Н2О + СО 5±СО2 + Н2 Г= 1259°, равновесие наступает、 Двести четыре Известная молекулярно-равновесная композиция: О2 = 0J мол, МСО = 9.46 мол, Mn2o = 9.46 моль、 Ми2 = 80.38 моль. Определить константу равновесия Kc Повторите Ks ^ 0.628、 13.
Температура Г; = 717 reaction реакция Образование йодистого водорода H2 + J2 ^±2HJ. Достиг равновесия. Начальное число молей йода mj2 успешно = 2.94 Начальное число молей водорода составляет Мс2 = 8.1 моль, определяется Определите количество молей HJ в равновесном состоянии. Константа есть Равновесие реакции/ Cc = 50.4 Г= 717 К. 14.
Процент (в зависимости от количества родинок) Необходимо смешать азот и водород для получения Любая заданная температура T и давление p Самый высокий (равновесный) относительный выход аммиака? Газ считается идеальным. Solution. By ввод парциального давления Давление, мы пишем закон действующей массы для реакции 2 + 2 = 2NH3, или^
В форме: = *(/>, Т). (8.28)) Указывает относительную молярную концентрацию От NH3 (равновесное состояние) до x, и равновесное отношение н Концентрация H2 и N2-r, то есть/?nh3-Pr> — P-1 — = R настройка И имейте это в виду. Приводит равенство (8.28) к форме.
Двести пять Для фиксированных р и 7 это соотношение определяется Определите функцию x ®.Из состояния экстремума этой функции Функция для вывода;; max получается при r = * 3.Потому что Газ также реагирует в соотношении 1: 3, поэтому очевидно Что вы должны выбрать то же соотношение, что и оригинал Смесь.
Смотрите также:
Решение задач по термодинамике
| Внутренняя энергия и энтропия смеси идеальных газов. | Фазовые переходы первого и второго рода |
| Закон действующих масс. | Фазовые переходы второго рода. Уравнение Эренфеста. |

