Оглавление:
Расчет кривых титрования в методе комплексонометрии
Комплексонометрическое титрование основано на способности ионов металлов образовывать устойчивые комплексные соединения с органическими полидентатными лигандами анионами аминополикарбоновых кислот, из которых чаще всего используется комплексон III (трилон Б, ЭДТА). Так называют двунатриевую соль этилендиамиитетрауксусной кислоты 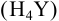 , кристаллогидрат которой
, кристаллогидрат которой 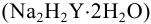 хорошо растворим в воде. В реакциях ЭДТА проявляет себя как шестидентатный лиганд и образует бесцветные октаэдрические комплексы состава
хорошо растворим в воде. В реакциях ЭДТА проявляет себя как шестидентатный лиганд и образует бесцветные октаэдрические комплексы состава 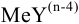 , т. е. реагирует с ионами металлов в молярном отношении 1:1.
, т. е. реагирует с ионами металлов в молярном отношении 1:1.
В комплексонометрии применяют металлохромные индикаторы — красители, способные образовывать окрашенные внутри-комлексные соединения с ионами металлов: кислотный хром темно-синий, хромоген черный специальный ЕТ-00 (эриохромовый черный Т), мурексид и др. В условиях титрования комплекс 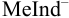 должен иметь окраску, резко отличающуюся от окраски свободного индикатора, и прочность его должна быть значительно меньше прочности комплекса
должен иметь окраску, резко отличающуюся от окраски свободного индикатора, и прочность его должна быть значительно меньше прочности комплекса 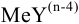 .
.
В частности, эриохромовый черный Т имеет синюю окраску при pH 7-10. С катионами металлов образует комплексы красного цвета, поэтому в ТЭ, вследствие перехода ионов металла из комплекса с индикатором в комплекс с ЭДТА, появляется синяя окраска свободного индикатора. В растворах ЭДТА устанавливается равновесие между различными протонированными формами и депротонированным анионом  :
:
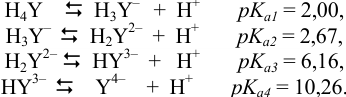
При pH 0 — 1,5 существуют незаряженные молекулы 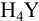 . Полностью депротонированный анион
. Полностью депротонированный анион 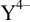 образуется при
образуется при 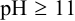 , а при pH 8-9 преобладает
, а при pH 8-9 преобладает 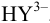 В связи с этим, комплексонометрическое титрование проводят в присутствии буферов. Большая группа ионов
В связи с этим, комплексонометрическое титрование проводят в присутствии буферов. Большая группа ионов 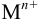 титруется в среде аммиачного буферного раствора с эриохромовым черным Т. Поэтому для ряда катионов возможны побочные реакции комплексообразования: с
титруется в среде аммиачного буферного раствора с эриохромовым черным Т. Поэтому для ряда катионов возможны побочные реакции комплексообразования: с  , с
, с 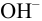 и др. Их следует учитывать при выборе условий титрования и при вычислении условной (см. разделы 2, 3, 4) константы реакции титрования
и др. Их следует учитывать при выборе условий титрования и при вычислении условной (см. разделы 2, 3, 4) константы реакции титрования 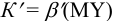 .
.
Реакцию образования комплексоната металла (титрования) можно представить в упрощенном виде (упуская заряды):
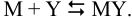
При протекании побочных реакций М и У их равновесные концентрации выражают через аналитические и молярную долю частицы (формулы (2.4), (2.5), (2.8)).
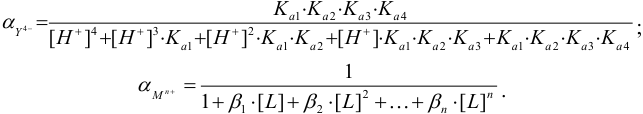
Значения 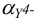 при разных значениях pH приведены в табл.7, значения
при разных значениях pH приведены в табл.7, значения 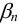 — в табл. 4 приложения. Условная константа равновесия реакции титрования вычисляется по формуле (в случае
— в табл. 4 приложения. Условная константа равновесия реакции титрования вычисляется по формуле (в случае 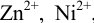 ,
, 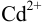 и др.):
и др.):
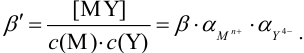
Если ион 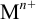 не вступает в побочные взаимодействия (
не вступает в побочные взаимодействия (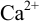 ,
, 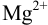 ),
), 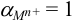 и формула (8.16) преобразуется в (8.17):
и формула (8.16) преобразуется в (8.17):
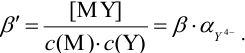
Кривая титрования в комплексонометрии строится в координатах 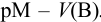 . Для вычисления
. Для вычисления 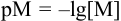 ионов, участвующих в побочных реакциях, используют соотношение:
ионов, участвующих в побочных реакциях, используют соотношение:
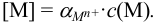
Пример 8.27.
Рассмотрим построение кривых титрования в среде аммиачного буфера 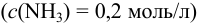 с учетом разбавления раствора:
с учетом разбавления раствора:
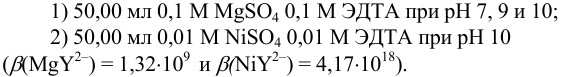
Поскольку М и Y реагируют в соотношении 1:1, в обоих случаях справедливо: 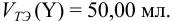
Ион 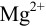 не образует комплексов с
не образует комплексов с 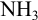 , поэтому
, поэтому 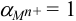 . Для иона
. Для иона 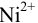 необходимо вычислить
необходимо вычислить 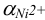 по формуле (2.8), используя табличные значения
по формуле (2.8), используя табличные значения 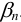 . Можно считать, что
. Можно считать, что 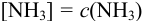 вследствие большого избытка по отношению к
вследствие большого избытка по отношению к 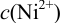 .
.
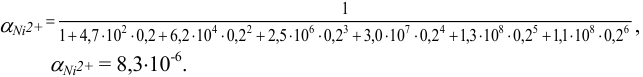
Используя табличные значения  , вычисляем для всех случаев
, вычисляем для всех случаев 
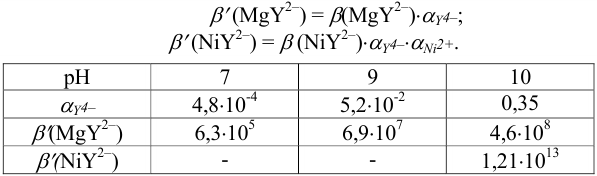
Далее определяем 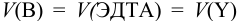 для точек кривых титрования и проводим расчеты рМ. При вычислениях руководствуемся теми же правилами, как и для других типов реакций:
для точек кривых титрования и проводим расчеты рМ. При вычислениях руководствуемся теми же правилами, как и для других типов реакций:
- с(М) до ТЭ определяется оставшейся неоттитровапиой частью;
- в ТЭ общая концентрация всех форм М (кроме MY) равна общей концентрации протонированных форм Y и вычисляется через условную константу
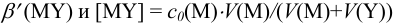 ;
; - после ТЭ расчет с(М) проводится через
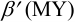 и избыток титранта.
и избыток титранта.
Необходимые формулы и результаты расчетов приведены в табл. 8.11, кривые титрования — на рис. 8.5.
Таблица 8.11
Данные для расчета и построения кривых титрования растворов  и
и 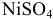 раствором ЭДТА в условиях примера 8.27
раствором ЭДТА в условиях примера 8.27
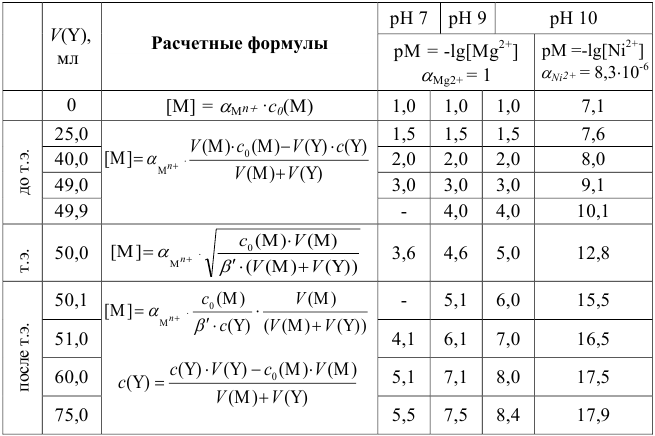
Анализ кривых титрования (рис. 8.5) и расчетных формул показывает, что:
- рМ не зависит от pH раствора до ТЭ, но зависит в ТЭ и после ТЭ;
- величина скачка титрования и положение ТЭ зависит от величины pH — чем больше pH, тем больше скачок титрования;
- на величину скачка титрования влияют концентрация ионов металла и все факторы, определяющие ионное равновесие и константу устойчивости комплексоната; чем больше
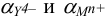 , тем больше скачок.
, тем больше скачок.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

