Оглавление:
Расчет кривых окислительно-восстановительного титрования
Классификация методов окислительно-восстановительного титрования (редоксиметрии) приведена в табл. 8.3. Методы редок-симетрии основаны на изменении потенциала окислительно-восстановительной системы в ходе титрования вследствие изменения концентрации окисленной и восстановленной форм реагирующих веществ. Полнота протекания реакции зависит от разности стандартных (или формальных) потенциалов окислительно-восстановительных пар. Для реакции в общем виде:
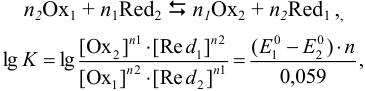
где 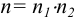 — количество электронов, участвующих в реакции.
— количество электронов, участвующих в реакции.
Например, при 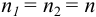 необходима К не менее
необходима К не менее 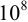 (для превращения исходных веществ в продукты реакции на 99,99 %), a
(для превращения исходных веществ в продукты реакции на 99,99 %), a 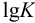 не менее 8. Следовательно:
не менее 8. Следовательно:

Тогда при 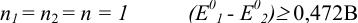 ;
;
при 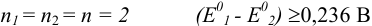 и т. д.
и т. д.
Величина изменяющегося в ходе титрования равновесного потенциала определяется значениями стандартных потенциалов редокс-пар титранта В и определяемого вещества А, а также концентрациями реагентов. Для построения кривых титрования необходимо записать уравнения полуреакций для титранта и определяемого вещества и найти в справочнике или табл. 5 приложения соответствующие им значения стандартных потенциалов 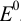 .
.
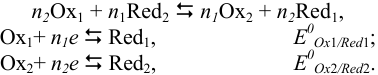
Для построения кривой титрования в координатах 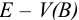 (рис. 8.3) расчет
(рис. 8.3) расчет 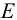 в ходе титрования проводят по уравнению Нернста, связанному с концентрациями компонентов окислительно-восстановительных пар (см. главу 5).
в ходе титрования проводят по уравнению Нернста, связанному с концентрациями компонентов окислительно-восстановительных пар (см. главу 5).
В случаях, когда в полуреакциях участвуют ионы 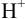 или
или 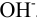 , определяющие среду раствора,
, определяющие среду раствора,  зависят от
зависят от 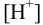 (сравните табл. 8.8 и табл. 8.9). При расчетах допускается, что pH практически не меняется в ходе титрования. При этом до ТЭ удобно пользоваться полуреакциями с участием титруемого вещества А, после ТЭ — с участием титранта В.
(сравните табл. 8.8 и табл. 8.9). При расчетах допускается, что pH практически не меняется в ходе титрования. При этом до ТЭ удобно пользоваться полуреакциями с участием титруемого вещества А, после ТЭ — с участием титранта В.
Если титруемое вещество (с индексом /) — восстановитель, то до ТЭ:
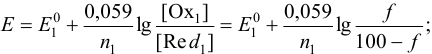
после ТЭ: 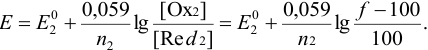
Если титруемое вещество окислитель, то до ТЭ:
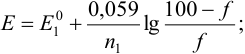 после ТЭ:
после ТЭ: 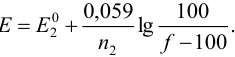
В области ТЭ устанавливается смешанный потенциал, который для простых редокс- реакций можно представить в виде:
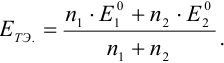
Для расчета 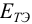 в общем случае используют формальный прием сложения двух полуреакций с уравненным числом электронов (путем умножения на
в общем случае используют формальный прием сложения двух полуреакций с уравненным числом электронов (путем умножения на 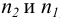 ) и решения полученного уравнения относительно
) и решения полученного уравнения относительно 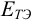 (пример 8.25).
(пример 8.25).
Пример 8.25.
Рассмотрим построение кривых титрования 100 мл 0,1 н. раствора соли 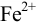 : 1) 0,1н. раствором соли
: 1) 0,1н. раствором соли 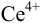 ;
;
2) 1н. раствором 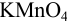 , т. е. раствором с
, т. е. раствором с 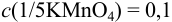 моль/л в среде 1 н.
моль/л в среде 1 н. 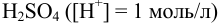 .
.
Расчет проведем в интервале ±10 % от 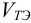 (100 мл). Начальную точку при
(100 мл). Начальную точку при 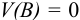 в редоксиметрии не рассчитывают, а также пренебрегают влиянием ионной силы раствора.
в редоксиметрии не рассчитывают, а также пренебрегают влиянием ионной силы раствора.
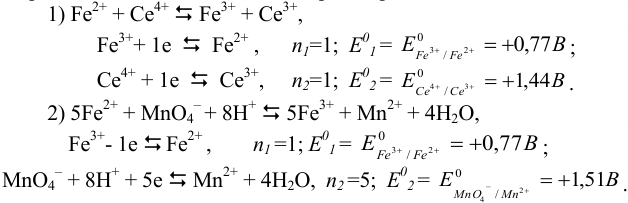
Выведем выражение для 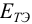 во втором, более общем случае.
во втором, более общем случае.
Уравнения Нернста для полуреакций окисления 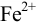 перманганатом калия представим в виде (выражения умножены на соответствующие количества электронов в полуреакциях):
перманганатом калия представим в виде (выражения умножены на соответствующие количества электронов в полуреакциях):
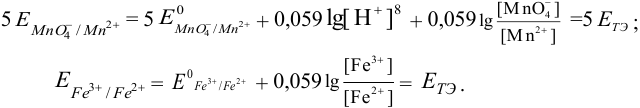
При их сложении получаем:
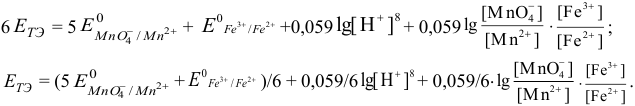
В соответствии с уравнением реакции титрования (2) можно представить соотношение равновесных концентраций в ТЭ:

После подстановки и сокращений получаем выражение для 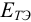 :
:
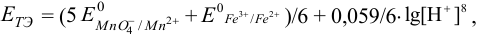
т.е. 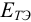 в данной системе зависит от pH.
в данной системе зависит от pH.
Кривые титрования показаны на рис. 8.3, результаты расчетов для реакций (1) и (2) представлены в виде таблиц 8.8 и 8.9.
Если титрование 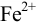 раствором
раствором 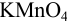 в кислой среде проводить в присутствии
в кислой среде проводить в присутствии 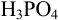 , то продукт реакции — ионы
, то продукт реакции — ионы 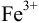 — будут связываться в комплекс
— будут связываться в комплекс 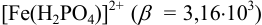 . Легко показать, что при
. Легко показать, что при 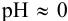 , создаваемом 1 н.
, создаваемом 1 н. 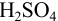 , в присутствии 1 М
, в присутствии 1 М 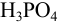 равновесная концентрация дигидрофосфат- ионов,
равновесная концентрация дигидрофосфат- ионов, 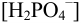 равна
равна 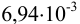 моль/л.
моль/л.
Значения Е на этом участке (до ТЭ) и в ТЭ можно вычислить, заменяя в формулах табл. 8.9 значение 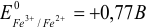 на
на 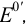 которое можно получить с использованием формулы (5.7).
которое можно получить с использованием формулы (5.7).
Таблица 8.8
Данные для расчета и построения кривой титрования 0,10 н. раствора соли 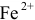 0,10 н. раствором соли
0,10 н. раствором соли 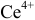
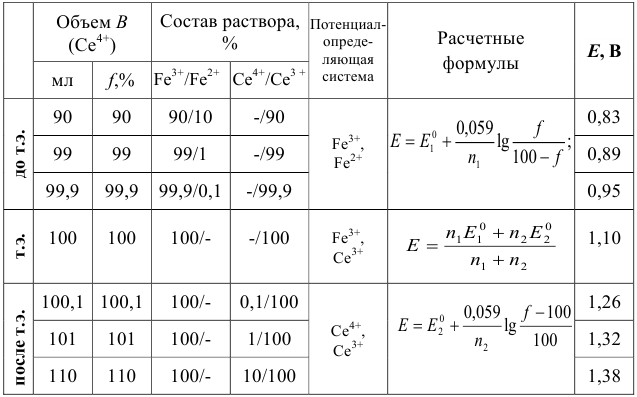
Таблица 8.9
Данные для расчета и построения кривой титрования 0,10 н. раствора соли  0,10 н. раствором
0,10 н. раствором  при pH = 0
при pH = 0
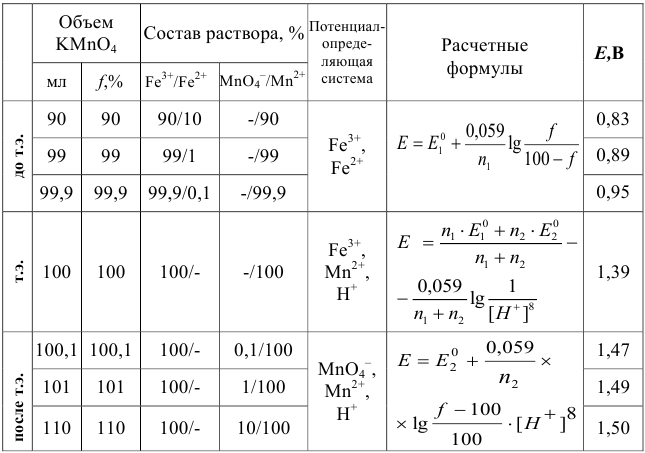
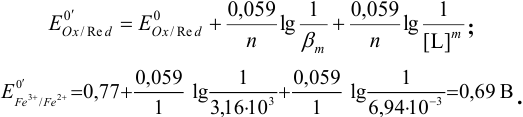
При этом получаются следующие значения равновесного потенциала Е при соответствующих объемах титранта:

Сравнение этих данных с приведенными в табл. 8.9, а также сопоставление хода кривых (3) и (2) рис. 8.3, показывает увеличение скачка титрования на кривой (3). Это происходит вследствие уменьшения 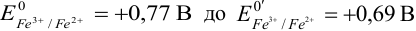 за счет связывания в комплекс окисленной формы (
за счет связывания в комплекс окисленной формы ( ).
).
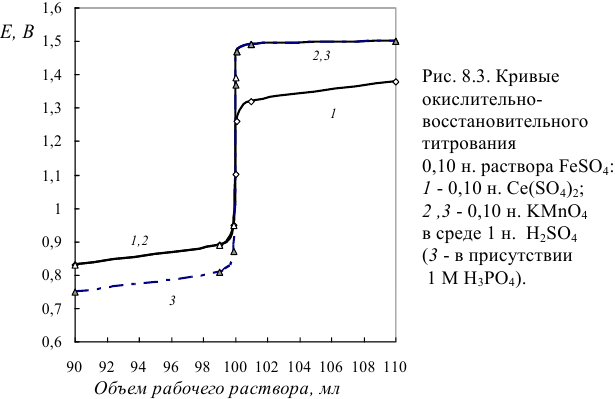
Таким образом, анализ кривых редокс- титрования показывает, что:
- при
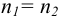 кривая симметрична относительно ТЭ (кривая 1);
кривая симметрична относительно ТЭ (кривая 1); - при
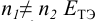 смещен к ветви кривой, соответствующей паре с большим
смещен к ветви кривой, соответствующей паре с большим 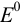 (например, кривые 2, 3);
(например, кривые 2, 3); - скачок титрования возрастает с увеличением
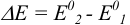 или
или 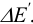 , т. е. зависит от факторов, влияющих на редокс- потенциал (с ростом pH для реакции (2) величина скачка уменьшается; при связывании в комплекс ионов
, т. е. зависит от факторов, влияющих на редокс- потенциал (с ростом pH для реакции (2) величина скачка уменьшается; при связывании в комплекс ионов 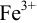 величина скачка увеличивается вследствие понижения Е до ТЭ).
величина скачка увеличивается вследствие понижения Е до ТЭ).
Для окислительно-восстановительного титрования используются индикаторы разных типов. При выборе окислительно-восстановительных индикаторов (табл. 8.14) необходимым условием является попадание 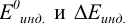 — интервала изменения его окраски в границы скачка титрования.
— интервала изменения его окраски в границы скачка титрования.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

