Оглавление:
Расчет кривых кислотно-основного титрования
Метод кислотно-основного титрования основан на реакции нейтрализации. Он позволяет определять содержание кислот или оснований в растворе, причем роль таких кислот и оснований могут играть гидролизующиеся соли и амфолиты (см. табл. 3.1, 8.4). Основными рабочими растворами в методе нейтрализации являются растворы сильных кислот (соляной, серной и др.) и щелочей. При визуальном титровании применяют различные кислотно-основные индикаторы, примеры которых приведены в табл. 8.12. В инструментальных методах точку эквивалентности определяют по кривой титрования, полученной экспериментально с помощью индикаторного электрода, потенциал которого является функцией pH.
Пример 8.21.
Рассмотрим построение кривых титрования 0,20 М рабочим раствором 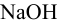 50 мл 0,10 М растворов кислот: сильной —
50 мл 0,10 М растворов кислот: сильной — 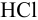 , слабой —
, слабой — 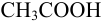 и слабой катионокислоты — катиона солянокислого анилина
и слабой катионокислоты — катиона солянокислого анилина 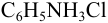 . Для этих протолитов
. Для этих протолитов 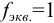 .
.
Согласно формулам (8.14) и (8.15), в этих случаях 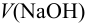 в ТЭ составляет:
в ТЭ составляет:
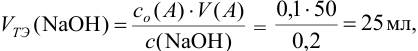
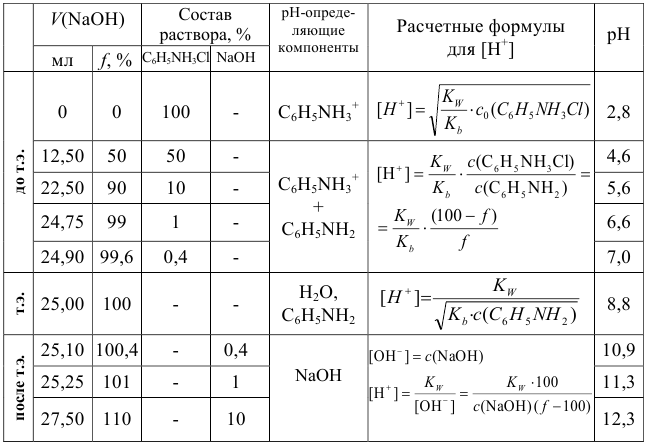
что соответствует 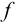 =100%. Промежуточные значения и другие расчетные данные для построения кривых титрования представлены в табл. 8.4 — 8.6.
=100%. Промежуточные значения и другие расчетные данные для построения кривых титрования представлены в табл. 8.4 — 8.6.
Для качественной и количественной оценки состава раствора в ходе титрования следует вспомнить расчеты протолитических равновесий, приведенные в разделах глав 2 и 3. Справочные значения 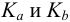 приведены в табл. 2 и 3 приложения.
приведены в табл. 2 и 3 приложения.
При титровании протекают следующие протолитические реакции:
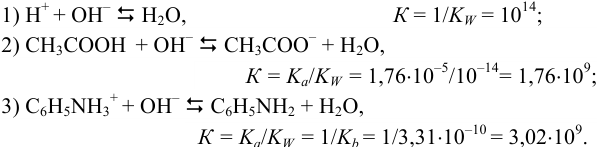
Из рассмотрения химических равновесий реакций титрования следует:
- в случае 1) в ТЭ среда нейтральная (pH = 7);
- в случаях 2) и 3) в ТЭ среда щелочная (pH > 7); причина этого — присутствие в растворе в ТЭ слабых оснований
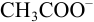 (2) и
(2) и 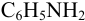 (3);
(3);
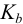 , для
, для 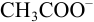 (
(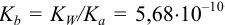 ) близка к
) близка к 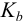 для
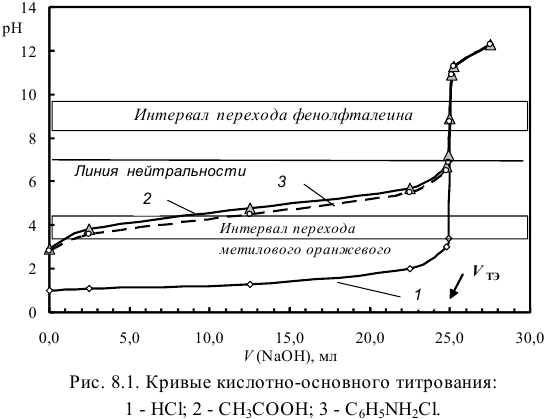
для 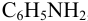 , поэтому ход кривых для случаев 2) и 3) тождественен (рис. 8.1).
, поэтому ход кривых для случаев 2) и 3) тождественен (рис. 8.1).
Как видно из рис. 8.1, при титровании сильной кислоты кривая (1) симметрична относительно линии нейтральности. Благодаря большей величине скачка для кривой 1 можно использовать достаточно широкий круг индикаторов. Для кривых 2 и 3, например метиловый оранжевый непригоден.
Таким образом, величина скачка на кривой кислотноосновного титрования зависит от природы (силы) титруемых протолитов. С уменьшением 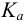 возрастает pH раствора в ТЭ. Если величина скачка становится меньше интервала перехода индикатора
возрастает pH раствора в ТЭ. Если величина скачка становится меньше интервала перехода индикатора 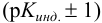 , то визуальное титрование становится невозможным.
, то визуальное титрование становится невозможным.
При построении кривых титрования оснований кислотой используют ту же схему подхода к расчетам, рассматривая изменение состава раствора при титровании и подбирая формулы для расчета 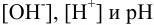 .
.
Таблица 8.4
Данные для расчета и построения кривой титрования 0,10 М раствора 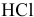 0,20 М раствором
0,20 М раствором 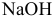
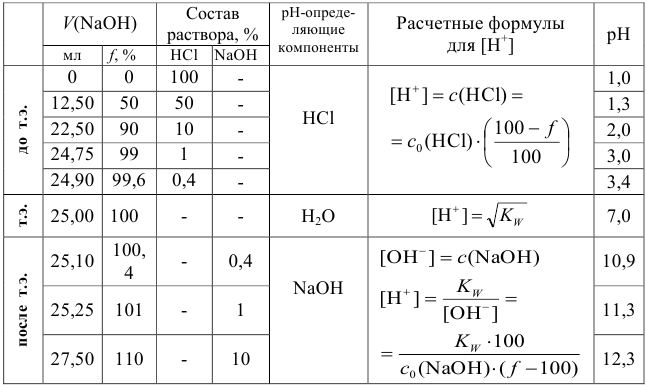
Таблица 8.5
Данные для расчета и построения кривой титрования 0,10 М раствора слабой кислоты 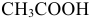 0,20 М раствором
0,20 М раствором 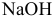
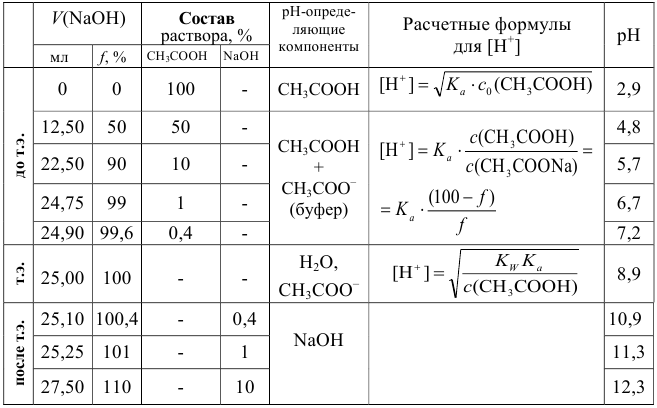
Таблица 8.6
Данные для расчета и построения кривой титрования 0,10 М раствора 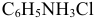 0,20 М раствором
0,20 М раствором 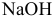
Для определения очень слабых кислот и оснований 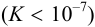 в титриметрии используется ряд приемов, описанных в рекомендованной учебной литературе: обратное титрование, прием замещения, усиление кислотных свойств за счет комплексообразования или перехода к неводным и смешанным растворителям, определение ТЭ инструментальными методами и др. В случае многоосновных кислот (оснований), смесей кислот (оснований) возможно их раздельное ступенчатое титрование (примеры 8.22, 8.23) с выраженными скачками титрования, если константы кислотности (основности) или константы соответствующих реакций титрования отличаются не менее, чем в
в титриметрии используется ряд приемов, описанных в рекомендованной учебной литературе: обратное титрование, прием замещения, усиление кислотных свойств за счет комплексообразования или перехода к неводным и смешанным растворителям, определение ТЭ инструментальными методами и др. В случае многоосновных кислот (оснований), смесей кислот (оснований) возможно их раздельное ступенчатое титрование (примеры 8.22, 8.23) с выраженными скачками титрования, если константы кислотности (основности) или константы соответствующих реакций титрования отличаются не менее, чем в 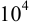 раз.
раз.
Пример 8.22.*
Построить кривую титрования 100 мл 0,10 М раствора 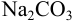 0,10 М рабочим раствором
0,10 М рабочим раствором 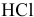 , считая относительную погрешность титрования (погрешность измерения объема) ±1 % и пренебрегая изменением ионной силы раствора. (Следует заметить, что подобная постановка задачи представляет интерес в основном для приобретения навыков расчета более сложных случаев протолитических взаимодействий.)
, считая относительную погрешность титрования (погрешность измерения объема) ±1 % и пренебрегая изменением ионной силы раствора. (Следует заметить, что подобная постановка задачи представляет интерес в основном для приобретения навыков расчета более сложных случаев протолитических взаимодействий.)
Решение:
1. Проведем некоторые предварительные рассуждения и расчеты.
При титровании слабого основания 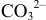 сильной кислотой могут протекать последовательно две реакции с соответствующими константами:
сильной кислотой могут протекать последовательно две реакции с соответствующими константами:
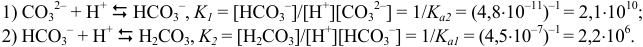
Значения констант равновесия показывают, что реакции 1) и 2) протекают практически количественно, а их отношение 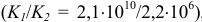 , равное
, равное 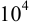 (отличаются на 4 порядка), свидетельствует о возможности ступенчатого титрования
(отличаются на 4 порядка), свидетельствует о возможности ступенчатого титрования 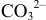 с двумя выраженными скачками.
с двумя выраженными скачками.
Расчет кривой до 1-ой ТЭ соответствует построению кривой титрования слабого одноосновного основания, т. к. при этом титруется один эквивалент слабого двухосновного основания 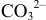 с константой основности
с константой основности 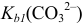 :
:
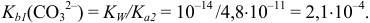
Далее титруется продукт реакции I) — амфолит 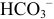 , для которого величина константы основности составляет:
, для которого величина константы основности составляет:
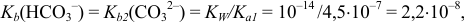
что превышает величину константы кислотности 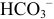 :
:
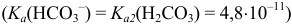
В начальный момент титрования 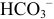 , соответствующий 1-ой ТЭ при титровании
, соответствующий 1-ой ТЭ при титровании 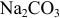 , концентрация
, концентрация 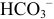 вдвое меньше начальной концентрации
вдвое меньше начальной концентрации 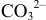 вследствие двукратного увеличения объема:
вследствие двукратного увеличения объема:
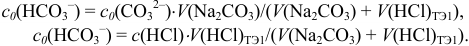
С учетом предварительных рассуждений, формул (8.14), (8.15), а также условий примера 8.21, для построения кривой титрования 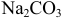 , зададим значения степени оттитрованности
, зададим значения степени оттитрованности 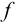 и соответствующих объемов
и соответствующих объемов 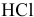 в точках кривой:
в точках кривой: 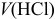 — общий добавленный объем титранта к 100 мл раствора
— общий добавленный объем титранта к 100 мл раствора 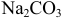 ;
; 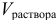 — общий объем титруемого раствора
— общий объем титруемого раствора 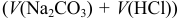 (табл. 8.7). В последнюю строку таблицы внесены результаты проведенных ниже расчетов для построения кривой титрования (в скобках приведены для сравнения значения pH в указанных точках при приближенных расчетах).
(табл. 8.7). В последнюю строку таблицы внесены результаты проведенных ниже расчетов для построения кривой титрования (в скобках приведены для сравнения значения pH в указанных точках при приближенных расчетах).
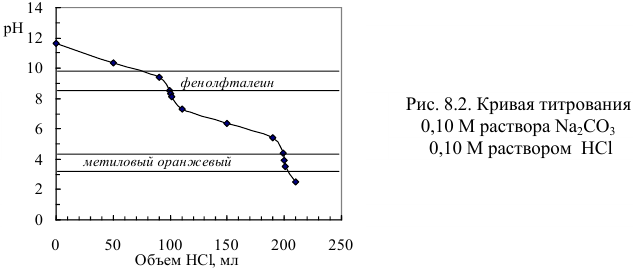
2. Проведем вычисления pH в соответствующих точках, внося результаты в нижнюю строку табл. 8.7 и представляя в виде кривой на рис.8.2.
В первой точке 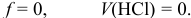
Среда раствора определяется концентрацией слабого анионооснования 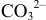 :
:

Соотношение 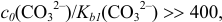 поэтому расчет проводим по приближенной формуле (табл. 3.1), преобразовав ее для расчета pH:
поэтому расчет проводим по приближенной формуле (табл. 3.1), преобразовав ее для расчета pH:
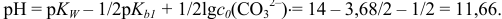
Таблица 8.7
Данные для построения кривой титрования 100 мл 0,10 М 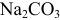 0,10 М рабочим раствором НС1 (с учетом разбавления)
0,10 М рабочим раствором НС1 (с учетом разбавления)
До 1-ой ТЭ титрование проводится по реакции 1). При этом в растворе образуется кислотно-основная сопряженная пара 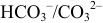 , в достаточно широком пределе концентраций обладающая буферным действием.
, в достаточно широком пределе концентраций обладающая буферным действием.
Расчет pH при 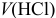 50 и 90 мл можно провести, используя формулу (3.11):
50 и 90 мл можно провести, используя формулу (3.11):
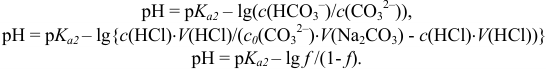
Подставляя в уравнения справочные и подготовленные данные, получаем значения pH для соответствующего участка кривой титрования. Например при 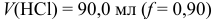 :
:
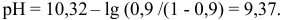
Вблизи ТЭ при 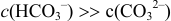 , в частности, при
, в частности, при 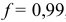 , расчет по приближенной формуле для буферного раствора приводит к значению pH 8,32, в результате чего нарушается ход кривой. В таких точках следует проводить расчеты через равновесные концентрации, которые можно вычислить с учетом совокупности равновесий и соответствующих констант:
, расчет по приближенной формуле для буферного раствора приводит к значению pH 8,32, в результате чего нарушается ход кривой. В таких точках следует проводить расчеты через равновесные концентрации, которые можно вычислить с учетом совокупности равновесий и соответствующих констант:
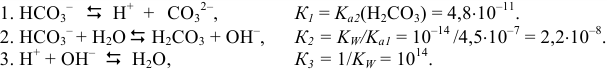
Общая константа 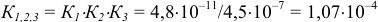 характеризует суммарное уравнение с исходными (с) и равновесными ([ ]) концентрациями
характеризует суммарное уравнение с исходными (с) и равновесными ([ ]) концентрациями
частиц:
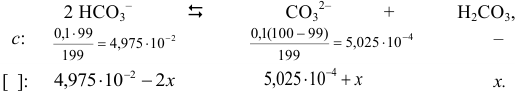
Подставляя значения равновесных концентраций в выражение для 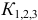 , получаем уравнение:
, получаем уравнение:
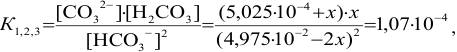
решение которого приводит к значению 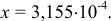 Вычисляем равновесные концентрации компонентов кислотно-основных сопряженных пар и, подставляя в соответствующие уравнения, получаем значение pH:
Вычисляем равновесные концентрации компонентов кислотно-основных сопряженных пар и, подставляя в соответствующие уравнения, получаем значение pH:
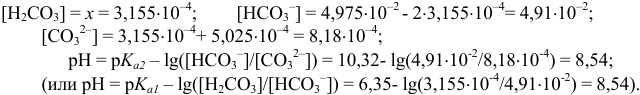
В 1-ой ТЭ 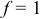 , pH создается амфолитом
, pH создается амфолитом 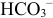 — уравнение (3.8), из которого получаем выражение для pH:
— уравнение (3.8), из которого получаем выражение для pH:
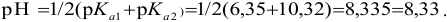
После 1-ой ТЭ и до 2-ой ТЭ по реакции 2) начинается титрование 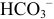 , причем в 1-ой ТЭ
, причем в 1-ой ТЭ 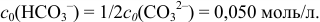
При соизмеримых количествах 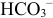 и
и 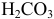 в образующемся буферном растворе, например в интервале
в образующемся буферном растворе, например в интервале 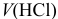 от 110 до 190 мл, расчет pH можно проводить по приближенной формуле для буферного раствора, т. е. через
от 110 до 190 мл, расчет pH можно проводить по приближенной формуле для буферного раствора, т. е. через 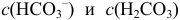 или через степень оттитрованности
или через степень оттитрованности 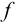 . Например, при
. Например, при 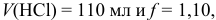 получаем:
получаем:
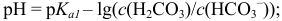
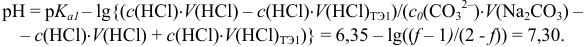
При большом избытке той или иной формы (вблизи ТЭ) расчет pH следует проводить через 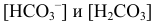 , вычисляя их подобно тому, как это было показано выше. Например, при
, вычисляя их подобно тому, как это было показано выше. Например, при 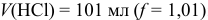 :
:
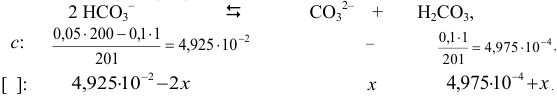
Подставляя значения равновесных концентраций в выражение для 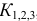 , получаем уравнение, решение которого приводит к значению
, получаем уравнение, решение которого приводит к значению 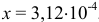 .
.
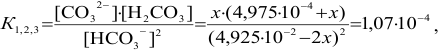
тогда 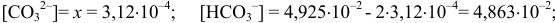
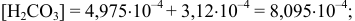
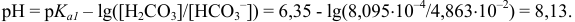
Вблизи 2-ой ТЭ, в начале второго скачка на кривой титрования, в частности при 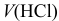 = 199 мл, когда мала
= 199 мл, когда мала 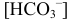 , можно провести расчет
, можно провести расчет 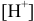 по формуле (3.10), считая
по формуле (3.10), считая 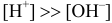 :
:
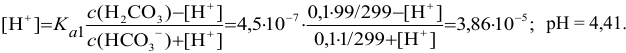
Во 2-ой ТЭ f=2, pH создается слабой двухосновной кислотой 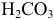 , концентрация которой втрое меньше
, концентрация которой втрое меньше 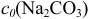 :
:
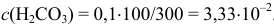
При концентрации 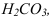 , превышающей растворимость
, превышающей растворимость 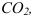 . равную при комнатной температуре
. равную при комнатной температуре 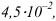 при расчете pH следует использовать величину молярной растворимости
при расчете pH следует использовать величину молярной растворимости 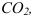
Различие 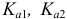 и соотношение
и соотношение 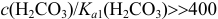 позволяют провести расчет pH по приближенному уравнению (табл. 3.1):
позволяют провести расчет pH по приближенному уравнению (табл. 3.1):
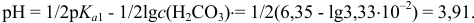
После 2-ой ТЭ pH раствора определяется избыточной концентрацией сильной кислоты, подавляющей диссоциацию слабой угольной кислоты.
Например при 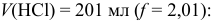
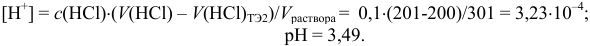
Как видно из рис. 8.2, кривая титрования 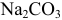 имеет два скачка. Однако первый из них, при протекании реакции 1, имеет меньшую крутизну и величину. Интервал перехода фенолфталеина выходит за границы скачка. Поэтому титрование
имеет два скачка. Однако первый из них, при протекании реакции 1, имеет меньшую крутизну и величину. Интервал перехода фенолфталеина выходит за границы скачка. Поэтому титрование 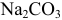 по второму скачку с индикатором метиловым оранжевым по реакции:
по второму скачку с индикатором метиловым оранжевым по реакции: 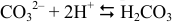 будет иметь более высокую точность.
будет иметь более высокую точность.
Пример 8.23.
Оцените значения pH в точках эквивалентности, границы второго скачка (погрешность определения объема считать ±1,0 %) при титровании смеси кислот: 0,10 М НЮ3 и 0,10 М 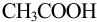 0,10 М раствором NaOH, а также точность определения первого иона водорода при его титровании до точки эквивалентности.
0,10 М раствором NaOH, а также точность определения первого иона водорода при его титровании до точки эквивалентности.
Решение:
В данной смеси присутствуют кислоты разной силы 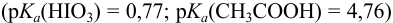 , каждая из которых может быть независимо оттитрована щелочью, и последовательно — из смеси, поскольку константы кислотности отличаются на 4 порядка. Первой реагирует с
, каждая из которых может быть независимо оттитрована щелочью, и последовательно — из смеси, поскольку константы кислотности отличаются на 4 порядка. Первой реагирует с 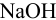 более сильная кислота
более сильная кислота 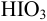 :
:
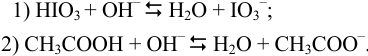
В 1-ой ТЭ pH раствора можно оценить, учитывая проявление свойств анионооснования ионом 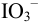 (гидролиз) и диссоциацию
(гидролиз) и диссоциацию 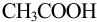 , т.е. провести расчет по приближенной формуле для амфолита, в котором основная и кислотная функции распределены на две частицы.
, т.е. провести расчет по приближенной формуле для амфолита, в котором основная и кислотная функции распределены на две частицы.
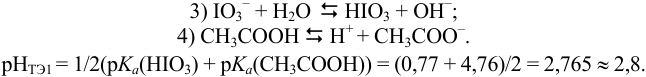
Точность титрования первого иона водорода (от 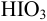 ) можно охарактеризовать, выразив из
) можно охарактеризовать, выразив из 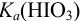 отношение оттитрованной части к неоттитрованной, а затем к общей для данной кислоты:
отношение оттитрованной части к неоттитрованной, а затем к общей для данной кислоты:
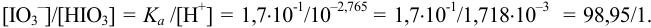
Точность титрования составляет: 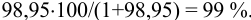
Вторая ТЭ (/”= 2) и границы второго скачка рассчитываются подобно приведенным в примере 8.22 (табл. 8.7), при этом не учитывается вклад гидролиза 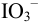 в pH среды и разбавление раствора. Нижняя граница второго скачка титрования соответствует
в pH среды и разбавление раствора. Нижняя граница второго скачка титрования соответствует 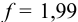 . При этом среду раствора можно оценить по буферной смеси, состоящей на 99 % из сопряженного основания
. При этом среду раствора можно оценить по буферной смеси, состоящей на 99 % из сопряженного основания 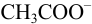 и на 1% — из
и на 1% — из 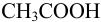 :
:
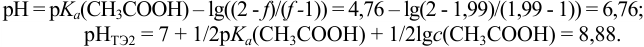
Верхняя граница второго скачка титрования определяется избыточной концентрацией 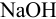 при
при 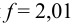 :
:
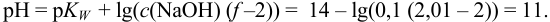
Таким образом, границы второго скачка находятся в пределах pH 6,8 -11.
Пример 8.24*.
Рассмотрите возможность титрования 0,20 М раствора соли аммония 0,20 М растворами: a) 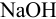 в воде; б) этилата натрия в безводном этаноле, считая константу автопротолиза этанола
в воде; б) этилата натрия в безводном этаноле, считая константу автопротолиза этанола 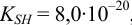 , константу ионизации
, константу ионизации  в этаноле —
в этаноле — 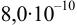 .
.
Рассчитайте долю неоттитрованного 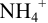 (%) при титровании до точки эквивалентности в случаях а) и б). Какие условия являются более приемлемыми? Вычислите pH в точках эквивалентности для а) и б).
(%) при титровании до точки эквивалентности в случаях а) и б). Какие условия являются более приемлемыми? Вычислите pH в точках эквивалентности для а) и б).
Решение:
Титрование в воде идет по реакции:
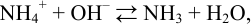
константа равновесия которой:
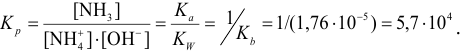
При титровании в этаноле (см. пример 3.7) протекает реакция:
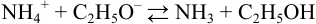
с константой равновесия:
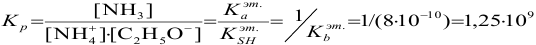
В точке эквивалентности в обоих случаях 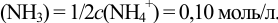
Концентрации титруемой катионокислоты в точках эквивалентности можно вычислить через 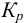 . При титровании в воде согласно уравнениям реакций титрования:
. При титровании в воде согласно уравнениям реакций титрования:
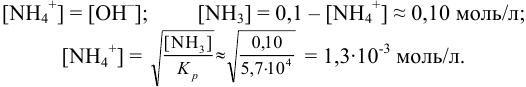
Доля неоттитрованного иона х вычисляется из отношения:
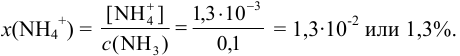
При титровании в этаноле: 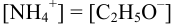 ;
;
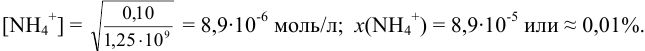
Таким образом, при неводном титровании в этаноле доля неоттитрованного иона 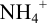 значительно меньше (вследствие меньшей обратимости реакции).
значительно меньше (вследствие меньшей обратимости реакции).
В точках эквивалентности среда определяется константой основности и концентрацией слабого основания. С учетом приведенных выше соотношений проще провести расчеты по формулам: 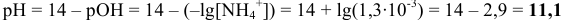 — в воде; в этаноле:
— в воде; в этаноле: 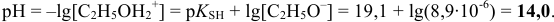
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

