Оглавление:
Расчет константы равновесия по стандартным и формальным потенциалам
Направление реакции, полноту её протекания, а также равновесные концентрации компонентов или растворимость веществ в ходе окислительно-восстановительной реакции, можно оценить по ее константе равновесия (см. разделы 2.3, 5.1), которая в справочниках не приводится, но связана с табличными значениями стандартных потенциалов. Термодинамическую константу (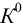 ) можно вычислить по формуле:
) можно вычислить по формуле:
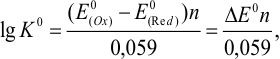
где n — число электронов, передаваемых в ходе реакции окислительно-восстановительного взаимодействия; 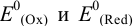 — стандартные потенциалы пар предполагаемого окислителя и восстановителя.
— стандартные потенциалы пар предполагаемого окислителя и восстановителя.
В реальных условиях вместо стандартных потенциалов следует воспользоваться формальными и вычислить условную константу равновесия К.
Пример 5.13.
Вычислить константу равновесия реакции окисления иодом арсенит-иона с учетом кислотности среды в условиях примера 5.7.
Решение:
Воспользуемся данными о 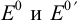 для полуреакций, полученными в примере 5.7.
для полуреакций, полученными в примере 5.7.
Уравнение реакции: 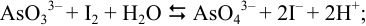
полуреакции и потенциалы пар:
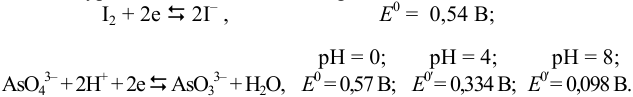
В стандартных условиях (pH = 0) рассчитаем термодинамическую константу равновесия  указанной реакции по формуле (5.11). В качестве окислителя предполагается
указанной реакции по формуле (5.11). В качестве окислителя предполагается  .
.
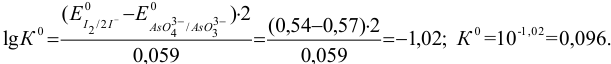
Поскольку 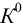 < 1, равновесие реакции смещено влево. Вычислим значения
< 1, равновесие реакции смещено влево. Вычислим значения 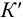 при других значениях pH. При pH = 4:
при других значениях pH. При pH = 4:
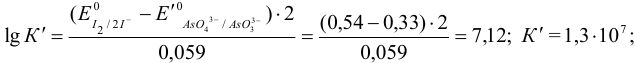
при pH = 8: 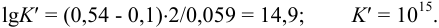
Расчеты показывают, что для практически полного смещения равновесия вправо необходимо создать pH > 4.
Пример 5.14.
Вычислить константу равновесия реакции:

Решение:
Представим полуреакции и соответствующие им 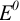 :
:

Предложенную реакцию можно представить как сумму ступенчатых процессов, характеризующихся соответствующими константами:
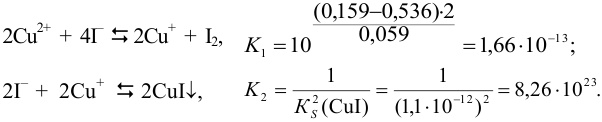
Общая константа равновесия суммарной реакции равна произведению  (см. также раздел 2.3):
(см. также раздел 2.3):
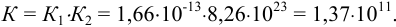
Значение константы показывает, что реакция будет протекать до конца даже при стехиометрическом соотношении реагирующих веществ.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

