Оглавление:



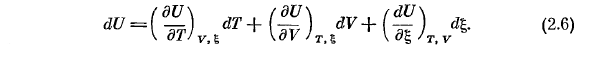

Принцип сохранения энергии. Формулировка принципа сохранения энергии.
Энергетический принцип Формулировка принципа энергосбережения Первый закон термодинамики вводит понятие энергии, утверждая, что изменение энергии системы равно на сумму энергии, которую система получает от внешнего мира в течение рассматриваемого периода.
В частности, энергия изолированной системы постоянна. С этим связано и другое название первого принципа-принцип сохранения энергии. Замкнутая система обмена энергией с окружающей средой iB в виде телеработы или механической работы(гл. I, см.§ 4). 、 Где dQ и dW работают с теплом, которое система получает во время процесса, U-внутренняя энергия системы.
Изменение внутренней энергии при бесконечно малом преобразовании, идущем от I к t-dt, равно: дю = йд + д \ В Людмила Фирмаль
- Тепло, получаемое системой, и работа, выполняемая в системе, считаются положительными, а тепло, выделяемое системой, и работа, производимая системой, считаются отрицательными. С помощью (2.1) вам, естественно, придется измерять тепло, внутреннюю энергию и работать с одним и тем же устройством. Представленная здесь таблица показывает соотношение между наиболее часто используемыми единицами энергии в физическом Chemistry. In в дальнейшем, как единица энергии, небольшие калории (калории) 2 используются во всех местах(таблица 2.1). Эта таблица считывается горизонтально в направлении стрелки.
Следовательно, 1 эрг эквивалентен 1,0197-10 — ®КГМ, или 9.869-10-10 л-АТМ и др. (2.1) Если поверхность Q для закрытия системы будет одинаковой в любом месте внешнего давления P}перпендикулярна Q、 (2.2) DА = PDV Если система не выполняет никаких других внешних работ.
1 в отечественной литературе принято считать работу, производимую системой, позитивной. (Эд.) Из 2 1-1, Советского МГП, была введена система приоритетов единиц СИ, поэтому единица эперги-это Joule. In книга, 4.1840 джоулей термохимических калорий используются в качестве единиц измерения energy.
In таблица всех имеющихся в настоящее время термодинамических величин(энергия, энтропия, термодинамический потенциал, удельная теплоемкость и др.), , потому что они используются в качестве единиц энергии. (Эд.)
Мы обнаружили, что калории не могут быть преобразованы в джоули Людмила Фирмаль
Таблица 2.1 * Hm L-PTP от vrg. Н Кэл АБС. j 1 эрг 1 КГМ 1 л-А / ПМ 1 кал 1 АБС. J 1 9,807•107 1,0133-10 * 4,1840-U7 107 1,0197-10- * 1 10,332 0,426197 0,10197 9,869-10 «10 9,678-10» * 1 4,129-U-2 9,869-юго-запад 2,390-10-8 2,343 24,218 1 0,2390 10 «7 9,807 101,33 4,1840 1 *
Для основных физических констант см. R. T. см. Birge, Phys. Соц. Заряд прогрессии физика 8, 90 (1941). в соответствии с рекомендациями; Международная федерация физиков (S. G. 48-6 19948), калории определяются как 4,1840 АБС. j данная таблица составлена в соответствии с последними рекомендациями бюро стандартов США; см. таблицу выбранных значений химических термодинамических свойств (Вашингтон, 1947). В этой книге мы будем использовать первые законы термодинамики в простейшей форме / ду = — йд-ПДВ.(2.3)
Поверхностные явления, не отраженные в Формуле (2.3), воздействие внешних силовых полей и другие эффекты здесь не рассматриваются1. Поскольку внутренняя энергия является функцией состояний, она может быть выражена независимой переменной, характеризующей состояние системы. Например, в момент времени t состояние системы не зависит от временной переменной 7 \ V,…,
Если определяется Gss, то внутренняя энергетическая переменная равна У = У(Г, В, РП…, ПС.) (2.4) В замкнутой системе, согласно (1.41)、 у = у(Т, в, ФК НЛ…, Н°С)= У(Т, в,&), (2.5) О, да. это связано с тем, что n, -, ps можно считать предопределенным параметром. (2.5) полный дифференциал внутренней энергии согласно、
Смотрите также:
Решение задач по термодинамике
| Многофазные системы. | Экстенсивные и интенсивные переменные. |
| Термодинамические переменные. Вводные определения. | Превращения в закрытой системе. |

