Оглавление:
Расчеты при приготовлении рабочих растворов и установлении их концентрации
Пример 8.9.
Сколько граммов дихромата калия необходимо взять для приготовления 500 мл раствора 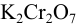 с титром, равным 0,005882 г/мл? Определите молярную концентрацию и молярную концентрацию эквивалента
с титром, равным 0,005882 г/мл? Определите молярную концентрацию и молярную концентрацию эквивалента 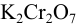 в полученном растворе, если
в полученном растворе, если 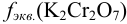 = 1/6.
= 1/6.
Решение:
Из формулы (8.6):
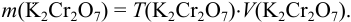
В данном случае 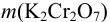 = 0,005882 500 = 2,941 г.
= 0,005882 500 = 2,941 г.
По формулам 8.9 и 8.8 находим соответствующие молярные концентрации дихромата. 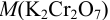 = 294,1 г/моль.
= 294,1 г/моль.

Пример 8.10.
Сколько нужно добавить воды к 100 мл 0,8000 и. раствора 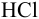 , чтобы получить 0,2000 и. раствор?
, чтобы получить 0,2000 и. раствор?
Решение:
Исходя из выражения закона эквивалентов (8.1) и учитывая, что количество кислоты при разбавлении сохраняется, справедливо: 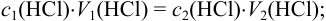
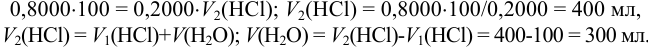
Пример 8.11.
Приготовлен 0,02500 и. рабочий раствор 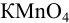 для перманганатометрии. Определить его молярную концентрацию, титр и титр по железу.
для перманганатометрии. Определить его молярную концентрацию, титр и титр по железу.
Решение:
В соответствии с примером 8.6:
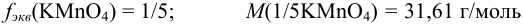
Тогда, пользуясь формулами (8.5), (8.8), (8.9) и (8.12) находим:
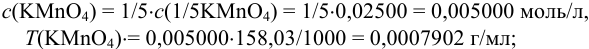
или, через молярную концентрацию эквивалента:

Пример 8.12.
Во сколько раз следует разбавить 20,24 % — ый раствор 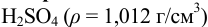 для приготовления 0,1 и. раствора?
для приготовления 0,1 и. раствора?
Решение:
Вычислим 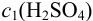 — молярную концентрацию исходного раствора кислоты:
— молярную концентрацию исходного раствора кислоты:
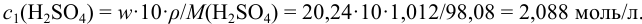
По условию необходимо приготовить раствор с 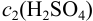 . Её определяем по формуле 8.5:
. Её определяем по формуле 8.5:
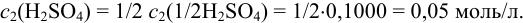
Тогда: 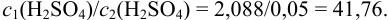
Такая кратность разбавления неудобна на практике. Можно разбавить раствор в 40 раз, т. е. получить раствор с концентрацией:
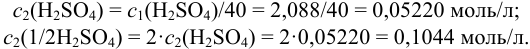
Согласно (8.13), 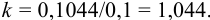
Например, при приготовлении 1 литра рабочего раствора кислоты, т. е. 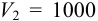 мл, необходимо с помощью пипетки взять
мл, необходимо с помощью пипетки взять 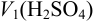 и довести в мерной колбе до метки:
и довести в мерной колбе до метки:
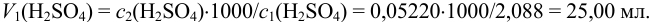
Пример 8.13.
Из 2,500 г 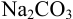 приготовлено в мерной колбе 500 мл раствора. Вычислить для этого раствора: a)
приготовлено в мерной колбе 500 мл раствора. Вычислить для этого раствора: a) 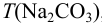 ,
,
б) молярную концентрацию, в) молярную концентрацию эквивалента 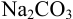 , если предполагается титрование приготовленного раствора рабочим раствором
, если предполагается титрование приготовленного раствора рабочим раствором 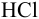 с индикатором метиловым оранжевым, г) определить молярную концентрацию
с индикатором метиловым оранжевым, г) определить молярную концентрацию 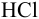 и
и 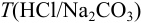 ), если на титрование 25,00 мл раствора соды израсходовано 23,35 мл раствора
), если на титрование 25,00 мл раствора соды израсходовано 23,35 мл раствора 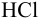 .
.
Решение:
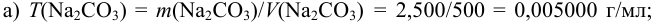
б) согласно (8.9), 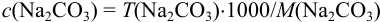 ,
,
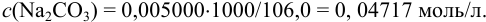
При титровании с метиловым оранжевым реакция протекает до 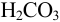 :
:
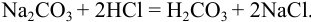
Тогда 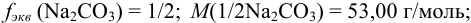
в) по формуле (8.8) находим:
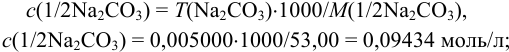
г) по формулам (8.1) и (8.12) находим 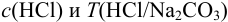 :
:
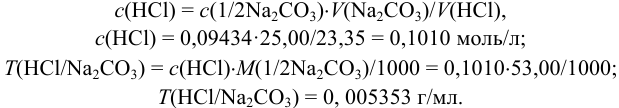
Пример 8.14.
Рассчитайте поправочный коэффициент 0,1 н. раствора 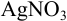 , если па титрование 0,09850 г
, если па титрование 0,09850 г 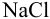 израсходовано 16,50 мл этого раствора.
израсходовано 16,50 мл этого раствора.
Решение:
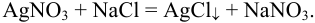
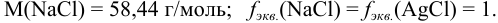
Для определения концентрации использовано прямое титрование отдельных навесок, следовательно, согласно формулам табл. 8.3:
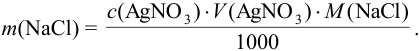
Из этого выражения находим:
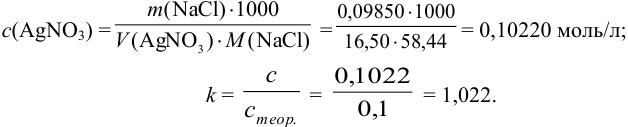
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

