Оглавление:



Применение принципа подобия физических свойств чистых веществ
Применение принципа подобия физических свойств чистых веществ. Формула, основанная на общем принципе подобия физических свойств веществ и теории соответствующих состояний (см. главу III), нашла широкое применение для расчета температурной зависимости теплоты испарения жидкостей от температуры. По мнению Карапетянца [5], если теплота испарения вещества I при температуре 7 равна 7 ″ Cn. B и его критическая температура ТКР. b, следовательно, для материала 2 при температуре T2 теплота испарения равна/. 2 и его критическая температура равна G, f. 2, существует зависимость ^1. = K = C0P5 ((U-15) * СП. 1. В ТКР. 1-Т,= 7 ″ р.2-Т2у.
Отношение теплоты испарения 2 веществ на равных расстояниях от критической температуры является постоянной величиной. Людмила Фирмаль
- Знать теплоту испарения/, » СП. I, Tcr \и Tcr значения стандарта 1 для определенного диапазона температур, R>, и теплоты испарения материала 2/.вы можете определить значение g, значение 1, константу / C и вычислить значение 7Нсп. Зависит 1sp2. 2 = / с /.Использовать! Для температурного диапазона известна теплота испарения, / sp b В качестве стандартного вещества обычно пьют воду(/СН2О = 1) значения K для некоторых веществ приведены в таблице. Ю-З. Стол Значение K в уравнении некоторого вещества (U-15) (Knao = ^ Пример U-4. Теплота испарения этилацетата при температуре 1 г = 76°С соответствует 7720 кал 1 моль. Рассчитайте теплоту испарения этилацетата при температуре 21,6°с* 2.Критическая температура этилацетата * cr.2 = 250,1°C, а критическая температура воды (стандартная) / nP.1 удар 374.20°C Решение.
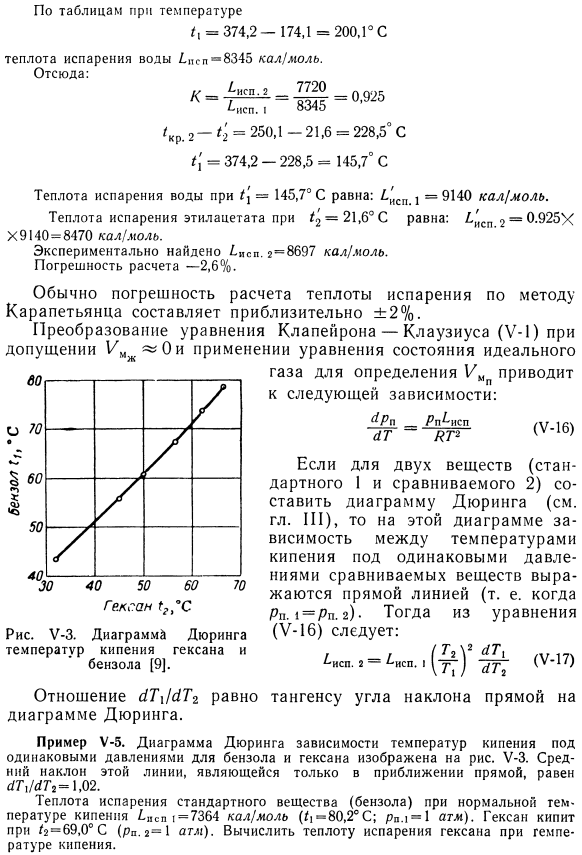
Температурная зависимость теплоты испарения влаги известна в a * P. 2-и= T’KR. 2-7 * 2 = 250.1-76 «174.1°С Согласно таблице температуры /(= 374.2-174.1 = 200.1 ° С Вода испарительная тепло/.sp = 8345 кал! моль. Отсюда: К = ^ НСП-2-около 925 /S = 3/, Исп.1-8345 » ° » 925 / 2-*:2 = 250.1-21.6 = 228.5°С. /、 ’= 374.2-228.5 = 145.7°С. Теплота испарения воды in / in= 145,7°c равна: a’SP l = 9140 кал / моль / 2 ″ теплота испарения этилацетата при 21,6°c равна 1’sp2 = 0,925 X X9140 = 8470 кал / моль. Это было установлено экспериментально. 2-5697 кал / моль. Погрешность расчета составляет 2,6%. Преобразование уравнения Клапейрона-Клаузиуса (Y-1) в предположении 1 / MJ ^ 0 и применение идеального уравнения состояния Газ для принятия решения приводит к следующему соотношению: (У-16) ^ Пн ^ НСП ЫТЬ » КТ2 Гексан. Рисунок U-Z. рисунок * температура двойственного кипения гексана и бензола[9].
- Для 2 веществ (по сравнению со стандартом I2), если составить диаграмму Дюринга(см. главу III), соотношение между температурами кипения при одинаковом давлении сравниваемых веществ представляется прямой линией (т. е. температурой кипения сравниваемых веществ). 1=Рп). д.)Тогда из уравнения (U-16)это выглядит так: ^ СП. Р = / » СП..(^ ) 2477 (V-17) Отношение yT \ 1 (XTr равно углу наклона прямой на диаграмме дюллинга. Пример U-5.На диаграмме показана зависимость температуры кипения при одинаковом давлении бензола и гексана. U-Z. средний наклон этой линии является только приближением линии, YG7U * 7 * −1.02. Нормальная температура кипения/.испарение стандартного вещества (бензола) в spsp 1= 7364 кал / моль (|/-80,2°С; 00,1 * 1 og.).
Гексан кипит при f = 69,0°C(ряд 2 = 1 атм).Рассчитайте теплоту испарения гексана при температуре кипения. Решение. Теплота испарения гексана при нормальной температуре кипения: *. Да. 2 = 7364 (§ C+ W!2 1.02 = 7070 кал / моль Найдено экспериментально{.Цепь. 2 = 6800 ккал(моль. Погрешность расчета+ 4%. Более точный результат может быть получен путем сравнения свойств исследуемого вещества с свойствами стандарта. Этот метод был предложен Отмером[10, 11]. Если записать уравнение (Y-2) Для сравнения характеристик стандартных 1 и 2 веществ при одинаковой температуре (T {= Tg)>, то: л 1П Ра. 2 =■ХГЛХпb ..ОМ8) СП. Я ^ Р2. 1Н ^ нл 2 х ИСП. Два АГ. * cr. 1. 1П /?П. С.. стр. С. 1.
Обычно погрешность в расчете теплоты испарения по методу Карапетянца составляет примерно±2%. Людмила Фирмаль
- При сравнении веществ при одинаковой низкой температуре (гр.1 = 7 ′ pr. г),*получается. Вот, rn = rn! rkr-это пониженное давление насыщенного пара. Значение Lr = rn-rr можно определить по формуле[10]. ДГ = 1.003-0.66 /> пр «(п-20) Формула (L / −20) очень точна с рядом декомпрессии 0.01 pPr 0.5. Размер отношения г^гггобычно обычно мало отличается от Unity. In это дело: (U-21) * НПС. 2 ′ кр. 2 меня? Армированный пластик. Два Точность формулы (U-21) зависит от коррекции отклонения сравниваемого вещества, аппроксимируя точность расчета формулой(V-19) и диаграммой Дюринга. Эта формула может применяться только в областях, где не очень высокое давление.
Смотрите также:
Возможно эти страницы вам будут полезны:

