Оглавление:






Полуэмпирические формулы для расчета кинематического коэффициента диффузии.
Полуэмпирические формулы для расчета кинематического коэффициента диффузии. Полуэмпирическая формула по существу представляет собой уравнения, основанные на кинетической теории газа (X1-23) и (X1-24) среднего диаметра столкновения a, 2 молярного объема вещества в кипящем состоянии (СМГ /моль) (см. таблицу с-2). Формула Жирара-Перрего. Простейшая полуэмпирическая формула для расчета кинематической диффузии 01 > 2 была предложена гилиландом[27], и на основе формулы (XI-23) эмпирически был выбран коэффициент b, дающий наиболее близкий результат к эксперименту, а средний диаметр столкновения 01.2 был заменен пропорциональным значением, которое вычисляется из объема газовых смесей, оба из которых были сжижены при нормальной температуре кипения. Форма формулы гириланда является Где 0] G2-кинетический коэффициент диффузии, см х сек. p-общее давление、\ В.., V » молярный объем жидкого компонента 1 и 2 МКНП. мкип. 2 о * Нормальная температура кипения найдена путем суммирования пропорций из таблицы. H-2, СМГ / моль \ Mi M 2-молекулярная масса компонентов 1 и 2; T-температура,°K.
Эта сумма определяется путем суммирования доли, предложенной Левисом в качестве дополнительной суммы. Людмила Фирмаль
- Преимуществом рассматриваемого уравнения является его простота и удобство использования. Формула для Арнольда. Арнольд [28]применил уравнение Сазерленда (X1-24) к техническому расчету, выбрал соответствующий постоянный коэффициент и заменил среднее значение диаметра молекул диффузионного газа, 2 на среднее значение молярных объемов этих веществ при нормальных температурах кипения. Арнольд также предложил метод вычисления констант Сазерленда, включенных в уравнение. Н = 0.00837 ^(М1±М1 г *(Х1. Сорок пять) Для вычисления константы Сазерленда используется следующая формула: (Х1-46) Согласно Фогелю[29] С,= 1.477 * С2 = 1.477 *、 Аппаратура. 1. Аппаратура. Два (Х1-47) где находится гжш? 1, Tm w, 2-нормальная температура кипения веществ 1 и 2 Величина коэффициента Р формулы (X1-46) зависит от соотношения молярного объема при стандартной температуре кипения (Vy IV и) диффузионного вещества( ВМ> 1 / м). «кровяное давление.2ICNP. Я… / Аппаратура. | / ^ м Завеса. Два 1 2 3 4 b 8 10 1.00 0.98 0.953 0.920 0.875 0.838 0.805 Значение P интерполируется из следующих данных: Арнольд опубликовал уравнение раньше гилиланда.
- Формула Арнольда учитывает влияние температуры более точно, особенно хорошо, но при ее расчете необходимо знать температуру кипения рассеянного газа. Формула Слеттери. 2 газовые диффузоры 1 и 2 корпуса: Падение температуры: Преобразование уравнений классической кинематики газов после принятия некоторых эмпирических упрощений приводит к зависимости. Где 01.2-коэффициент диффузии газа! И 2, см2 / с Tpr-пониженная температура, рассчитанная по формуле (X1-49). ТКР. 1> т * ЧР. 2 * » * критическая температура веществ 1 и 2,°к: ПК? А П *?L-вещества 1 и 2, критическое давление yy; M1U. 2-молекулярная масса веществ 1 и 2. p-это давление. я, B-константы. значения i и b приведены в таблице. Х1-9. Точность формулы Слеттери несколько уступает точности формулы Арнольда. Формула андреусова. Молекулярная масса M \и U газа, участвующего в диффузионном процессе, равна、 В случае значений приведенная выше формула дает результат с большой погрешностью. 17.2(1 + ум,+ / ИГ) см2 / с (Х1-51).
Основываясь на теории соответствующих состояний, Слеттери попытался вывести обобщенное уравнение для расчета коэффициента кинематической диффузии. Людмила Фирмаль
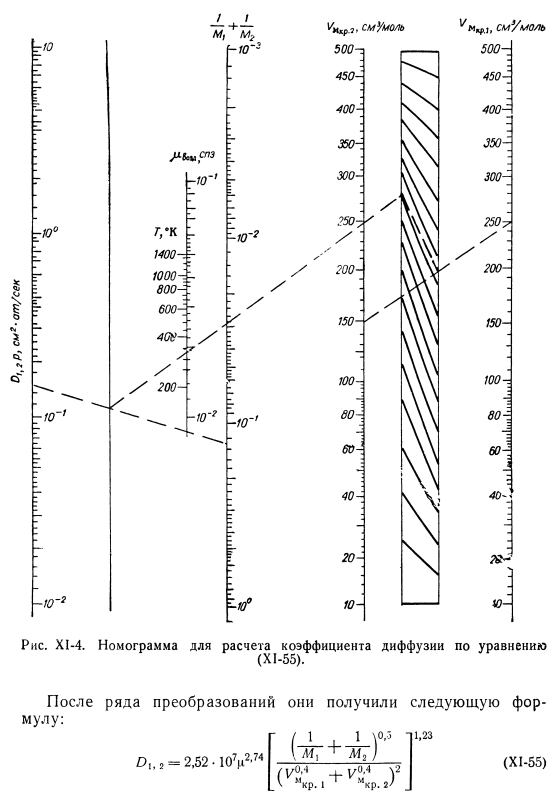
- Коэффициент самодиффузии%при температуре T и давлении p можно рассчитать по формуле: Показатель степени уравнения (X1-52) равен»o = / gm + 1″.^Показатель степени Формулы Андрусова (UP-38). При температуре 7°= 273,16°К и давлении 1 атм, постоянном Ло = 4,3. o 1, 2Р. 1 + 0.56 * 4.Р2 (Х1-53) После расчета коэффициента самодиффузии,/) 2. можно определить значение g, коэффициент диффузии 01.2.Использование уравнений: P ’ = 7Х7Щ Р2 = 1-Р、 Согласно Кувшинскому [30], зная 01.1 и 02.2, мы можем вычислить 01.2, используя следующее уравнение: Да. 2-К ^ 1, 1 ^ 2, 2(Х1-54) Если значения равны 01. 1 и 02, g близки, то формула (X1-54) дает хороший результат. Например, для системы СО— 02 или he —Н2 погрешность расчета не превышает 5%. Если разница между 01.1 и 02.2 велика(например, система CO2-H2), то погрешность расчета может достигать 25%. Формула отомера и Чена. Основываясь на сходстве температурной зависимости коэффициента диффузии и вязкости, отмер и Нин шин Чен [31]преобразовали.
Смотрите также:
Методические указания по гидравлике
Возможно эти страницы вам будут полезны:
- Результаты измерений кинематического коэффициента диффузии в газах.
- Расчет кинематического коэффициента диффузии на основе кинетической теории газов с учетом межмолекулярных сил взаимодействия.
- Диффузия в многокомпонентных газовых системах.
- Примеры расчета кинематического коэффициента диффузии в газах.

