Оглавление:















Подгруппа мышьяка
- Подгруппа мышьяка. Содержание элементов этой подгруппы в земной коре относительно невелико: мышьяк (J•10-4%)-сурьма (5-10%)-висмут (2-10″%) снижается. Они встречаются в основном в виде сернистых минералов-Олега (As4S4), аурипигмента (As»Si), сурьмяного блеска(Sb2S3), висмутового блеска(B12S3).3. все элементарные примеси обычно встречаются в различных металлических рудах. Для получения As, Sb и Bi их Серные руды сжигают на воздухе, сульфиды превращают в оксиды, а затем восстанавливают углем.
- Реакцию проводят по схеме. 232S3 +90®= 6S02 +2Э, 03 и Э203+ЗС = ЗСО+2Э В свободном состоянии элементы подгруппы мышьяка имеют металлический вид и очень хорошо проводят тепло и электричество. Од- * Грибова И. А. .. У. Б А Н-yunYcn, успехи химии, 1961 ″ нет. 1Д Но они очень хрупкие и легко измельчаются. Сравните их наиболее важные константы (с соответствующими данными азота и фосфора) ниже: В нормальном состоянии Состояние элемента агрегатного цвета N газ бесцветен. 。 。 П-это тяжело. Белый….. Серебро. 。 СБ » серебро. 。 Би «красноватый»! 。 。 Температура плавления. °с — 210, 44. 817 (36) 631. 271. КН температура genchm 、 °с −196 1.0 257 1.8 615 5.7 1631 6.7 1552 9.8 банкомат)
В нормальном состоянии Состояние элемента агрегатного цвета N газ бесцветен. Людмила Фирмаль
В нормальных условиях Sb не изменяется в воздухе, а As и Bi незначительно окисляются с поверхности. Мышьяк и его аналоги не растворяются в воде или органических веществах solvents. In много металлов, они легко придают сплав. В ряду напряжений As, Sb и Bi лежат между водородом и медью. Поэтому они не замещают водород из кислоты, а могут быть превращены в раствор реакцией, например, действием окислителя: 2As + 5C12 + 8H20 = 2H3As04 + JONS1 Bi + 4H \ Oj = Bi (N03) 3 + NO + 2H20 3 элемента все растворимые производные токсичны. 3-15. При нагревании на воздухе As, Sb и Bi образуют оксиды e2o3 и горят them. It также легко сочетается с галогенами и серой.
Образование некоторых соединений с металлами относительно рассматриваемых элементов менее характерно, чем с азотом и фосфором, но аналоги с нитрилами и фосфидами, сурьмой и сурьмой, например, $ 3A $ 2, Mg3Sb2 и Mg3Bi2. Благодаря действию на них разбавленных кислот, висмута с мышьяком («арсин»), сурьмы («бенд») и сходству общей формулы ENz («висмут») получается водород, а также аммиак и фосфин. Реакция протекает следующим образом: Mg33,+ 6HCI = 3MgCl2 + 2 EN3
Поскольку эти соединения нестабильны, Распад больших и малых элементов на элементы происходит уже в момент их образования, и поэтому они почти всегда выделяются в смеси с водородом. Это особенно верно для BiH3.BiH3 редко изучается из-за его крайней нестабильности. Арсин и стибины-бесцветные, высокотоксичные газы, содержащие сероводород (SbH3), такие как чеснок (AsH3) или запах. Они очень хорошо растворимы в воде, но не взаимодействуют с ней химически. Характерная реакция присоединения к аммиаку не наблюдается в Арсине и стибине. Оба являются очень сильными восстановителями.
При нагревании он легко разлагается на элементы, а при воспламенении на воздухе сгорает вместе с водой и образованием соответствующих ей оксидов. Оксиды As, Sb и Bi соответствуют общей формуле E20z. элементы легко образуются при нагревании на воздухе и представляют собой твердые вещества белого (As203 и Sb203) или желтого (Bi203) цвета. Ангидрид мышьяка (As203) хорошо растворим в воде, а оба других окиси почти нерастворимы. Химические свойства гидроксида E (OH) 3 серии As-Sb-Bi изменяются очень естественно.
Липиды обнаружены низкой растворимостью этого гидроксида в сильном растворе сильной щелочи, потому что они все амфотерные, и кислотная природа главным образом как(OH)3,главным образом одно Sb(OH) 3, и кислотная функция очень слаба к Bi(OH)3.Таким образом, кислотные свойства гидроксида E (OH) 3 серии As-Sb-Bi быстро ослабляются. Арсенит (H3As03) известен только в растворе. Гидроксид аммония (также известный как сурьмяная кислота) и Bi (OH) 3, представляет собой белый слоистый осадок. Оба элемента характеризуются продуктами частичного обезвоживания гидроксидов-SbO (OH) и BiO (OH).
Соответствующие радикалы-SbO (антимонил) и BiO(in и cm) часто входят в соль как таковую и играют в ней роль одновалентных металлов. Растворенные части гидроксиды, как и ШБ может быть диссоциированной одновременно в соответствии с абстрактной схемы Е- + зон ’Е(0н)3 = N3E03ZN’ + ЭОЗ » При добавлении кислоты в раствор равновесие сдвигается влево и образуется соль катиона E3 +.
При добавлении щелочи равновесие сдвигается вправо, и получается сурьмяная (сурьмяная) соль с мышьяковой кислотой (антиоксидант) или анионная ЭО〜соль. Кислотная диссоциация протекает даже при расщеплении молекул воды по типу Н3Э03Н* + 30J +Н » 0, в результате чего образуются кислотные соли мышьяка (HAsQs) и сурьмы (HSb02).Оба очень слабы 26 Поскольку основные свойства гидроксида E (OH) 3 серии Sb — Bi улучшаются, стабильность соли с катионами E3 *также повышается в том же series.
In в частности, соли кислородных кислот в AS3 *в свободном состоянии вообще не выделяются, а представители Sb3 *имеют только 1.Между тем, бесцветный Bi(N03) 3•5NgO является наиболее распространенным соединением висмута. Растворимые производные Sb3 +и Bi3 *легко разлагаются водой за счет выделения основных солей.27 ″ 30 Параллельно с ослаблением кислот и усилением основных свойств гидроксидов E (OH) 3 серии As111-Sb111-Bi111 ослабляются и восстановительные вещества.
То есть снижается тенденция элемента к переходу в более валентное соединение. Мышьяк, который является сильным восстановителем в щелочной среде, уже гораздо труднее окислить в кислой среде. Сурьмяная кислота не является типичным восстановителем, но ее очень легко окислить в щелочной среде. Наконец, гидроксид висмута может окисляться только самым сильным окислителем, в самой щелочной среде.
Высшие оксиды As и Sb-мышьяковый ангидрид (As205) и сурьмяной ангидрид (Sb2Os) — получают путем тщательного нагрева гидратов, образующихся при окислении элементарных as и Sb сильной азотной кислотой. Безводный мышьяк-это белая стекловидная масса, которая распространяется в воздухе. Безводный порошок сурьмы желтоватого цвета очень слабо растворим в воде. Соответствующий мышьяк As205 (H3AsO«) получают по следующей реакции: 3As + 5HN03 + 2H30 = 3H3ASO4 + 5NO Он легко растворяется в воде и почти так же силен, как фосфор.
Для Sb2O некоторые гидраты не характерны, и белый аморфный осадок * Sb205 * t / H20 изменяется по составу в зависимости от состояния excretion. In вода, она почти нерастворима. Кислотные свойства сурьмы довольно слабо.Арсенат (арсенат, или арсенат) в основном получают из ортогидрата гидрата (H3As04), сходного по свойствам с соответствующим фосфатом, а боль сурьмяной кислоты (сурьмяная кислота, или сурьмяная кислота) обычно получают из гексагидрата-H [Sb(6), соответствующего гидратированной форме OH (H)), соответствующей гидратированной форме: H ^ L ЗНB•L20*.
Как и фосфорная кислота, арсенат и антимонат обычно бесцветны и плохо растворимы в воде.31 * 32 вследствие действия нескольких сильных окислителей (С12 и др.) на фоне суспензии гидроксида висмута в концентрированном растворе NaOH или KOH образуется нерастворимое производное висмута 5 валентности, цвет от фиолетового до желтого. Их состав почти близок к формуле NaBi03 или KVYu3.Эти соли висмута очень сильны oxidants. So, в кислой среде двухвалентный марганец легко окисляется и становится семивалентным 33.
Сравнительная окислительно-восстановительная активность элементов мышьяковой подгруппы в характерных трехвалентном и пятивалентном состояниях может быть представлена следующей схемой: Как «1 Сб1» БИ » 1 АСВ СБВ Бив ■ 4—> Усиление восстановительных свойств усиление окислительных свойств Окислительные свойства мышьяковой и сурьмяной кислот замечательны только в кислой среде. Обратимая реакция Первого может вызвать окисление HI до 12 и даже 2-го до HC1 до C12. H3AS04 + 2HI H3AS03 + 12 + 2020h3sb04 + 5HCI SbC!3 + CI2 +4Н20 Производные пятивалентного висмута является окислителем не только в кислой среде, но и в щелочной среде.
Тридцать четыре Очень характерные сернистые соединения As, Sb и Bi получают как при взаимодействии серы с этими элементами при нагревании, так и при обменном разложении в растворе. Полученные сухие (и натуральные) Bi2S3 и Sb2S3 представляют собой серо-черные кристаллические вещества. Bi2S3 отделяется от раствора в виде коричнево-черного, Sb2S3 и Sb2S5-оранжево-красного, As2S? Асисс, порошок ярко-желтого цвета. Все эти сульфиды нерастворимы в воде и разбавленных кислотах(в то же время они не являются окислителями).
Сульфид мышьяка нерастворим в концентрированном виде! Но сильная азотная кислота (и царская водка) растворяет их по реакции. 3As2S5 + 40HN03 + 4H20 = 6H * As04 4-15H2S04 4-40NO Сульфид As, Sb и Bi проявляют сходство некоторых свойств с оксидами того же типа element. In взаимодействие с оксидами As и Sb аналогично. Щелочи дают кислотные соли h3e03 или h3e04、 Их сульфиды вместе с растворимыми металлами серы, например, по реакции образуют соль соответствующего тиоката (то есть кислоты, в которой кислород был заменен на серу).
StNHAS + AS2S3 = 2 (NH4) 3AsS3 и 3(NH.) 2S + As2Ss = 2(NH4) 3AsS Этот процесс также применим к сульфидам, antimony. In напротив, Bi2S3 практически не реагирует с растворимыми солями серы. Поэтому этот сульфид ведет себя аналогично оксиду (Bi2O3), который практически нерастворим в щелочи. Тиохиины (H3AsS3), тиохиины (H3AsS;) кислоты и соответствующие соли сурьмяной кислоты очень stable. As как правило, они желтые или red. Na, производные K и NH4 в воде хорошо растворимы, а большинство остальных едва растворимы.
Некоторые тиогидраты и тиогидраты используются для борьбы с сельскохозяйственными вредителями. В отличие от своих солей, свободная тиоевая кислота неустойчива и, согласно схеме, например, разлагается на соответствующий сульфид и сероводород. 2H3AsS3 = * AsS3J + 3H2S и 2H3AsS4 как ^ ’ — f 3H2S Поэтому, когда раствор тиозола подкисляется, соответствующие сульфиды осаждаются в результате реакции. 2 (NH4)3ASS4 +6НС1 = 6NH4CI + AS2S5 / / 3H2S Образование и разложение солей As и Sb Тио очень важно для качественного химического анализа.
Соединения галогенов As, Sb и Bi легко образуются за счет прямого взаимодействия элементов. Тип Галоида EH3 известен для всех рассматриваемых элементов и галогенов, но только тип представителя EF5 более или менее стабилен, только производные фтора и SbCls. In нормальное состояние, AsCfo и SbCI являются жидкими веществами, в то время как SbCI3 и BiCl3 являются твердыми веществами. Все 4 хлорида бесцветны и хорошо растворимы в воде, но подвержены сильному гидролизу.
Из-за хлоридов некоторые одновалентные металлы в основном относятся к типу M [ES1] и MJSbCJej. Могут образовываться комплексные соединения 3S-54. Добавь 1) соединения As, Sb и Bi были известны в Древнем Египте. Образование элементарного мышьяка из его природных сульфидов описано в Энциклопедии zossos (i§ 1 postscript 5), и во время раскопок в Вавилоне был корабль, сделанный из сурьмы 3000 лет назад. первое упоминание о металлическом висмуте содержится в трудах по алхимии в 15 веке. century.
In мышьяк и висмут, только 7sAs ^ Bi существуют в природе, а сурьма состоит из 2 изотопов (Sb (57,25%) и asSb(42,75%). 2) по структуре внешнего электронного слоя атомы мышьяка (4″, 4ps), сурьмы (№ 5p) и висмута (6s *6p®) аналогичны атомам фосфора и являются 3-валентными даже в основном состоянии. Непрерывная энергия ионизации (эВ) сравнивается со следующей. Я второй болезни И. в О………. 9.81 18.63 28.34 80.1 62.6 Sb………. 8.64 16.5 25.3 44.1 56 БИ………. 7.29 16.68 25 * 56 45.3 56D)
3) 3 элемента все обычные формы характеризуются одинаковым типом слоистой кристаллической структуры (рис. IX-53).Каждый атом связан с другими 3 [D w 2.5 (As), 2.90 (Sb), 3.10 A (Bi)] того же слоя и с другими 3 ближайшими соседями[d =-3.33 (As), 3.36 (Sb), 3.47 A (Bi)]. как видно из рисунка выше, разница в ядерном расстоянии прямого перехода вдоль ряда As-Sb-Bi непрерывно уменьшается(0.83—0.46—0.37 это не так.
То есть уравнение ядерного расстояния от типичного металла имеет определенное приближение. Отдайте каждый атом всем своим neighbors. At при этом относительная (Hg) электропроводность элементов ряда As (2.7)-Sb (2.5)-Bi (0.8) не только не увеличивается, но даже уменьшается. Увеличение давления оказывает очень различное влияние на электрическое сопротивление всех 3-х элементов(РНС.(IX-54).
Сурьма может образовывать смешанные кристаллы как с As, так и с Bi, но последние не образуются с каждым из них other. In в жидком состоянии элементы мышьяковой подгруппы смешиваются в произвольном соотношении. 4) при нагревании (в отсутствие воздуха), так как будет сублимироваться(то есть 615 ° С).Пар состоит из небольшой (около 0,03%) смеси as <молекул и as * молекул. При дальнейшем нагревании равновесие, обусловленное схемой E4 ″ j-2Eg <* 4E, будет все больше смещаться вправо.
Это характерно для паров сурьмы и висмута, которые имеют следующий состав при температуре кипения: 49% Sb4 + 49%Sb * + 2%Sb I 49%B1z + 51% Bi. Серия N *(226) — P, (117) — Asj(92) — Sb?(72) — энергия Dnocentiation 2 атомных молекул Bi2 (47) (ккал / моль) непрерывно уменьшается. Силовые константы связей As * As и Sb SB SB равны 4,0 и 2,6 соответственно. Элементы серии O-Te (добавленные к VIII§ 4.11) аналогично, связи между атомами ослабевают из-за увеличения. Размер.
Тепло элемента ятомнацина (pr 25 ° С) составляет 69(As). 64 (Sb) и 50 (Bi) атомов ккал / г. 5) подобно фосфору, мышьяк может присутствовать в некоторых аллотропах, обычный серый цвет является наиболее стабильным. Когда давление повышается, температура его плавления довольно быстро повышается(от 950 ° Cprn достигает 6 миллионов).Если пар охлаждается очень быстро, то мы получаем желтый мышьяк с плотностью 2,0 е / cm3.It очень растворим в дисульфиде углерода (около 20% при 8°С) и образует желтые кристаллы при выпаривании такого раствора.
Последний состоит из Альфа-молекул и имеет структуру правильного тетраэдра, а также фосфора (рис. IX-33) [rf(AsAs)=-2.44 A, x (AsAs)= 1.5, энергия связи 40 ккал /моль].в воздухе желтый мышьяк легко окисляется, а под воздействием света быстро становится серым(теплота перехода 1,8 ккал / г атомов). При сублимации as в потоке водорода образуется аморфный черный мышьяк с плотностью 1*) 4,7 г / см3.Последний не окисляется на воздухе, но при 270 куб. см и более он становится серым(передача тепла 1 ккал / г атома). б) элементарный мышьяк в основном используется в качестве добавки (около 0,3%), что приводит к образованию фракций.
Эта добавка повышает твердость металла и придает ему способность затвердевать в виде строго сферических капель. Соединения мышьяка применяют в медицине, при изготовлении кожи и меха, в стекле, фарфоре и других изделиях industries. An важной областью их применения является сельское хозяйство, в котором различные производные выступают в качестве одного из основных средств борьбы с вредителями культурных растений.
Годовой объем мирового производства АС составляет около 5 млн г (без учета Советского Союза).Есть монография о мышьяке. ; / Я * Рисунок ch1X-33. Схема строения слоев кристаллов BI от как, ШБ. И затем ■ J 1■J» — — — — — — -.1.1.: 1к. Дж Давление, утренняя тысяча. Это хорошее место для начала. 1Х-54.Влияние давления-это относительное электрическое сопротивление. * Рцхвдадзе В. Г. Мышьяк, М.. Металлурги. I960. 189р. 7) теплота плавления сурьмы составляет 4,8 ккал / г атома, а теплота испарения-30 ккал / г атома.
При повышении давления температура плавления падает до 57°C при 567 kbar. It соответствует тройным точкам Sb 1, Sb II и жидкости. Температура плавления Sbll повышается с дальнейшим повышением давления(она достигает 65°C уже при 600 кбар).Что касается аллотропии, то при нормальном давлении сурьма подобна мышьяку. Его желтая форма получается путем окисления Sbll3 озонированным кислородом при −90°C и всегда содержит важную смесь химически связанного водорода (около 10 атомов процентов).
Повышение температуры сопровождается разложением SbHj и переходом к черной сурьме (плотность 5,3 г / см*).Это также достигается быстрой конденсацией пара Sb. При электролизе сильно охлажденного концентрированного раствора SbCl3 на катоде осаждается аморфная масса, похожая на графит (плотность 5,8 г / см1), содержащая значительное количество хлора. Трение влечет за собой выделение белого дыма, вызывающего выделение тепла.
Нестабильность этой «взрывчатой» сурьмы явно связана с одновременным присутствием в ней обоих структурных элементов-металла (атомов Sb) и солей (Ионов SbCIJ, SbCI9 * n CI).Какая-то другая аллотропия. 8) сурьма является важным компонентом некоторых важных сплавов (тип печати буквенной печати, сплав для подшипника и т. д.). Она также используется в производстве sh-пряжек.
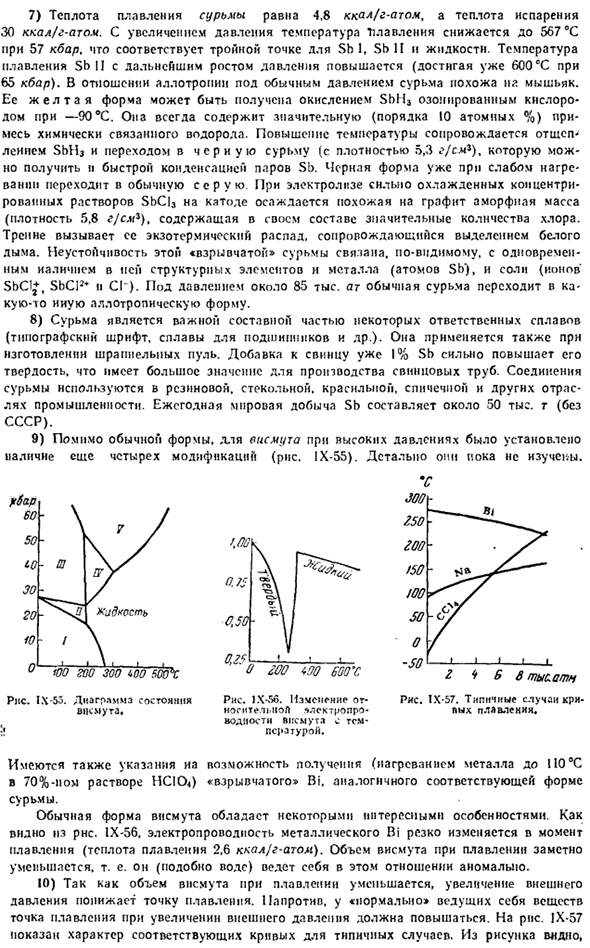
Если добавить уже 1% свинца из СБ, то это значительно увеличит его твердость. Это очень важно при изготовлении свинцовых труб. Соединения сурьмы используются в таких отраслях промышленности, как резина, стекло, крашение и спички. Ежегодное мировое производство СБ составляет около 5 млн г (без учета СССР). 9) кроме обычной формы, в висмуте высокого давления обнаружено более 4 модификаций(рис. IX-55).
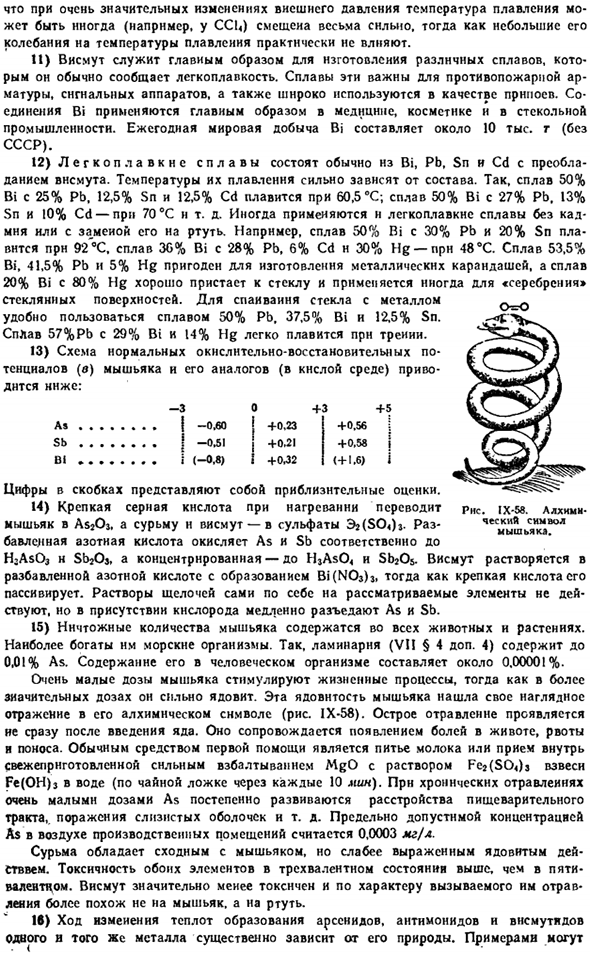
Они еще не были детально изучены. «ю ГОО зоо Тод сажи Пит IX-55.Диаграмма состояния висмута* 8000 ловит Диаграмма IX-57.Типичный случай холодного плавления. цбар 60. 50СО30201 Жидкость Ф. м 0,7 Дж 0,50 Рис. 1Х-С6. или-огнтел«.iioft * lek7ropro изменения. ppemugl Вт температура воды. 0.25 о ГОО соо соо соо соо с Имеются также указания на возможность получения «взрывчатого вещества» Би » путем нагрева металла до 4 ° С 70% — ным раствором HCl до 0°C.
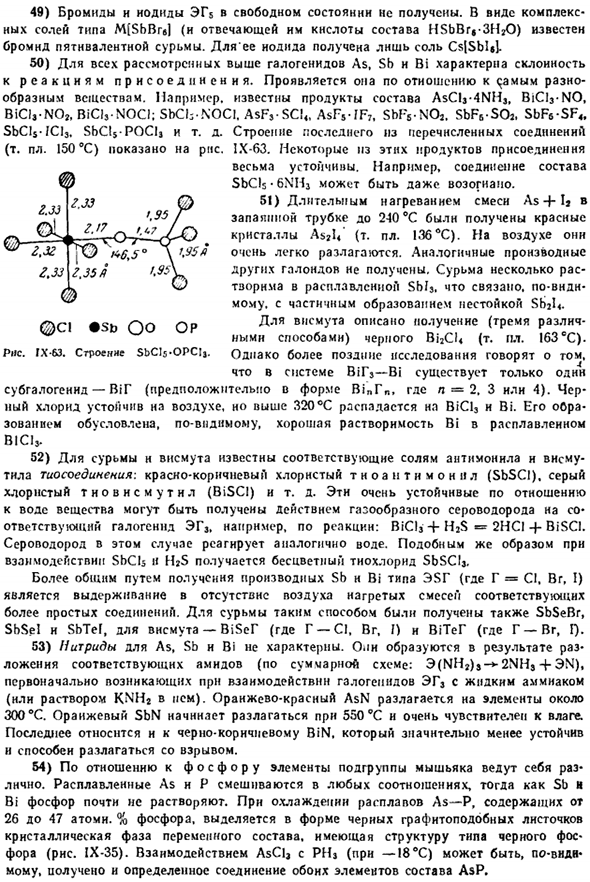
It напоминает соответствующую форму сурьмы. Обычная форма висмута имеет некоторые интересные особенности features. As вы можете видеть из рисунка 1X-56.Проводимость металла Bi быстро изменяется в процессе плавления (2,6 ККЛ / г атомов тепла плавления).Во время плавления объем висмута заметно уменьшается. То есть он ведет себя в этом отношении ненормально (как в воде). 10) из-за уменьшения объема висмута во время плавления температура плавления снижается из-за увеличения внешнего давления.
Напротив, при»нормальном» поведении веществ температура плавления выше, когда внешнее давление выше. Рисунок IX-57 показывает характер соответствующей кривой в типичном случае. Цифра такая Из-за очень больших изменений внешнего давления температура плавления может иногда очень сильно изменяться(например, в случае CC1), но ее небольшие изменения фактически не влияют на температуру плавления. 11) висмут главным образом использован в изготовлении различных сплавов, обычно impart растворимость.
Эти сплавы важны для оборудования пожаротушения, сигнального оборудования, а также широко используются в качестве припоев. Би-смеси главным образом использованы в медицине, косметиках, и стеклянных индустриях. Ежегодное мировое производство Би составляет около 1 млн г (без учета СССР). 12) плавкие сплавы обычно состоят из Bi, Pb, Sn и Cd с преобладанием висмута. Температура их плавления во многом зависит от состава. Таким образом, это сплав 50% Bi и 25% Pb.
При 60,5°C он плавит Sn 12,5% и Cd 12,5%. 27% Pb включая сплав 50% Bi. На 13%Sn и 10% Cd-70°C etc. Можно также использовать легкоплавкие сплавы, которые не содержат кадмия или были заменены ртутью. Например, сплавы 50% Bi и 30% Pb и 20% Sn плавятся при 92°C, 30% Bi и 28% Pb, 6% Cd и 30% Hg и при 48°C сплавы 53,5% Bi, 41,5% Pb и 5% Hg подходят для производства металлических карандашей, а сплав 80% Hg 20% Bi хорошо прикрепляется к стеклу и может использоваться для припоя стекла и металла, удобно использовать сплав 50% Pb. 37.5%BI и 12.5%ЗП.
Сплавы 57% Pb и 29% Bi и 14% Hg легко растворяются из-за трения. 13) обычная схема окислительно-восстановительного потенциала (в) мышьяка и его аналогов (кислотная среда) показана ниже. с +3 +5 + 0.С6 | +0.58 я <+ л.6)я Цифры в скобках являются оценочными. 14) сильная серная кислота при нагревании перемещает мышьяк в асджой, сурьму и висмут в сульфаты 32 (SO») 3.Разбавленная азотная кислота окисляет As и Sb до H> As03 и Sb ^ Oj соответственно и концентрируется в Hjaso Alpha и SbjOs-висмут растворяется в разбавленной азотной кислоте с образованием Bi (N03) j и сильных кислотных пассивов.
Щелочной раствор Сам по себе не действует на рассматриваемый элемент, но в присутствии кислорода, как и Sb, постепенно разъедается. 15) все растения и животные содержат следовые количества мышьяка. Самая богатая из них-морская жизнь. Так, келп (VII§ 4 add.4) содержит до 0,01% As. Его содержание в организме человека составляет около 0,00001%. Очень небольшое количество мышьяка стимулирует жизненный процесс, но большое количество мышьяка очень токсично.
Токсичность этого мышьяка была четко отражена в его алхимическом символе (рис.1X-58).Острое отравление не наступает сразу после введения яда. С появлением боли в животе, рвоты и поноса. Обычная первая помощь-пить молоко или принимать свежеприготовленное с МГО, которое сильно взбалтывают с раствором Fe (OH) j, суспендированным Fe2 (S04) 3 в воде (каждые 10 минут по 1 чайной ложке).
При хроническом отравлении следовыми количествами As, расстройствах пищеварительного тракта, повреждении слизистой оболочки и т. д. происходят постепенно, и предельно допустимой концентрацией ас в воздухе промышленных объектов принято считать 0,0003 мг / л. Сурьма обладает выраженным токсическим действием, сходным с мышьяком, но более слабым. Токсичность обоих элементов в трехвалентном состоянии выше, чем в пятивалентном.
Токсичность висмута гораздо ниже, и из-за природы отравления, которое он вызывает, он больше похож на ртуть, чем на мышьяк. 16) ход изменений в образовании арсунидных, сурьмяных и экстраядерных ядер одного и того же металла во многом зависит от их природы. Примерами являются Диаграмма IX-58.Алхимический символ мышьяк! / −0.60 Я-ОЛ1 Я: (-0.8) Как ШБ пока +0.23 +0.21 +0.32 Серия Na3As(52)-Na5Sb (51) — Na3Bi (48 ккал / моль) и Кахас, (139) — Ca3Sbj(114)-CajBij(75 ккал / моль).
Как видно из приведенных данных, теплоты образования соединений на почти одинаков, а в случае ка-она очень разная. 17) помимо разложения мышьяка и сурьмы кислотой, арсин и стибин могут быть получены, например, действием водорода в момент выделения против различных растворимых соединений мышьяка и сурьмы, по следующей реакции: AsjOj-f 6Zn 4-f12HC1 = 6znclj-fч 3h. молекулы AslU и Sbllj имеют треугольную пирамидальную структуру с углом вершины 92°N91®, [d (AsH)= 1,52 соответственно. d (SbK)= 1.71 A. J полярность обеих молекул очень мала(n = 0.22 n 0.12).
Кроме того, энергии связи As — H [/ c (AsH)= 2,71 и Sb — H оцениваются соответственно в 69 и 61 ккал / моль. Потенциал ионизации AsHj эквивалентен 10,6 векам. 18) Аль-Шейха (Мп.-117.Мп.-62°С).И Стевин(Мп.-94.Т. Кипятить.-18°С) является эндотермическим соединением (генерация тепла от элементов −16 и −35 ккал / моль соответственно).В нормальных условиях они почти стабильны.
Тепловое затухание Asllj заметно примерно при 300°C. даже более простые коллапсы sbll могут иметь взрывоопасный характер, когда сталь нагревается в отсутствие достаточного избытка водорода. Окончательно. BiH3 (произведенное тепло оценивается как n-55 ккал / моль) разлагается на элементы очень быстро даже в нормальных условиях. Пиролиз арены и стивии используется для глубокой очистки этих элементов. Растворимость в воде Ашдж и СБХ » около 1: 5 мимо volume.
In в органических растворителях она значительно выше(например, 1 объем сероуглерода поглощает до 250 объемов SbH3).Для водорода мышьяка кристаллический гидрат AsHi-6H: 0 стабилен только при −10 ° C и ниже. Непрерывное образование желтого пепла (HgCI)}, коричневого As (HgCI) и Черного HgjAs2 под действием Арены против хлорированной ртути иногда используется для его открытия. 19) в смеси золы и HI или HBr, инфракрасная спектроскопия (III§ 6 add.9) из-за низких температур установлено частичное образование ионов аргона (золы*).
Ионы SbH * не образуются при аналогичных условиях. 20) водород мышьяка — один из самых мощных неорганических ядов. Отравление может произойти, особенно во всех случаях, когда большое количество водорода получается за счет взаимодействия цинка или железа с кислотами (если исходный продукт содержит смесь мышьяка (это бывает очень часто), и если работа проводится без адекватных профилактических мероприятий).
Опасность от этого еще больше усугубляется. Первые признаки отравления(озноб, рвота и др.) обычно появляются только через несколько часов после вдыхания пепла. Основным средством оказания первой помощи является свежий воздух покоя пострадавшего. Подобно пеплам, wo слабее и действует на тело и SbHj. Если смесь обоих гидридов проходит через разбавленный раствор AgNO *, то мышьяк становится раствором (например, HjAsOj).
Сурьма находится в осадке (например, Sb205). 21) разложение мышьяка на элемент, который легко протекает при нагревании, является основой для метода обнаружения мышьяка, который обычно используется в судебной и санитарной медицине analysis. To проводят реакцию, исследуемый материал обрабатывают цинком и соляной кислотой, а выделившийся газ пропускают через нагретую стеклянную трубку.
При наличии Ас вблизи места нагрева образуется глянцевое черное покрытие («зеркало») элемента мышьяка. Соляная кислота, используемая для определения циклических кислот, должна быть тщательно проверена на наличие примесей мышьяка, используя тест «заготовку» (то есть выполненную без тестового материала). Обратите внимание, что сурьма дает реакцию, подобную мышьяку.
- Свойства «зеркала» могут быть установлены нагреванием или их летучестью относительно раствора NaOCl (как растворяется, но не Sb).Аналогично сурьма (но только в небольшой степени) действует в этой реакции и на висмут. 22) когда эфирный раствор SnClj действует на раствор соляной кислоты AsCI, коричневый порошок asjhj может образовывать нерастворимые в воде, щелочи и кислоте вещества.
Вещество легко окисляется и имеет тенденцию происходить естественным путем Распад стихии. Имеются также признаки того, что стабильные гидриды As2H4 могут быть получены только при низких температурах. 23) Если вы пропустите Asllj через жидкий аммиак, содержащий растворенный металлический калий, жидкость станет ярко-желтой. После испарения NHj остаются Амид калия и аналогичные производные мышьяка KAslI**.
Твердые серые гидриды сурьмы и висмута образуются частично при восстановлении SbCI или BiC! Людмила Фирмаль
Его пиролиз (по схеме KAsH2 = M3 4-KAs) происходит только выше 80°С, но NaAstb и LiAsllg разлагаются уже при 10 и 0°С соответственно. Таким же образом был получен красно-коричневый KSbH2. * Менее устойчив, чем каш. 24) теплота образования as, Sb и Bi оксидов составляет 159, 169 и 138 ккал / моль, respectively. In случай безводного мышьяка (иногда называемый «белым мышьяком»), восьмигранные модификации(mp.
In кроме 278 УК, известны еще 2: моноклинный (Мп.314°С) t; стабилизированный в стеклянном качестве над 310°C. жидкость AsaOj кипит на 461 ° C. растворимость в воде около 100%и prn 0 ″ C n 0%.Нагрев Sb2Oa (mp 656, mp.1456°C), изменение цвета на желтый, и нагревание Bi ^ Oj(mp.825, ВР.1890°C) — изменение цвета на красновато-коричневый. Плотность паров мышьяка и оксида сурьмы соответствует формуле 800 в 2 раза (выше As40 *и Sb «0», 1801). — Simple. By структура молекулы a $ 40 «(d (AsO) −1.8 A) и Sb4Oe U (SbO) −2.0 AJ аналогична P404 (рисунок 1X-36).Энергия связей as — O и Sb-O составляет 70 ккал / моль.
Растворимости AsjOj, SbjOj и Bi203 составляют 910} и 3-10 «при нормальных условиях, соответственно. 2-10 » * моль/л ПАО. 25) нагревая Sb2Oa (или Sb2Ob) на воздухе, можно получить белый, почти нерастворимый в воде порошок состава Sb204.Тепло, выделяемое из этого довольно типичного элемента оксида сурьмы, составляет 217 ккал / моль. Должный к сильному зареву, кислород отрезан и входит в Sb203.By сплавляя его со щелочью, можно получить оловянную соль M2Sb; 0$.Как и сам оксид SbjO.»
И производные его солей включают в свой состав как трехвалентную, так и пятивалентную сурьму, а также структурные (SB) Sbboj и M2 (Sb0) {Sb04J. мышьяк и оксид висмута E204 имеют сходную структуру (EO) с EO3, но они не характерны для обоих элементов. 26) раствор мышьяковой кислоты имеет равновесие по схеме HAsOj + NaO * * HiAsO, с сильным сдвигом влево.
То есть мета-тип резко преобладает над Орто-типом. Кислотные свойства HAs02 выражены очень слабо(K * 7-10-10), но они гораздо сильнее, чем соответствующая диссоциация по oasoh * * OAS ’+ OH ’ основной схеме (K «= 5-10, s).Последнее проявляется образованием AsOHSO, когда as 100% серная кислота и as (HSO) 3 растворяются в as2oj при растворении в Олеуме. 2-я и 3-я кислотные константы диссоциации H As AsOj имеют порядок i0 J J J4 насыщение растворов As2o J показывает pP = 5,0(при 25°C).
Большая часть арсенита производится из арсенита. Плохо растворимый (Г1Р-1-Ю17) желтый Агиасой имеет важное значение для химического анализа с орто-арсенитом. Ионы AsOJ, входящие в состав этой соли, имеют структуру треугольной пирамиды с атомами as в ее вершинах(c /(AsO)= 2.01 A. a = 109°J. 27) Как уже упоминалось в тексте, соль кислородной кислоты Sb3 *не является характерной.
Раствор Sb (или Sb: Oj) в концентрированной серной кислоте при повышенных температурах получают в виде обычного сульфата сурьмы-Sb2(S04).Эта соль производит кристаллогидраты с небольшим количеством воды, и при разбавлении раствора она сначала образует эйтилоилсульфат [(Sb0; 2S04]].Затем происходит дальнейший гидролиз. MISb (s04) 2 тип двойной соли является несколько стабильным в растворе).он получен путем взаимодействия обычного нитрата— Sb (SbCI с Agn’OJ в ацетоне.
Под воздействием небольшого количества воды она переходит в основные нитраты. Ортофосфат сурьмы образуется при нагревании смеси Sb2Oj+ P2Oj-1200°C).Для антимоната щелочного металла характерны типы M [Sb (OH) 4l, MSb02, M2Sb40 и M2Sh6O | 0. 28) состав сурьмы и калия K-аммония смешанная калиевая соль (Sb0) C4H40«H20 очень характерна для сурьмы.
Эта соль («рвотный камень») представляет собой бесцветный кристалл, который легко образуется при кипячении Sb203 с раствором тартрата водорода калия (KHC4N40) и легко растворяется в воде. water. It применяется в медицине и крашении. 29) нитрат висмута получают растворением металла в HNO*после выпаривания раствора он осаждается в виде большого бесцветного Bi-Кристалла (N03h-5H20.Эта соль очень растворима в эфире и ацетоне.
Нагревание кристаллогидратов предполагает удаление части азотной кислоты с образованием в воде азотнокислого хтрамуцила, а также остатков — (био) NO *. Bi2 (S04) 3(Мп.710 ° с) бесцветные гигроскопические кристаллы могут быть отделены от раствора Bi (или Bi203) в концентрированной серной кислоте. Сульфат висмута легко гидролизуется с помощью water. In некоторые сульфаты одновалентных металлов образуют комплексные сульфаты типа M (Bi (S04) 2]и MjBi(S04) 3J.
Из карбоната висмута выделяется только состав производного висмута (WU) 2C03- * H20. (H4) gCO3 для раствора соли висмута. 30) из соединений трехвалентного мышьяка мышьяк безводный является едва ли не самым важным, и это основной сырьевой продукт для получения оставшихся производных As. It применяется непосредственно в стекольной промышленности (отбеливание стекла), консервантах (меховая промышленность и др.) и лекарства.
Небольшое количество As203 оказывает благотворное воздействие на организм человека и животных(и, по некоторым данным, растений).Мы обнаружили, что добавление As203 в корм для скота значительно улучшает его рост и производительность. Оксид сурьмы (Sb203) используется для получения различных эмалей и ГЛ препаратов, а оксид висмута используется в производстве кристаллов.
Среди солей наиболее важной является соль висмута с основным нитратом в приблизительном составе BiO (N03) BiO (OH), которая используется в лекарственных средствах при заболеваниях желудка. Соль эго также используется в косметической промышленности и в производстве красок для покраски. 31) теплота образования as2o из элементов составляет 222 мкал / моль.
Его термическая диссоциация (AsjO * и 02) проявляется только при 400°C и above. In очень характерен случай мышьяковой кислоты(K \ = 6•10″®, K2 = MO » 7, / C3 = 310 «2), серебряной соли шоколадно-коричневого цвета, которая практически не растворяется в воде. Разница в цвете-AgjAsO » (дополнительные 26) и AgjAs04 (PR =!* 10 ″ 20) иногда используется для установления валентности мышьяка в растворе.
Ионы AsOJ имеют тетраэдрическую структуру с атомом водорода в центре(d (AsO)= 1,75 A).Арсенат Ca и Pb используются для борьбы с сельскохозяйственными вредителями. Кристаллический гидрат, выделенный в нормальных условиях из водного раствора As20$, имеет состав NaA $ 0″•VjHjO (т. е. As20s-4H: 0).Гидраты, состав которых соответствует пирогенной и метасоматической формам мышьяковой кислоты, образуются при dehydration.
In напротив, NaH2As04 изменяется при нагревании подобно соответствующему фосфату (§ 5).41). 00135230°с NaH5As04 — > — NaHjAsO, — Na3HjAs3Olo — >(N’aasos) x Полученный Метасиликат плавится при температуре 615 ° С и при низкой температуре (около −30 ° С) можно выделить кристаллогидрат Ajo * −7HjO, состав которого соответствует кислотному[HAHAsOe].Последние и подобные им соединения фосфора (§ 5add.50), образуется большое количество гетерополикислот и их солей, многие из которых очень стабильны в нормальных условиях.
Гидрат A $(OH)$не был получен, но a $(OCH*)$, полученный из него, известен. 32) сурьма безводная получается путем обезвоживания ее гидратов при 275°С. теплота образования элемента NS составляет 241 ккал / моль. Из солей сурьмы (/C | = 4-10 «5) производные K и Pb используются в керамической промышленности. Образование труднорастворимого Na [Sb (OH) e]используется в аналитической химии для обнаружения натрия (отсутствие лития и аммония). non [Sb (OHe) — имеет структуру октаэдра с атомом Sb в центре в составе этой соли (</(SbO)= » = 1.97 A]в составе этой соли. (ТАК.«)»
Желтый нестабильный Sb0 (N03) 3 также известен. 33) в чистом состоянии Суперсульфаты Na и K, очевидно, являются yellow. In добавлением к ним были получены оранжевые соли состава: 3 (Bi03) 2-4Hj0(где E-Ca или Ba) и черный AgBi03.Существует также демонстрация получения (путем спекания Li20 и Bi203 в кислородной атмосфере) Li3Bi04, Li * BiOs, Li. в I Oe присутствие IIBi03 и B1gO3 в качестве отдельных соединений сомнительно. 34) образование предэксидных производных элементов мышьяковых подгрупп не характерно. Однако некоторые соли сурьмы (HSb04) были obtained. As как правило, эти соли сурьмы слабо растворимы в воде. 35) в нормальных условиях и без нагрева воздуха все сульфиды As, Sb и Bi стабильны.
Например, как? S3 плавится при 310°C и кипит при 723°C без растрескивания. Asass разлагается на as2s3 и серу только при 500°C. 。 3 молекула сернистого мышьяка соответствует формуле As. S » (D(AsS)= 2.25 A) n состоит из того же типа, что и P40 (рисунок IX-36), а структура молекулы as4s4 показана на рисунке IX-59. Кипятить при 320 ° С и кипятить при 534°С.5 сернистый мышьяк, вероятно, соответствует уравнению As4Sjo и состоит из того же типа, что и P«ом(рис. IX-38). Сульфид мышьяка используется в кожевенной промышленности (для удаления волос SK SKUR), пиротехнике и производстве-в составе минеральных красок. Sb2S3 (Мп.560, Мп.1160°с), немолекулярном с, С4.
Польза в фейерверке, спичке, стеклянной индустрии、 SbjSj-резиновая промышленность (для «вулканизации» каучука). помимо вышеупомянутых сульфидов, известен As4S3. Sb2Slt Bi4S4, BiS2.In случай целидов и теллуридов. Sb. Bi характеризуется типом 92Se3 или E2Te3.Все эти соединения получают нагреванием смеси соответствующих элементов, по весовому соотношению соответствующих формуле.
Сравните теплоту образования некоторых из них со следующей (ккал / моль): As2S3 Sb2S3 BljS3 sb2se3 BJjSej SbjTe3 BljTe3 3S 33 37 31 33 14 19 Интересно, что при переходе вдоль ряда S-Se-Te максимальная теплота образования смещается от сурьмы (и мышьяка) к висмуту. Теллурид висмута(Мп.580, Мп.1172°C) используется в некоторых термоэлектрических устройствах. Его кристаллы имеют слоистую структуру и проявляют заметно различную электропроводность в направлении, параллельном вертикальному слою.
При повышении давления температура их плавления сначала повышается (до 15 000 атмосфер при 610°С), а затем снижается (до 50 000 ° С при 535 ° с). Основные свойства (Sv) As (OH) 3 и Sb (OH) значительно меньше, чем у гидроксида висмута, поэтому осаждение 3-валентных As и Sb сероводородом следует проводить в кислой среде, чтобы сдвинуть равновесие диссоциации обоих гидроксидов к образованию катионов E«Это далее применяется к осаждению 5-валентных As и Sb сероводородом. Реакция раствора в нем содержит лишь небольшое количество Ас-ионов….. с СБ……
Только большой избыток кислоты (особенно в случае АС) в равновесии Обратимая реакция Э04 «+8Н4НяО + э…..Сдвиг вправо достаточно 32S5 так, что образуется сульфидный осадок. помимо осаждения dsSs, сероводород также окисляется по схеме.+ H2S =■E » — S — + — 2H \в результате при осаждении производных As и Sb 5-валентности сероводородом в кислой (обычно соляной) среде образуется смесь сульфидов и^ S и осадок также содержит серу, которая выделяется при окислении.
В случае Sb восстановление до Э ’практически полностью отсутствует, а в случае As состав осадков сильно зависит от условий осаждения (концентрация, температура и др.). Промежуточной стадией осаждения пентавалентного мышьяка и сульфида сурьмы с большой вероятностью является образование nx-тионовой кислоты. С этой точки зрения основные процессы, происходящие при осаждении сульфидов, представлены следующей абстрактной схемой.30 «’4Ч,4Ч Ы ^, 0 + 3С»’, 3Ч * + 3С»» H33S4 и. Наконец. 2H33S4 — >-3, S5; 4-3H, S или 2H33S4 — ► 3, S3 / + — f 2S | — f 3H2S.
37) В дополнение к продуктам, в которых сера полностью замещена кислородом, было получено много промежуточных солей тиосилиновой кислоты против мышьяка и сурьмы. Например, для мышьяковой кислоты известны производные всех членов следующего ряда: H3As04. HjAsSOj, HjAsSjO *. HsAsSjO, H3AsS.»Образование таких веществ обусловлено растворимостью сульфидов As и Sb в щелочах.
AsS * — ионы представляют собой тетраэдры с атомом мышьяка в центре и d (AsS)= 2.23 A. Реакция: 2ка? Хасс? OJ-f-2H2S = 2Na2HAsS302H20 с последующим 2Na2HAsS30-f 02 = 2na2hass02 + 2Si имеет практическое значение для очистки различных газов от H»S и извлечения содержащейся в нем серы. По первому из них улавливается сероводород.
Согласно 2-му (запускаемому обдувающим воздушным потоком), воспроизводится первое решение. 38) приобретение AsCl3 удобно. Протекающий поток безводного мышьяка нагревают до 180-200°С и сушат НС1 до sbcl3-растворяют тонко измельченный sb2ss в горячем концентрированном нс1. Взаимодействие концентрированной серной кислоты с SbCl3 происходит по формуле: 2SbCl3 + 3H2S04 = Sb2 (S04) 3 + 6HClf. Чтобы получить BiCl3, растворите гидроксид висмута HCl или обработайте висмут царской водкой.
Затем остатки испарения перегоняют в отсутствие воздуха. Интересно, что под воздействием света BiCl3 постепенно темнеет и снова обесцвечивается в темноте. 39) молекулы ГАЛОГЕНИДА EG3 имеют треугольную пирамидальную структуру с атомом E на вершине и углом GZG около 100°.В приведенном сравнении показаны некоторые свойства рассматриваемого соединения: AsF j A » CI3 A * Br3 Asl3 SbF3 SbCI3 SbBr3 Sbl3 B! Ф3 BiCI3 BIBf3 б; и3 Тепло образования. ккал-моль 229 75 4 * 16221 91 62 24 215 91 62 26 д О-Г). А. 。 1.71 2.16 2.332.5с2. 03 2.33 2.49 2.72 2.48
Энергия электронного G. cc Аль’mol 115 73 60 46 104 74 61 45 91 67 56 43 Температура плавления.®С-а-16 31 n1 290 73 97 171 650 234 2 | 9 405 Температура кипения. … 58130221 371 319 233 289 402 903 439 461 542 Суммарные силовые константы AsF и AsCl оцениваются как 3,9 и 2,0 соответственно. И соединение SbC! И BiCl-1.8 и 1.2.Из интересующих соединений окрашен только желтый вибрион. Красный Aslj, Sbl3 и черный Bilj (для Sbl3 также известны менее стабильные желтые изменения).
40) молекула asf3 является ZГAsF = = 95,5°n и имеет очень высокую полярность (и-= 2,81).Cs, содержащий фтор. RB и K (Na или Li) arceitrifluoride могут образовывать комплексы типа MAsF4. Растворимость в воде SbF3 очень высока (4: I по весу).Фторид висмута, нерастворимый в воде, на самом деле вполне растворим в сильных растворах KF или NH4F, образуя комплексные соли типа M (BiF<).Комплексообразование с солями одновалентных металлов также является особенностью SbFj.
Наиболее распространенным типом образующихся комплексов является M [SbF4]тип M2 (SbF5]и MJ [SbjF7J соли также известны. Ион (SbFs} J — имеет октаэдрическую структуру, в которой 1 направление соответствует свободной электронной паре центрального атома I [SbaFyJ * » фтора(рисунок 1X-C0). 41) трихлорид Arssi имеет диэлектрическую постоянную e = 13 и представляет собой незначительную саморазложение по схеме: йодид щелочного металла AsCl3 4-AsC18 также слабо растворяется.
При взаимодействии с веществом, способным отдавать или связывать ионы хлора, образуются соответствующие производные, соответствующие акцепторной или Диорной функции молекул AsCI3 (^ ClAsC!=98е, m = 1,97, потенциал ионизации 11,7 а).Например, известны KAsCI4 и (AsClj] (SbCU].Смесь асцита и AsFj содержит небольшое количество Asfij и AsFjCI. Будьте хлоридом мышьяка. АСК!»Общая формула AsCI * — f 3h20 * * разлагается водой в соответствии с As (OH) 3-f-3HCI.
В отличие от гидролиза PCI , эта реакция удивительно обратима, и, добавляя избыток концентрированного HCl, ее равновесие может быть смешано слева. Из-за летучести хлорида мышьяка он движется в том же направлении, что и кипящий раствор. Из подкисленного водного раствора Аску можно экстрагировать эфиром. 42) для молекул SbClj потенциал ионизации q = 3,93 и 11,5 вольт равен given. In активные хлориды металлов, трихлориды и Sb и Bi классифицируются как тип M (ES! Комплекс M2 (ES15) и даже Me ES1|) может быть formed. An примером последнего является Csj / SbCI6.
43) Sb (OH) 3 и Bi (01 1) 3, поскольку основные свойства значительно более выражены, чем на рисунке 1X ^ 0.Структура ионов / SbaF; JJ». As (OH) 3. Гидролиз SbCl3 и BiCl » доходы образованием основных солей, а не базовой основы, согласно схеме. ES134-Н20* Э(ОН)С1,+НС1 и Э (он)С12+НзСЭ(ОН)аС14-НС1.Основные соли полученного типа E (0Н) * С1 легко отделяются от молекул воды, а нерастворимые хлориды (Sb и В!) из аттимоила или висмутила, respectively.
It это отличный способ начать работу. Таким образом, взаимодействие SbClj и BiClj с водой фактически протекает по схеме:3Clj +H20EOS1 | 4-2HCI. Взаимодействие между AsCl3 и As203 позволяет получить аналогичный состав хлорида мышьяка (AsOCl).То же самое относится и к SbBr3, но AsBrj растворяет только ковалентные соединения хлорида, бромида и йодида, а также соли соответствующих одновалентных металлов и может образовывать complexes.
In в частности, производные М-типа [BiI4]бромид и йодид разлагаются аналогично хлориду, а для скорости гидролиза галогенида мышьяка установлено соотношение AsF3> AsCl3> Assbr3>Assbr3 > Asbr3 > Asbr3 > Asbr3 > Asbr3 > Asbr3 > Asbr3. 44) рассматриваемый элемент, пейтафиллид, бесцветен. Некоторые из их характеристик Asf5 SbFe Bll-e Нормальное состояние Приставка wii…………..Сжиженный газ.
Трудный. Температура Плавления,°С, −80 +8 151 Температура кипения. День. 。 。 53,143 2E0 Все 3 фторида окислители, и в добавлении, серия As-Sb-Bi имеет быстрое увеличение в окисляемости 1 kbn. Теплота образования AsF5 из элемента составляет 296 ккал / моль, а энергия связи AsF в нем составляет 92 ккал / моль. Фторид висмута сублимируется в виде белых игольчатых кристаллов при нагревании трихлорвисмута до 600°С в потоке фтора.
Это соединение обладает мощным фторирующим действием, буря реагирует с водой, желтеет при влажном воздухе и буреет за счет гидролиза. Последний также является особенностью фторида мышьяка, а фторид сурьмы значительно менее гидролизуется, чем соответствующие хлориды. Для антимонопентафлуорондо известен твердый кристаллический гидрат SbF $ — 2H20.
Несколько типов кулачков m ’[9FsOH1, соответствующих ему по составу, были получены как в Sb, так и в As. В результате термического разложения в вакууме фторонтреата AsF3 (ONOh, SbF3 (ONOj) j и SbF (0N02> 4 (полученные взаимодействием соответствующего хлорида фтора и C1N0S)) были получены оксо-поглотители AsOF3,SbOF3 и SbOjF. Это белокрылые рентгеновские дифракционные картины.
Прямое фторирование эквимолярной смеси 03 и AsCI3 приводит к образованию газообразного myo-OAsF3 в нормальных условиях (mp 68, mp 26°C), который является полимером. Мышьяковая кислота-HjAs03F, HAsOjFc и H2A $ j0 * F8.In в первом случае значение K3-I-ICH. Анионы (AsaOiFJ *-O-O, состоящие из октаэдра, который стал двойным вдоль края-O (O / O)= 2.47 A] d (AsF) «= <(AsO) — » 1.81 A. расстояние AS-As равно 2.66 A.
Также известны фторсодержащие соли HjSbjOaF и HSbiOF, 0. Другие продукты, которые частично замещают атомы фтора SbF, например, вязкий полимер [SbF4(S03F)] n (то есть ключ.227 ° С) был получен. Растворение SbF в HS03F (VIII§ 1 additional 85) приводит к образованию HlSbFs-n (SOjF) i +Д в оловянной кислоте.
Здесь Л=О, 1, 2, 3, и прочность этих кислот возрастает с увеличением L. Антимонопентафиллид растворяет S, Sc, Te в синем, желтом или красном изображении раствора соответственно, из которого можно отделить бесцветный кристалл S (SbF5) 2 или желтый кристалл аналогичного производного. Селен и теллур. Описаны также продукты йодирования-темно-коричневый lSbF $(mp 80°С) и темно-зеленый I(SbFs) a (mp ill. M0°С).
45)как, СБ и Би-Ди-фторидных комплексных соединений, как правило, соответствует составу м [3Ф«], но МЮ [3F7J. На 3-ем ядерного расстояние октаэдра Ной[3Fel〜это 1.78(а) или 1,85 в (ШБ).Тенденция комплексообразования со схемой F—+ 3FS = 3FJ особенно ярко проявляется в сурьме. Поэтому при взаимодействии с другими фторидами SbF $обычно действует как фтор acceptor.
An примером может служить реакция по схеме: ClF,+ SbFs = CIFjSbF; и if,+ SbF,= IF * SBF «типа clfj3f ^комплексов(для ионов CJFJ параметры d(ClF) * =» 1.58 A и^ FCIF = 96е}также известны для мышьяка и фосфора, и много стабильности. Sb > As> P быстро уменьшается(в фосфорных комплексах при −38°C оно достигает давления диссоциации уже 760 мм рт. ст.).
Структура молекулы, сходная по составу с BrFjSbF^, соответствует почти октаэдрической среде сурьмы и прямоугольной среде брома. Общий атом фтора, [d (SbF) 1.90.d (BrF)= 2.29 A) больше, чем оставшееся ядерное расстояние[d (SbFj = 1.84.д(БСС) » 1.70 а].Производные хлорпентафторида получают и аналогичные — [ClF ^ SFe] (3-Sb, As) и llFeflAsF»] (давление диссоциации 25 мм рт. ст. при 20°С).
Взаимодействие безводного фтористого водорода с Сбф приводит к равновесию по схеме. 2HF-f-SbF5; * * Fhjbf ^ <FHj + SbF ^.Аномально высокая подвижность нового обнаруженного FHJ, по-видимому, обусловлена протонным обменом (V§ 8, 19 добавлено). Это также включает в себя производные инертных газов, таких как, в частности, желтый Электроионизационный,-2SbF»(Мп 63°С) и бесцветный KrF2-2SbF5 (Мп 50°С) (дополнение для VII§я 12).
По рентгеновским данным кристаллов структура первых соединений этих соединений показана на рисунке. 1X-61 (угол 147 n 150°вблизи сшитых атомов фтора). Среди продуктов гидролиза 2-го вещества неожиданно было обнаружено значительное количество FjO. Мы также получили XeFj-AsFs (mp 80°C) и 2XeF2-AsFs (кристаллы состоят из IX ^ FJ ^ AsFe-ионов), XeFe3F $(3 As, Sb) и 2XoFe-3F. Электроионизационный, — 2SbF «(Мп 108°с), XeOF4-2SbF5 (Мп 70°С).
Однако для XeF4 аналогичная производная неизвестна. Многие другие производные более или менее сложных катионов l. следовательно, он уже достаточно затвердел(NF4) 3Fe(§ I ext.76) в дополнение к FNN * AsFJ, стабильный Рисунок 1X-61. Конструкция XeFj•2SbF6. При безводном HF до 150°C это соединение растворяется без разложения и быстро разлагается в воде по следующей формуле: F \ NAsFe〜f H20-HAsF6 4-MgO 4-HF.
Твердый комплекс Oj3F7, полученный вместе с соответствующим производным фосфора (§ 5, дополнение 59), стабилен в нормальных условиях и начинает быстро разлагаться только при нагревании. Вода разлагает их по схеме. красный S, e (A $ Fe) 2. Также описан комплекс состава P02 (AsFeJ (E is I, C1) и 3Cla (AsF6) (E is S, Se, Te). 46) 5 хлорсодержащих сурьмяных петель получают реакцией: SbClj + 4-C12 SbCb 4-13 ккал.
Бесцветная жидкость(Мп.3, температура кипения 140°C, частичное удаление хлора), перегоняют без разложения при пониженном давлении. Благодаря ряду хлоридов одновалентных металлов SbClj образует довольно стабильный комплекс типа MfSbCle. SbCls 4-411 * 0 H3SbO 4-4-5HCl эта реакция (чтобы избежать восстановления сурьмы в воде, насыщенной хлором) является удобным методом получения чистой сурьмяной кислоты.
I * согласно концентрации соляной кислоты, как показано на рисунке IX-G2, тетрахлорид сурьмы используется в качестве вещества, которое легко высвобождает хлор в органических соединениях. synthesis. By структура молекулы, аналогичной пентагидрату фосфора (рис. IX-40), 3 атома хлора rf (SbCl)= 2.29 A. i-другие 2-2, 34 A. молекулярная структура отличается от SbCf $и твердотельного (PCI) желтого оксохлорида сурьмы-SbOC!3 и Sb02CI-очень гигроскопичны, неполярны и нерастворимы.
Растворитель. Подобное свойство характерно и для бесцветной Асойчи. 47) бесцветный SbC!3 и смесь SbCI производит темно-коричневую жидкость. Очевидно, что существует сильное равновесие в левом сдвиге: SbCl3 4-SbCl $ 2SbCl. В присутствии CsCl или RbCl выделяются черно-фиолетовые кристаллы комплексной соли типа M [Iscicle].Подобный тип бромида также известен. Исследования этих солей показали, что они не образуются из валентной сурьмы, но содержат одинаковое количество атомов Sb-1 и Sbv, то есть более точно описываются формулой в виде Mj (SbC) e)* M [SBC. Производные трехвалентной и пятивалентной сурьмы.
48) пентохлорид мышьяка, подобный SbCls, не образуется при взаимодействии asci3 с хлором. Однако оранжевый комплекс (PCURAsCU]и 1N (C2H$) » XAsCle] (температура плавления 117°C, разложение) известны анионы, содержащие 5-валентный мышьяк, связанный с хлором, но могут получать asf3, а хлор (в присутствии следовых количеств воды) может получать комплекс (Asf4) {AsF6), содержащий валентный мышьяк, связанный с хлором в катионе (Asf3). для заданной константы прочности значения K (ASCI)= = 3,23 и X (asf) −4,32 задаются другими производными катиона lascl «] \например{asci4] Sbfe.
Катион / AsCI » f легко растворяется, но Анон{AsF6J очень устойчив к воздействию воды. iv. для аналогичных катионов [SbCl<] было получено бесцветное кристаллическое производное (SbCuKSbFel (по другим источникам. SbF3Cl2 со структурой bpnramndalp).(SbCl4) 2SO и [SbCl4] F. (PCU) в отличие от F (§ 5 add.61).Чай тегриамера в твердом состоянии (Мп.83 УК) известно только. че [sbCle]〜Б [ШБ (О) С! с] Ряса. IX-6.
Компоненты SbCI и вибрационных решений. 49) например, бромид и йодид свободного состояния не были получены. В виде комплексной соли данного типа(и соответствующего кислотного состава Hsbbrv3h≧0) бромид сурьмы The является known. As для йодида была получена только соль CslSbUl 50) все галогениды выше As, Sb и Bi характеризуются тенденцией к добавлению reactions. It проявляется по отношению к самым разнообразным субстанциям.
Например, продукты состава AsCl3-4NH3f BiCl3-NO, BiCU-NO, BiClj-NOCI. SbCb NOCl. AsF3SCI», AsF5JF7, SbF6N02. SbF6SOi, SbFe-SF * SbCl $ JCI3. Например, SbCI5POCl3.Структура последнего перечисленного соединения (mp 150 ° С) показана на рисунке. IX-63.Некоторые из этих партнерских продуктов Он очень стабилен. Например, соединение с составом SbCls * 6NM может даже быть вспыхнуто.
51) красные кристаллы as2l (температура плавления: 136°C) были получены нагреванием смеси As + I *в герметичной трубке до 240°C в течение длительного времени. time. It разлагается очень легко в air. No были получены другие галогеновые аналоговые производные. Частичное образование нестабильного Sb2l, по-видимому, связано с плавлением Sbl3. Для висмута, черный Bi2CI (в 3 различных способах) подготовка (mp.163°с).Однако более поздние исследования показали, что система BiP3-Bi имеет только 1 субгалоген-HBr(вероятно, в виде Binrn, n = 2. 3 или 4).
Черный хлорид стабилен в воздухе, но при 320°C и выше он разлагается на BiCl3 и Bi. Его образование, по-видимому, связано с хорошей растворимостью Bi в расплаве B1C13. 52) для сурьмы и висмута известны тиосоединения, соответствующие солям сурьмы и висмута: красно-коричневый токоаммонилхлорид (SbSCl). Как хлорид серого цвета Tiovismuthnl (BiSCl).Эти вещества очень устойчивы к воздействию воды и получаются при действии газообразного сероводорода на соответствующий галогенид EH3, например, по следующей реакции: BiCl3-f H2S » 2HCI + BiSCl. In в этом случае сероводород реагирует аналогично воде.
Аналогично, бесцветный SbSCI3 тиохлорид получают взаимодействием SbCI с H2S. Более популярным способом получения производных Sb и Bi типа 3Sr (здесь G CI, Br, I) является выдерживание нагревания смеси соответствующих простых соединений в отсутствие воздуха. Для сурьмы таким же образом были получены SbSeBr, SbSel и SbTef; для висмута-BiSer(Г — CI, Br, I) и ВНеГ (где-br, I)
53) нитриды As, Sb и Bi не являются характерными. О. ih образуется в результате разложения соответствующего Амида(по общей схеме: 3 (NH2) S- » −2NH3-fEM).Это в первую очередь является результатом взаимодействия ГАЛОГЕНИДА EH3 с жидким аммиаком (или раствором KNHt в нем).Оранжево-красные ASN разлагаются на элементы примерно при 300°C. оранжевый SbN начинает разлагаться при 550°C и очень чувствителен к влаге.
Последнее относится к черно-коричневому бункеру, который гораздо менее устойчив и может разлагаться при взрыве. 54) Что касается фосфора, то поведение элементов подгруппы мышьяка отличается. Расплавленный как и P смешиваются в любой пропорции, но СБ н би-фосфин почти не растворяется.
Когда as охлаждается, P содержит 26-47 атомов и плавится.% Фосфора, кристаллическая фаза переменного состава со структурой, сходной с черным фосфором, выделяется в виде черных графитоподобных листьев (рис. IX-35).По-видимому, взаимодействие AsCl3 и PH3(-18°С) может быть использовано для изучения некоторых соединений обоих элементов в составе AsP. ©CI #Sb Oo или рисунок 1X63. SbCI5-построить OPC!3.
Смотрите также:
| Круговорот азота | Подгруппа ванадия |
| Фосфор | Углерод |

