Оглавление:















Подгруппа марганца
- Подгруппа марганца. Первый член этой подгруппы, миргы -^—, принадлежит к элементу, который очень распространен в природе и соответствует примерно 0,03% от общего числа атомов в земной коре. Небольшое количество Мп содержит много горных пород. Наряду с телом имеются также скопления его кислородных соединений, которые имеют вид преимущественно серо-черного минерального пиролиза (Mn02 * xNgO).
- Содержание рения в земной коре очень мало (9-10-10%).Этот элемент очень распылен. Даже самый распространенный минерал (молибдат) обычно составляет 0,1 мас. Содержится в количестве, не превышающем%.Технеций, являющийся промежуточным членом подгруппы, практически отсутствует в земной коре. Небольшое количество происходит во время искусственного transmutation.
Широкое применение рения и его производных до сих пор не найдено. Людмила Фирмаль
In вообще, по химическим свойствам технеций гораздо ближе к РЭМ, чем марганец. Около 90%добываемого марганца расходуется на производство легированной стали. Именно поэтому, как правило, чистый марганец выплавляют не из руд, а из высоколегированных Mn и ферромарганца (70-90% Mn), которые содержат железо и железо. carbon.
It выплавляется из смеси марганца и железной руды в электрической печи, а марганец восстанавливается углеродом по всем реакциям Mp02 + 2C-f 72 ккал = 2CO + Mp Очень чистый марганец можно получить электролизом раствора его солей. В виде порошка элементы подгруппы марганца имеют серый цвет, а в компактном состоянии это белый металл, похожий по внешнему виду на железо (Mn) или платину (Tc, Re).
Сравните наиболее важные константы ниже. Мп ТК ре Плотность, г / см5……… 7.4 11.5 21.0 Температура плавления, * С….. 1244 2200 3180 Температура кипения,°С….. 2120 4600 5640 Механические свойства металла во многом зависят от способа его подготовки и предварительной обработки 12-14 В воздухе компактный марганец покрыт очень тонкой оксидной пленкой, которая предотвращает окисление даже при нагревании. Наоборот, в мелкодисперсном состоянии он окисляется!
Это очень просто. Взаимодействие с галогенами протекает очень активно, что приводит к образованию солей MnH2.При нагревании он также связывается с типичными металлоидами, такими как марганец, сера, азот, фосфор, углерод, кремний и бор. Водород вполне растворим в Марганце и не вступает в химическое взаимодействие. Химическая активность рения несколько ниже.
Например, oi не соединяется напрямую ни с йодом, ни с азотом. Водород компактным рением явно не поглощается. В серии напряжений марганец находится между Mg и Zn. При нагревании он разлагает water. In разбавленные кислоты, марганец * очень энергично реагируют на замену водорода с образованием катионов Mn технеций и рений находятся в ряду напряжений на правой стороне меди и не взаимодействуют с HCl.
Азотная кислота легко растворяет их и окисляет по схеме: ZE + 7HN03-ZNE04 + 7NO + 2H. fi Марганец образует соединения, которые могут визуально отслеживать влияние изменений валентных состояний на характеристики. Хорошо изучены его производные, соответствующие следующим оксидам: MpO Mp203 Mp02, (Mp03) Mp207 Закись азота, марганец, марганец Марганец марганца безводный
Поскольку увеличение положительной валентности атома связано с увеличением его заряда и уменьшением его радиуса, предполагается, что диссоциация соединения марганца зонного типа протекает по-разному с различными валентностями марганца (согласно рис. V-13).На следующем рисунке показано, что это действительно так. Усиление основных свойств*- МП (он) 2 и Мп(он) 3 и Мп (он) 4(Н2Мп04) НМп04
Повышенную кислотность В целом характер изменения свойств наблюдается у производных рения и технеция. Для обоих этих элементов наиболее характерным является семивалентное состояние. Общим исходным материалом для соединений марганца является природный pyrosite. By нагревая его потоком водорода, получают зеленый порошок оксида марганца (MnO), который не растворяется в воде, но легко растворяется в кислоте.
Соли, соответствующие оксиду марганца, например, образуются при растворении самой пиролюцитовой кислоты в результате реакции Mn02-f4HC1 = mncl2-f Cl2 + 2н202мп02 + 2h2s04 = 2mns04 + 02 + 2н20 Когда щелочь воздействует на раствор этих солей, белый гидрат оксида марганца осаждается [Mn (0H) 2].на воздухе оксид марганца постепенно становится коричневым, так как окисление протекает (окончательно) по схеме. 2Mp (OH) g + 02 + 2NoO = 2Mp (OH) 4 Водонерастворимый Mn (OH) 2 является основанием, и когда он реагирует с кислотой, он легко образует соли соответствующего двухвалентного марганца.
Большая часть последнего не имеет МН-розового цвета, он легко растворяется в воде(рис. VII-23).2-валентная марганцевая соль является наиболее стабильным производным этого элемента в кислой среде. Обжигая место пиролиза, можно получить черный оксид марганца (Mp203). черно-коричневый гидроксид Mn (OH) 3, который соответствует dnmarganetransnoxide, почти нерастворим в воде и является очень слабым base.
As как правило, соли трехвалентного марганца нестабильны и практически не нуждаются в Контакте. Последнее также относится к небольшому числу производных ранее известного трехвалентного рения. MnO2 является наиболее стабильным соединением оксигената марганца в нормальных условиях, но ReO2 легко окисляется до более высокого оксида рения(NiO2).Оба эти диоксина являются Рисунок VI1-23.
Растворимость солей марганца (моль / л Н20). Черное, нерастворимое в воде вещество. Соответствующий темно-коричневый гидроксид е (он) 4 характеризуется свойствами обоих полов и практически нерастворим. Однако основные и кислотные функции обоих гидроксидов выражены очень слабо. Производимые из них соли, как правило, нестабильны.
Для технеция также было подтверждено присутствие черного диоксида (и других производных со значением+4). При сплавлении MnO2 со щелочью в присутствии окислителя (например, атмосферного кислорода) образуется марганцевая соль. 2Мп02-f4кон + 02 = 2к2мп04+2н20 Соль Н2Мп04 (марганцевая кислота или соль марганцевой кислоты) темно-зеленая. Соли марганца Na и K легко растворимы в воде, в то время как бариевая марганцевая кислота слабо растворима.
Свободный Н20404, выделяющийся при подкислении раствора марганцевой кислоты, неустойчив и быстро разлагается по схеме 3H2Mn04 = Mn02 + 2HMn04-f 2H20 Образование Mn02 и свободной манганоевой кислоты (NMp04).Например, аналогичный естественный распад по схеме ZK2Mp04 4-2N20 = Mp02 + 2KMp04 4-4KON Это также характерно для солей марганца в растворе, но только если они гидролизованы.
То есть он будет гораздо медленнее(особенно в сильной щелочной среде).Соли рениевой кислоты (H2Re04), сходные по составу с манганатами, являются еще более нестабильными и не требуют особого внимания.43 ″ 47 Все производные шестивалентного марганца являются сильными окислителями и легко восстанавливаются до MnO2(щелочная среда) или mn2 * соль (кислотная).
С другой стороны, действие очень сильного окислителя (например, свободного хлора) окисляется до солей марганца: 2K2Mp04 4-C12 = 2KS1 4-2KMp04 Вышеуказанные реакции иногда используются для получения KMp04.1. эта соль (так называемый перманганат) является одним из наиболее практичных и важных соединений марганца. Стабильность 7-валентного элемента, соответствующего оксиду 32 унций, существенно отличается.
Когда холодная концентрированная серная кислота действует на KMp04, безводный марганец (Mp207) выделяется в виде темно-зеленой маслянистой жидкости. Оксид димангангепта разлагается уже медленно (до MnO2 и кислорода) в нормальных условиях и разлагается (до Mn2Od и кислорода) при слабом нагревании или ударе и взрыве. Желтые Tc207 и Re20; легко образуется, когда металл нагревается в потоке кислорода.
Поэтому он плавится при 120 и 296 ° С и испаряется без разложения 4 * −60 E207 при взаимодействии ангидрида с водой образуются соответствующие кислоты NE04 (марганец, технеций, рений). Раствор имеет пурпурно-красный цвет, а раствор нтс04 при разбавлении превращается из темно-красного в желтый и бесцветный, а раствор hre04 становится бесцветным.
Прочность марганцевой кислоты почти равна НС, но диссоциация технеция и рения несколько слабее 61. Соли марганцевой кислоты(марганец или перманганат) обычно окрашены в пурпурно-красный цвет ионами MnOOT. Как и ионы TCOT и NaeOG, соли технеция (кислота технеция, или соль кислоты per-technetium) и рения (кислота рения, или соль кислоты per-rhenium) бесцветны.
Образование малорастворимых солей с катионами Cs * характерно для всех 3 кислот (и хлорной кислоты, которые близки по структуре).Их соли калия также относительно плохо растворимы, но соли натрия и двухвалентных металлов легко растворяются в воде. Что касается нагрева, то многие Пери-иодаты и пертех-тиаты очень стабильны. Таким образом, KTcOi разлагается только при 1000 ° С, а Креот перегоняется при этой температуре и не более.
Напротив, KMp04 уже сломался, в основном по схеме, примерно при 250°C 2KMp04 = KaMp04 + Mp02 + 02 Эта реакция пригодна для получения кислорода в лабораторных условиях. Окислительные свойства, которые очень выражены в Марганце и его солях, не характерны для лизинимонатных и перреновых солей, а переход к более низким валентным производным рения происходит только под действием мощного восстановителя.
Технеций является промежуточным и NTCO может быть восстановлен очень легко. Соли NMp04, в частности калий, могут нуждаться в переработке. KMp04-темно-фиолетовый crystal. In этот метод, перманганат обычно получают электролизом мощного раствора KrMn04.KMn04 образуется на аноде(по схеме MnOJ-e = Mn04), в катоде выделяется водород.
Перманганат очень силен и устойчив к щелочности, особенно в кислой среде. environments. It следует помнить, что характер восстановления кислоты (Mn-до) и щелочи или нейтрали (Mn02 до) часто встречается в химической практике при окислении перманганата различными веществами.53-84 Теперь, изучив химию галогена и элементов подгруппы марганца, сравнив оба соединения, бросается в глаза, что существует полная разница в свойствах их низковалентных производных.
Однако, если число высших валентных групп совпадает, как и ожидалось, исходя из доктрины электронного аналога (VI§ 4), то элементы марганцевой подгруппы становятся прямыми аналогами chlorine. In в частности, Re20;, Tc207 и MP2O7 подобны C120,но оксиды типа E207 неизвестны для брома, и присутствие в йоде подозрительно. Добавь 1) марганец известен с 1774 года. Существование его аналогов датируется 1870 годом. И. Это было предсказано Менделеевым.
N-я линия (№ 75) была открыта в 1925 году, а технеций 43) впервые приобретен в 1937 году 2) природный марганец состоит только из атомов «Mn и Линии-2 изотопов-e, Re (37,1%) и Re» (62,9%).Для технеция известны только радиоизотопы, из которых ТС является наиболее распространенным (среднее время жизни атома равно 3. 10″). 3) в осевом состоянии атом марганца и его аналоги составляют ndb(n + 1) 5 (соответственно-3d » 4s).5d * 6s») имеет структуру потенциального 5-валентного внешнего электронного слоя.
1. передача электрической энергии на Р-уровень(с возбуждением полувозначного состояния) требует затрат 53 ккал / э атомов (Mn). 47 ккал / г атом (ТС) и 54 ккал / г атом(Ре). Ниже сравнивается энергия непрерывной ионизации(эВ) всех 3 атомов элементов. 1 11 III IV V VI VII VII Mp. 。 。 。 。 7.43 15.64 33.69(53.4)76(100.7)119.24 Tf. 。 。 。 。 7.28 15.26(29.3)(43.5)(59.2)(76.2)(94.1) Ре. 。 。 。 。 。 7.87(13.2)(26.0)(37.7)(50.6)(64.5)(79.0)
Электронное сродство атома рения оценивается в 3 ккал / моль, а функция работы электронов от металла составляет 4,80 эВ. 4) марганец биохимически очень interesting. An точный анализ показывает, что он присутствует во всех животных и растительных организмах. Обычно его содержание не превышает 1000% от 1 минуты, но оно также может значительно увеличиться.
Например, листья свеклы содержат до 0,03% — до 0,05% в организме красных муравьев. А у некоторых бактерий даже до максимального процента МП. Эксперименты по кормлению мышей показали, что марганец является необходимым компонентом food. In в организме человека большинство Мп (до 0,0004%) содержит сердце, печень и надпочечники. Очевидно, что воздействие на жизнь очень разнообразно и затрагивает в основном рост, кроветворение и функционирование половых желез.
5) добавление небольшого количества соединений марганца в обычные удобрения часто значительно повышает урожайность некоторых важных культур(кукурузы, сахарной свеклы, картофеля и др.).Особенно эффективно «марганцевое удобрение» в почве Нечерноземья・пауза, где используется известь. в) в избыточных количествах по отношению к норме соединения марганца действуют как яды, вызывая хроническое отравление. Последнее может быть связано с вдыханием пыли, содержащей эти вещества compounds.
It проявляется в различных расстройствах нервной системы, болезнь развивается очень медленно. Предельно допустимым содержанием марганца в воздухе производственных помещений считается 0,0003 мг/л. 7) марганец очень диспергирован на скалах, его смывает вода, и каждый год сотни тысяч тонн уносятся реками в море. С другой стороны, содержание Mn в морской воде очень мало (от 10-7 до 10«%), а более глубокий ил в океане содержит еще больше (до 0,3%).
Это связано с постоянным окислением водорастворимых (за счет кислорода в воде) производных марганца двухвалентными, практически нерастворимыми диоксидными гидратами (MnO}• NaO) и осаждением на дно. Камнеподобные образования («конкреции»), которые могут содержать до 45% марганца (и смесь кобальта).Никель и медь. Есть шанс на богатое (а в мире ежегодное производство марганцевой руды достигает нескольких миллионов тонн, и месторождения такой небольшой массы подлежат промышленному освоению.
8) сплав железа и марганца очень твердый и прочный. Наиболее важной из них является марганцевая сталь (83-87%Fe.12-15% Мп.1-2%С), применяемые при изготовлении деталей, требующих высокой стойкости к ударам и истиранию. Рабочая часть дробилки, шаровой шарнир обычно изготавливается из нее. Как фабрика. Большое количество марганцевой стали используется в производстве железнодорожных рельсов.
Среди других марганцевых сплавов особенно хорошо используются Мельничный чугун (15-20% Mn) и марганцевая бронза (95% Cu и 5% Mn). 9) в лабораторных условиях марганец обычно получают реакцией 3MnjO» — f 8A1 ″ = 4A2203-f 9Mn-f 602 ккал. Этот алюминотермический метод также используется в технологии. Полученный металл может быть очищен дистилляцией в электрической печи при пониженном давлении. pressure. In электролитическое развитие марганца, они обычно возникают от разрешения mns04.
Есть монография по марганцу. * S и l и A. X. марганец. М.. Металлурппдат. 1959 год. 10) параллельно с перемешиванием молибдена происходит добыча рения из молибденовой смеси (MoS2): после окислительного обжига руды происходит ее обогащение. После дистилляции его отделяют от Му, который является менее летучим, а затем переносят в лейнат.
Для очистки от примесей важно, чтобы HReO можно было извлекать из сульфатного раствора некоторыми органическими жидкостями (например, амиловым спиртом).Металлический Re обычно получают нагреванием NHjReO *(или KRe04) до температуры более 500 эк в потоке водорода. Rsakiin следует формуле: 2NH » ReO » 4 — + 4H2 = 8H, 0-f Na-f 2Re(или 2KRe04 + 7H2 = 6H20 + 2KOH + 2Re).Мировое годовое производство рения и его производных измеряется в тоннах. Есть монография по рению. *
11) разделение Tc и Re достигается достаточно путем пропускания влажного HCJ в раствор 200% H2S04, нагретый до 80°C. рений переносится в дистиллят и технеций сохраняется. Металл HS был впервые получен нагреванием его сульфида (Tc5S7) до 1100°C с потоком hydrogen. It может быть электролитически изолирован с помощью катода. Технеций нерастворим в смеси H2O2 и H4OH (отличается от Re).
Он реагирует с хлором гораздо сложнее, чем рений. Имеются обзоры статьи и монографии о технеции 12) ряд Mn (3.5 и 52.5) — Tc(5.5 и 138.0) — re (7.9 и 169.0) — теплота плавления (1 колонка) и испарения (2 колонки) до атомов ккал / г последовательно возрастают.
Преобразование твердого металла в парообразное состояние при нормальных условиях потребует затрат следующего повышенного тепла: 69,3 (Mn). Атомы 155(Tc) и 186 (Re) ккал / г. 13) известны 4 аллотропные модификации марганца (a -, p -, y и 6).Точка перехода находится при 727.1101 и 1137°С. из них а-форма (плотность 7,4 г / см3), стабильная при комнатной температуре, характеризуется твердостью и хрупкостью, в то время как рафинирование при повышенных температурах гораздо мягче и более пластично.
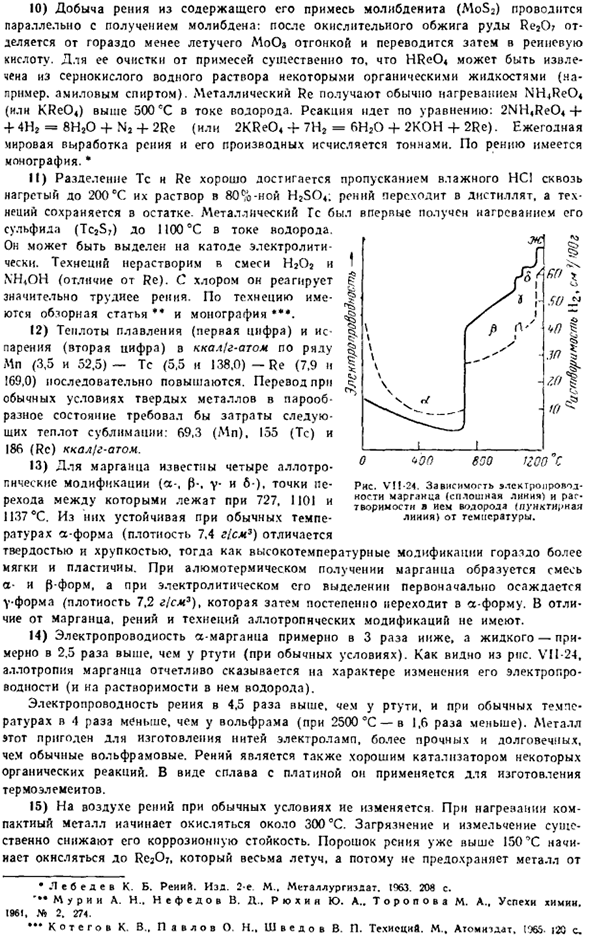
При приготовлении алюмосурмикса марганца образуется смесь типа А и типа Р. При электролитическом разделении V сначала осаждается(плотность 7,2 г / см3), а затем постепенно превращается в форму. В отличие от марганца, рений и технеций не имеют аллотропных модификаций. 14) электропроводность а-марганца примерно в 3 раза ниже, а жидкой ртути-примерно в 2,5 раза(при нормальных условиях).
Как видно из рисунка VI1-24, аллотропное тело марганца явно влияет на характер изменения его электропроводности (и растворимости в нем водорода). Электрическая проводимость рения в 4,5 раза выше, чем у ртути, и в 4 раза выше, чем у вольфрама (2500 и 1,6) при нормальной температуре. Этот металл подходит для производства нити накаливания лампочек, он более прочный и долговечный, чем обычный вольфрам.
Рений также является отличным катализатором для некоторых органических reactions. It применяется при изготовлении термопар в виде сплавов с платиной. 15) в воздухе рений изменяется в нормальных условиях. При нагревании компактный металл начнет окисляться при температуре около 300°C. Из-за загрязнения и измельчения коррозионная стойкость значительно снижается.
Порошок рения уже превысил 150°C и начинает окисляться до Re20.It не защищает металл, потому что он очень летуч. Рисунок VI1-24.Температурная зависимость электропроводности (сплошная линия) манглинца и растворимости (пунктирная линия) водорода в Изме. * Лебедев К. Б. Рений. Эд. 2-й М.. Металлургия 1063.208 секунд * * * М и Р и А. Н.. Нефедов В. Д.. Ру и я Ю. А. О П О Т Р В и А. А. успехи химии. 1961 год. Дж * 2.24. ••* K к K от него. В. .. Павлов О. Н., Шведов В. П. Техиецив. М.. Atomtdat, t * 36S. Страница 20 Дальнейшее окисление.
Рений не взаимодействует только с HCl и не взаимодействует с HF (даже при нагревании). Типичный окислитель, более или менее, легко преобразует Re в HReO или его соли. Щелочная среда сама действует на рожь, но вносит значительный вклад в ее окисление. Взаимодействие металлической линии с фтором и хлором начинается уже при 100°С и выше, а с бромом-300 и выше. С избытком противотум. фары, рифа, Recia, и нестабильная ReBr формируются, соответственно.
Образование ReSj при взаимодействии линии и серого*начинается примерно при 400°С. 16) следующие окислительно-восстановительные потенциалы в среде кислотности (1-я колонка) и щелочности (2-я колонка) соответствуют полному переходу по схеме e * + 7e «E».+ 0.74 дюйма и −0.21 дюйма (Мп). +0.47-дюймовый и −0.48-дюймовый (ТС); +0,37-дюймовым и −0.58-дюймовый(Ре).Из этих данных видно, что он последовательно, окислительно, продвигается до максимальной валентности ряда Mn — Tc — Re(в щелочной среде это легче осуществить, чем в кислой среде).
Наиболее распространенные валентные переходы марганца характеризуются значениями потенциала, показанными ниже(c): Зима 0+ 8 + 4 + 7 Хорошо сделанная окружающая среда… — Я −1.1 буквы» J + ЭЦП от J +1″.J щелочная среда… / −1.55 / — 0Jto | + БС»я Валентный переход+ 3 * E * 4.Mn аналоги в кислой среде характеризуются потенциалом+ 0,74 (Tc) и+0,51 (Re). 17) известны производные марганца и Ленина, соответствующие всем значениям 0-7.Но некоторые из них представлены только нестабильными или комплексными соединениями.
Возможно, то же самое относится и к технецию. До сих пор изучены все валентные состояния технеция. 18) тепловыделение некоторых производных марганца, технеция и рения из элементов сравнивается со следующим (ккал / э ’ 9кв): MnO MP / 0″MnO, Mn, 07 Tf, от ReiO? MnS MnSe MnPt MnCl, MnVr » Mn! F 45 58 31 12Г921 25 14 около 55 45 29 19) взаимодействие mnot и соляной кислоты — MnO,+4НС1 «mncu + 2H! Он прогрессирует в фазе 0 (реакция нейтрализации) и MnC1» «■■MnC1 „+С1 “ (окислительно-восстановительная реакция) 2.
Последняя реакция протекает с промежуточным образованием MSCC. Разбавленный H2S04 действует на диоксид марганца(в отсутствие восстановителя), и вместе с кипящей концентрированной серной кислотой [MnO] реагирует по формуле, приведенной в тексте. 20) кроме нагрева MnOt в потоке водорода, удобно получать MnO прокаливанием оксалата марганца(реакция протекает по формуле MnCiO „= CO “ + CO + MnO).Кристаллическое состояние можно отличить перекристаллизацией MNO от плавления KC1.
Такой оксид марганца стабилен в воздухе, но его мелкодисперсный порошок очень легко окисляется. Чистый расплав MNOs при температуре 1780°C 21) из раствора солей марганца Mn (OH) двухвалентный / осадок (ПР »» 2•10 «1*)?при рН 8,7, под воздействием атмосферного кислорода, окисление этого гидроксида фактически протекает по формуле 6 Мп (OH) * + 0» 2Mpe04 + 6HtO.2-я константа диссоциации Mn (OH) t основного типа составляет 5-10 * 4.
22) при нагревании Mn (OH) в очень концентрированном растворе NaOH (без окислителей) образуются красные кристаллы с составом 2NaOH•Mn (OH).Также были выделены аналогичные производные Ba и Sr типа 2E (OH)| ’Mn (OH).Наличие этих соединений свидетельствует о признаках обоих полов, которые наблюдаются у Mn (OH).Первая константа диссоциации кислоты оценивается величиной I * JO-1.
23) Безводное состояние двухвалентная соль галогенида марганца (MnH) образует розовые кристаллы, которые легко растворимы в воде (кроме плавления) МНФ Гося ПРВ 930 по. Его растворимость составляет около 10 а / л).Наиболее важным из них является MnClj(Мп.650 * с, МП.1231 * С) и обычно выделяется в виде клветаллогерата MClCl * 4H | 0.
Лист бумаги, пропитанный раствором MPSC, иногда используется для открытия озои. Под его воздействием ИА становится коричневым (за счет реакции со схемой MnClt 4-3HjO + Oj-Mn (OH),+ 2HCl + O*).При совместной кристаллизации галогенидов марганца с соответствующими галогенидами ряда других металлов возможно получение двойных солей в составе, например, MnFfKF, Mncb’KCl, MnClt•2KS1.In в серии MnClr-MnBrj (mp 698 eC) — Mnlf (mp 638 # C) тенденция к образованию таких соединений ослабевает.
24) нитрат марганца обычно выделяется в виде кристаллического гидрата Mn (NO») s * 6Н » 0.It легко растворим в воде water. In для получения чистого диоксида марганца удобно использовать разложение Mn (NOj) A[по схеме Mn (NOj),-MnOj4-2NO) при нагревании. 25) сульфат марганца технически получают обработкой MnOj термически концентрированной серной кислотой.
Обычно он продается в виде розового кристаллогидрата MnS04-4Hj0, который растворяется easily. In Безводное состояние, MnS04 (mp.700 * C) почти colorless. It применяется в сельском хозяйстве как средство, стимулирующее прорастание семян.> Из слаборастворимых солей 2 # Mn » * следует отметить MnC03 (PR =» 9 * 10″) и MnS (PR7 — U>» w).Карбонат марганца встречается в природе как минерал марганцевой руды.
Чистый MpCO $ — это белый порошок, используемый для изготовления масляной краски (марганцевой белой).Уже при температуре около 100 * C он начинает распадаться на MnO и CO]. Для качественного анализа сатиба марганца важно, что сульфид марганца (MnS-xHjO) образуется в виде аморфного розоватого осадка под действием сульфида аммония Mn**.
Этот осадок, оставленный на длительное время в безвоздушном состоянии(быстрее-при кипячении или измельчении в ступке), переходит в зеленую МНС(Мп 1615 ° С).Переход ускоряется в присутствии избытка (NH4> » S. при оставлении в воздухе осадок постепенно буреет за счет оксиаленов по схеме MnS +О, — f2H, 0-Mn (ОН) 4 + S. 27) валентное состояние рения, соответствующее значению+2, возникает при давлении 100 атм, в результате взаимодействия при 300°с смеси Крео с избытком концентрированной соляной кислоты и водорода.
Из двухвалентных соединений рения описаны в основном ReCla-4HjO темно-синего цвета, reclj-2CH1•2HiO темно-зеленого цвета и некоторые производные последнего. Водный раствор ReClj вызывает кислотную реакцию и очень стабилен в отсутствие окислителей. Также был получен черный Рентгеноаморфный РЭС, который легко окисляется на воздухе в присутствии влаги. Среди производных двухатомного технеция описаны только комплексные соединения с двойным составом.
28) 2 структурные формулы могут соответствовать окислению композиции Mn * 0*. И затем Валентность марганца равна different. In на самом деле, существуют обе формы. Первый из них образуется, например, при длительном нагревании участка пиролиза до 700°С, а второй-при окислении мно кислородом воздуха. Природный минеральный состав Mn / 03 (коричневый свет) является производным марганца с валентностью 2 и 4.
При нагревании выше 300 ° C с потоком водорода Mn3Oz уменьшается до MnO. 29) красный 3-валентный фторид марганца получают, воздействуя на МНФ при 250 * С. Если он превышает 600°с, МНФ $разлагается в исходный материал. Разложение в воде по уравнению 2MnF * — f 2HtO » ■ MnOt J-f + MnFs 4-4HF. Однако, если HF является избыточным, его можно отделить в виде красного кристаллогидрата MnFa-2HjO.
In наличие темно-красной двойной соли в составе фтористых солей калия и других металлов, MnFs-MF, MnFj-2 MFP Да. Да. MnFt * 3MF (M-одновалентный металл).Подобный MnF-трихлорированный марганец стабилен только в виде такого бинарного соединения(например, mnssc’ZKS черного цвета!).) Но MnBr ’и Mn1′ не получается при all.
- It следует отметить, что в присутствии избытка ионов фтора Кмп04 восстанавливается только в кислой среде не до 2-валентной (нормальной), а до 3-валентной. 30) взаимодействие MniO с очень сильной (более 75%) серной кислотой дает зеленый Mni (S04) 8.In в сухом состоянии разложение начинается примерно при 300°С.
При использовании 70% кислот выпадает коричневый осадок MNA (S04) в составе hjs04 6h20, а при снижении концентрации H% S04 до 50% соль полностью растворяется. hydrolyzed. in некоторые сульфаты других металлов, Mni (S04) могут образовывать диморфные соединения, такие как CSIS. Mn2 (s) f24hi0 кислота, которая представляет собой темно-красную кристаллическую форму фосфорной кислоты. воздействуя на него, HC1 получается при −100°C и, по-видимому, стабильный коричневый Mncl®только ниже 40°C.
Наиболее распространенным из них является коричневый марганец (chjcoo) t-2hjo. Людмила Фирмаль
3!Изучены производные трехвалентного рения, в основном ReCl, ReBr * RejOt-xHjO и некоторые двойные соли. Трихлорэтан может быть получен нагреванием KeSSC с азотом tox и очисткой вакуумом distillation. It представляет собой темно-фиолетовый кристалл, который растворяется в воде с образованием раствора темно-красного цвета.
Последний в свежеприготовленном состоянии дает осадок AgNO, свидетельствующий о том, что практически отсутствует электролитическая диссоциация ReCl.в твердом состоянии и парах (300°С) он является тримером, а определение молекулярной массы в уксусной кислоте приводит к выражению RejCU. Производным димера является темно-зеленая двойная соль состава RejCb ’ 2mcl.
Он полностью экстрагируется эфиром из водного раствора 3-х хлоридов рения. Возвращен $устойчива к окислителям. Напротив, в нейтральной среде, он очень быстро окисляется кислородом воздуха до HRe04. При нагревании в потоке водорода при 300°c, ReCl восстанавливается до металла и не образуется хлорид рения.
«По характеристикам сублимации при 450°С без разложения он очень похож на ReCl, но темно-коричневый ReBr «n не так много-коричневый Rel».Для первых 2 галогенидов получено достаточно стабильное красное бинарное соединение типа RelVMr, где M-Cs, Rb, K. In показано, что хлориды, их структура соответствуют уравнению димера (MjlCURcReCU) с прямой валентной связью между рением atoms.
In известна также форма двойных галогенидов с более сложным составом-трехвалентный технеций. Нейтрализуя холодный кислотный раствор реку щелочью в отсутствие кислорода воздуха и других окислителей, можно отделить черный осадок рения 3 валентности-Re3Oj * xH, 0.Этот осадок растворим в высокотемпературном концентрированном HCl (или HBg) и легко окисляется на воздухе до HRe04.
32) пиролизит был известен человечеству еще в древние времена. Диоксид марганца имеет различные технические применения. При нагревании до температуры выше 500 ° с кислород начинает отделяться и переходить в MnO2 (промежуточный продукт типа xmnjoe * уМпО}). это является основой для использования MnO * при окислении различных соединений серы и производных железа в стекольной промышленности, затемняя стекло.
Диоксид марганца, смешанный с льняным маслом, катализирует окисление на воздухе, что приводит к высыханию масла. Поэтому мно часто вводят в состав сухого масла, из которого готовят масляные краски. MnOa также основан на его использовании в специальных противогазах для защиты от угарного газа. MnOa часто использовано в разнообразие химических работах, как сильный оксидант в кислотном environment.
In при окислительном производстве водорода, которое происходит в процессе эксплуатации элемента, расходуется значительное количество MnOi. 33) соли, соответствующие кислотной функции гидрата диоксида марганца, дают названия mar ga и tsovatistock и syl-jc или mcgaints. It очень трудно разделить их в чистом виде.
Это неудивительно, поскольку при синтезе сухим способом (нагревание оксида металла с мно), а также при осаждении из раствора образуется смесь продуктов различного состава obtained. It по-видимому, синий раствор MnO2 в загущенном коне также содержит смесь производных 3-валентного марганца.
34) производным марганцевой кислоты (и гидрата оксида марганца в качестве основания) является манит Хауса, природный темно-красный минерал:2Mn (OH)f +Н4МПО4 = MN, 04+4h * 0.Поэтому с химической точки зрения таусмеит (MPa04) следует рассматривать как марганцевый манганат.
В лабораторных условиях Mn * 04 получают окислением вновь осажденного Mn (OH)§за счет воздушного потока при кипении жидкости, в которой происходило осаждение. Османит (mp 1590°С) также образуется, когда MnO2 (или Mn2O3) iacalivainne превышает 1000°C. 35) из солей, соответствующих основной функции Mn (OH) 4, иррациональный черный Mn (S04) был получен из других.
При разбавлении водой раствор сильной серной кислоты разлагается и осаждает Mn (OH).При нагревании Мнфж до 500°с потоком фтора образуется синий сублимат, который является МНФ*это вещество более медленно разлагается на воздухе и интенсивно (со вспышкой) в воде. М является щелочным металлом.
Тетрахлорид марганца (MnCU) образуется в качестве нестабильного промежуточного продукта в результате реакции MnO *с сильной соляной кислотой (может быть экстрагирован эфиром). Н.)Коричневый MnSj начинает разделение серы даже при слабом нагревании, и смешанные производные серы MnOS и MnBH также были зарегистрированы.
36) диоксид рения получают пиролизом при NH4Rc <4) 600 ° С (по схеме 2NH4Re04 = » 4HjO-f N,+ 2ReOa). при 650°C, где нет кислорода, он разлагается по схеме 7ReOj = 2Rea07 + 3Re. Функция кислоты характерна для Re (OH) 4, но еще меньше, чем для Mn (OH) 4.
Однако рео можно получить путем сплавления Реоа с воздухом, водой общей формулы м нерастворимыми бурыми лайитами Na и K без щелочи. Ca2Re04 и CajReO также описаны. 37) из соединений, соответствующих основной функции Re (OH), известны следующие: Temiosei ReF4(mp.12 £ cC), черный ReCI * ReBr4 и кривошип Rel4.
Когда ReCl4 нагревается за пределами ZOVGS, это будет обсуждаться в ReCI и ReCls, и черный Re 1t и Rel могут быть получены пиролизом ReI4 при определенных условиях. Железы Ref4 являются водорастворимыми и гидролизуются путем осаждения Re (OH) 4.
Водонерастворимый черный остаток образуется при нагревании смеси порошка рения и серы(образуется тепло 43 ккал / моль). При 1000°C и выше oi является возвышенным, частично разложенным. 38) диоксид технеция получают разложением NH4TcO при нагревании. В отличие от MnO»и ReOj, он обладает термической стабильностью и перегоняется при температуре около 1000°С без деградации.
ТСА взаимодействие? При 400°C CC14, TcC14 был получен в виде красных кристаллов(при тех же условиях Rein образовал ReCI$). TcSj также известен. 39) это бинарное соединение с соответствующими солями нескольких одновалентных металлов, которое гораздо более устойчиво, чем простые соли четвертичных Mn, Tc и Re.
Основными типами таких производных являются EG4 * 2MG и EG4 * MG. Здесь е МН, ТС или re, M-это одновалентного металла, и G представляет собой галоген. Примерами являются mnf4•2KF и TcCU * 2KCI желтого цвета. Зеленый ReF4•2KF и ReCU-2KCl, красный MnF4-KF и ReBr4-2KBr. МПК! Кристалл 4 * 2KS1 состоит из K * Иона и RF (MnCl) октаэдрического MpC ||〜аниона≒2.28 A. другие соединения типа EG4-2MG имеют аналогичную структуру.
Галогенированный технеций характеризуется переходом по схеме HBr HI KaTcClg — » — KaTsVg, — KaTcI、 40) производная 5-валентности элементов рассматриваемой подгруппы фактически хорошо изучена. Желто-зеленый ReF $в Steam (mp 48, mp.221 ° C) бесцветен и имеет тенденцию к дефициту питательных веществ ReFe и ReF *. MF-ReF-тип соответствующий бесцветный двойной фторид. Где M-Na, K. Rbnln C $.
Согласно схеме, она была получена взаимодействием ReFe в жидком SOf с соответствующим Nodong dam: 2ReF * — f-f 2MI = la + 2 (MF-ReFs).Черный Нелетучий оксофторид ReOF также известен.」 Коричнево-черный рекл $является основным продуктом взаимодействия рения и хлора при нагревании и может быть очищен вакуумной перегонкой.
С водой 4-валентность и половина валиума разлагаются и индуцируются. Напротив, в присутствии концентрированного HCl он, по-видимому, образуется. Из них и другие смеси. Также известны желтые двойные соединения состава ReOCla-2MCl(M-K, Ce или MH4).Производная частично разложившийся продукт ReCls воды-oxocloride ReOClj.
При нагревании ReCl $в смеси с KCl образуется желто-зеленый двойной солнечный ReCW•2KS1, который частично отсекает хлор. При взаимодействии KMnO с концентрированной HCl образуется темно-красная марганцевая соль аналогичного состава. Сине-зеленое Ребрирование было получено действием насыщенного парами Br2 азота на рений prn 650 ° С.
Если нет избытка брома, он имеет тенденцию распадаться на ReBr и Br2.Красный ReOBr4-CsBr был получен из неизолированного производного reobr>.Кристалл этого вещества содержит неоребр7, который имеет структуру четырехугольной пирамиды с «атомом Re около центра, атомом O на вершине и атомом 4 Br в основании HReO» = 1,72. РФ (ReBr)= 2.48 а).
Серо-голубой Re «05 образуется электрохимическим восстановлением Крео» 12 м в серной кислоте. Вода деградирует до ReO » n HRe04. Длительное нагревание при температуре 700 ° С с использованием смесей NaOH, RcOj и NaRe04 привело к образованию нитрита натрия, который, по-видимому, входит в состав NaReOj.
Эта бледно-желтая соль легко расщепляется водой и производными 4-и 7-валентных дождей. Cd2Re20r также был доступен. 41) технеций, TcF5 (температура плавления 50°C) и двойные фториды MF-TcF $(M-Cs-rNa), TcOS-2NH CI. In в водной среде пятикратные производные технеция диспропорционируют по схеме: 3tcva= 2TcIV + Tcvl *.
42) из пятивалентных производных марганца наиболее характерный для наиболее активных металлов (Ll, Na, K) Wawa NajMn04 некоторых солнечных элементов«MnO% (gnpomaigaiates) лучше всего получается при погружении смеси MnOj и NaOH (1: 3) в кислородную атмосферу при 800°C. безводная соль темно-зеленая, а кристаллический гидрат NaaMrl04•7H20-темный.
Mn04 не изменяется, и в растворе смесь происходит по следующей схеме: 2NaaMn04-f 2HjO * MnO2 4-Na2Mn04-f-4NaOH. As как видно из вышеизложенного, VI-валентные состояния с относительно небольшими количествами рения и технеция встречаются в Марганце еще реже.
43) из Шестивалентных Mn и re оксидов, новости только триоксид Рейна. Реакция Re2Or-f0202 + 2reo * получается при слабом нагревании ангидрида рения в атмосфере монооксида углерода. Нейтральная окраска, возникающая в этом случае, вероятно, обусловлена образованием нестабильных смешанных оксидов типа Re207-Re0s[т. е. Re02 (Re04) 2].
Триоксид дождя представляет собой красный (очень тонкий слой-зеленый) кристаллический порошок с металлическим блеском, который нерастворим в воде. H2S04 и разбавляют щелочью. При слабом нагревании на воздухе ReOa (mp 160 * C) не изменяется, а при сильном нагревании окисляется до Re20T.
При нагревании в вакууме выше 300°c происходят мутации по схеме 3ReO «= Re207 + ReO». Когда Na Re04 подвергается воздействию горячих растворов NaOH, происходит аналогичная дутамия (NaRe04 и ReO»).Азотная кислота окисляет ReOj до HRe04. Когда мы восстановили Re2S7 с помощью водорода, мы получили ReS3.
44) при техническом приготовлении миньета калия тонкоизмельченный пирозит смешивают с 50% — ным раствором Кон и окисляют кислородом воздуха prn 250 CC. Пиролиз K » Mn04 начинается с 500 Эк и более и протекает в основном по уравнению ZKaMn04 = 2KzMnO + Mn02-O (частично образуется) Продукты термической диссоциации KjMnO и MnO*).
Вы можете использовать этот процесс, чтобы получить K * MnO. Сине-зеленый Бамно «(ПР-* 2•10_, в) осторожно уменьшить щелочной раствор Кмно в присутствии солей бария и осадка». Для NajMnO< известны кристаллогидраты, содержащие 4,6 и 10 молекул воды. Имеются признаки стабильности свободного H2Mn04 в растворе эфира. Также сообщалось о взрывоопасных коричневых оксидах MnOaCl *
45) Образование зеленого рецикла (т. е. соли H2Re04) при легировании Re или ReOj щелочью в присутствии окислителя обычно осуществляется только как промежуточная стадия окисления, но конечным стабильным продуктом является красный цвет, содержащий соответствующую мезолитическую соль-H3ReOj.
Тем не менее, был получен щелочной металл Ренато, но наиболее интересными среди них являются соли лития-Li»ReOs» и Li | ReOe, которые получают из железистых ортоформ. С водой Ренат Na и K быстро разлагаются на Re (OH) 4 и перренат. Для более труднорастворимого BaRc04 тот же процесс будет несколько медленнее. Вплоть до соли HRcO, Ренато уже окисляется в растворе под воздействием атмосферных oxygen.
In в связи с этим более вероятно, что рсиаты характеризуются в основном свойствами, а не оксидом марганца (например, марганцем). 46) В дополнение к Реои и reiats. As для рения известны многие другие производные. Светло-желтый RCFA (mp 19, mp 35 ° С) образуется при 273°СНЗ элемента со значительным выделением тепла (125 ккал / моль).Его молекула имеет октаэдрическую структуру (rf (RcF)= 1.83 A. * (ReF) −4.8].
Oi — очень реактивное вещество(особенно оно разъедает стекло).Молярная растворимость RcF *в жидком фтористом водороде такая же, как и в норме. Условие 3.5: 100.It реагирует с водой по формуле 3ReF «+ 1211.0 = 2HRe04 + Re (OH) » + 4-18HF. Солеподобные соединения, полученные из него, известны для 2 типов: ReFj-MF (желтый) и RcFe. 2MF (розовый): что касается нагрева, то последний намного более стабилен, чем первый.
Синий ReOF4 был получен из шестивалентного фторида рения-оксо(mp 108, mp 172 X), и были выделены верные соединения типа RcOF4•MF(M — K, Rb, Cs).Бесцветный Реойф»(Мп. Наличие 156 СС) сомнительно. Также описаны нестабильный темиоелен RcCle (mp 22°C), красновато-коричневый ReOCl4(mp 29, mp 228°C), его желтые двойные соединения ReOCl4-2CsCl и синий твердый RcOBr4.
47) золотисто-коричневый Tcfa (mp.37, Мп.55°C), соответствующий оксо-фтор-лид TcOF4 (mp.134°C), неустойчивый темно-зеленый TcCU, розовый BaTc04, все известны своими technetium. In водная среда, 6-валентный технеций характеризуется неизменным по схеме 2TcO [- Tc07 + TcO {«. 48) теплота образования ангидрида 3 Joh из элементов равна 177 (Mn), 266 (Tc) и 296 (Re) ккал / моль соответственно. МК * 07(Мп.6°C) взрывной распад происходит уже при температуре около 90°C, но Tc20?
Если она превышает 260°С, то начинает разлагаться и может быть очищена сублимацией, но 362°с отдачи будет кипеть без разложения, а если она превысит 600°С, то станет заметной. Все 3 ангидриды очень hygroscopic. It разлагает медленно в MnO2 и кислород(включая примесь озона) под нормальным состоянием, но может быть дистиллирован без разлагать под уменьшенным давлением.
Когда влага полностью исчерпывается при температуре −10°C, oi остается в течение длительного времени. Безводный марганец обладает очень сильными окислительными свойствами. Поэтому он воспламеняется, когда эфир и спирт вступают в контакт. Окислительные свойства менее выражены в TcjO. Это еще меньше, если вы используете RcjOt (например, алкоголь окисляется им).
В случае кристаллов Tc20; молекулярная структура вероятна(03Tc0Tc03J. In в случае Кристалла Re2Or ионный Re0jRe07-твердый Tc2Og проводит намного больше тока, чем расплавленный ток, но является ли это RejO?- Обратное то же самое. Ион EO^представляет собой тетраэдр с атомом E в центре и расстоянием E-O, равным 1,63 A (Mn), 1,75 A(Tc) и 1,77 A(Re).
49) реле при образовании Rc2Ot из элементов содержат следовые количества воды, поэтому по мере их существования мы получаем белый туман HReO, который трудно уловить(ранее рассматривался re30 $оксид или другая форма RcjO). При охлаждении до −80°C ангидрид обесцвечивается, а при сильном нагревании он начинает darken.
In водород, он восстанавливается до ReOj при 300°C и до металла при 500 ° C. 50) Кмно «взаимодействует с холодной концентрированной серной кислотой по общей схеме 2КМ10 »+ 2хйсо «2хс04 + Мн207-Ф мджо случай, скорее образуется промежуточное звено Мнхсо».Аналогично, оксо-фторид(MnOjF) получают реакцией KMnO, — f-IFs = KF-f 10Fj + MnOjF, и темно-зеленой жидкостью (mp.-38°C), а выше 0°C уже есть unstable.
It является очень активным окислителем и быстро распадается на HF и HMP04. Молекула FMnOj полярна (n = 1.5) и имеет тетраэдрическую структуру с марганцем вблизи центра (</(Mnno) a = 1.59, rf (Mnf:) = 1.72 A).Аналогичный хлорид-MnOjCl-был получен при прохождении через сушку NS! Концентрированный CMPO, содержащий растворенный CMO, описывается как взрывчатый фиолетово-зеленый газ, который сжижается при температуре −30°C
51)в нормальных условиях раствор NMp04 выдерживает конденсацию только до содержания 20%.Затем начинается кислотное разложение (с образованием MnO2 и развитием кислорода). при низких температурах была получена свободная марганцевая кислота в виде кристаллогидрата НМпО » * 2hjo.
Причем в безводном состоянии. Темно-фиолетовые кристаллы гигроскопичности NMp04 быстро разлагаются за счет того, что кислород уже выделяется над СВС. Кристаллический гидрат стабилен при нормальной температуре в течение примерно 15 минут. Безводный Марганец является очень сильным окислителем, поэтому при контакте с ним воспламеняются почти все органические вещества (часто происходят взрывы).
52) в результате концентрирования раствора технетосевой кислоты оставшиеся красно-черные кристаллы ИТКО и синильной кислоты дают остаток RE60 при 160°с, шепча water. It следует отметить, что Re207 значительно улетучивается с водяным паром. На Tc207.
53) растворимость в воде KMnO при нормальных условиях составляет около 60 г / л (а перманганата Rb и C $-около 10 и 2 г / л соответственно). Пиролиз Кмно на самом деле более сложен, чем графически показано в тексте. При умеренном нагреве 5KMlO = KxMnO * 4-KaMn04 + Z. Он приблизительно представлен формулой MnO * + ZOa.
54) восстановление KMn04 протекает по-разному в зависимости от реакции среды, что видно из процесса окисления серы под, например, источником чистого калия Для кислой среды: 5K, SO,+2KMnO «+ 3H2S04 = „6K2S04 + 2MnSO“ +для нейтральной среды:3H20:3K2SOj + 2KMn04-fHaO = 3kas04-f2mno} + 2koh для щелочной среды: kjso, 2kmn04 + 2кон = k2s04 + 2KJMNN-H, 0k
Однако, согласно последнему уравнению, реакция протекает только при дефиците восстановителя и отсутствии концентрации щелочи, обеспечивающей достаточную задержку гидролиза KjMnO .Поскольку окислительные процессы чаще всего протекают в разбавленных растворах, то продуктом восстановления Кмн04 в щелочных и нейтральных средах обычно является Mn02.In щелочная среда, KMp04 должна быть восстановлена, чтобы она имела тенденцию восстанавливаться естественным образом по схеме.4KMn04+ 4KOH = 4KgMp04 + O „- + — 2H “ 0.
55) для промывки жира и других органических веществ в лабораторной стеклянной посуде удобно использовать щелочной раствор перманганата(после этого емкости промывают сильной соляной кислотой для удаления выделившихся стенок МНК). Насыщенный раствор KMn04, содержащий AgMnO, может быть использован для поглощения водорода, а Ca (MnO») j используется в реакционной технологии (в качестве катализатора разложения перекиси водорода).
Разбавленный (около 0,1%) раствор КМПО применяют в медицине для лечения полосканий горла, моющих средств, poisoning. In при незначительных ожогах рекомендуется немедленно смочить область ожога 4% раствором Кмп04-под его действием кожа высыхает Обычно образуются пузырьки. KMp04 хорошо растворим в ацетоне (2: 100).
Подобный перманганат КЦО » (температура плавления 540°с) оказался очень хорошим ингибитором коррозии железа и низкоуглеродистой стали (его защитный эффект проявляется уже при концентрации 5 * 10-5 моль / а, остающейся при 250°с). Ни KMn04, ни KRe04 не обладают таким защитным эффектом.
56) химические свойства марганца очень характерны для легко эволюционирующего взаимодействия KMn04 с двухвалентными солями марганца по реакции. Пример: 3MnSO + 2KMnO + + 2H} 0 = 5Mn02 + K * S04 + 2112SO <.Эта реакция сцепления, как правило, противоположна диспропорционированию Mn02 и KMp04 в K2m04.
57) перренат калия плавится при 555 ° C и кипит при 1370 ° C (по-видимому, без разложения).Структура молекул пары соответствует структурной формуле. Атом рения окружен почти тетраэдром с 3 атомами кислорода (d (ReO)= 1.75 AJ и группой OK [d(ReO)= 1.951, d {OK) «= — = 2.20 A. ZOReO » 95°, ZKORe = 105°).
Как видно из рисунка VI1-25, в целом соли перрения одновалентного металла (за исключением таллия) сходны по растворимости с соответствующими перхлоратами (рисунок VI1-5).Однако Аглот очень легко расплавить(27 моль! Л), бесцветное Агрко легко для того чтобы расплавить и расплавить(0.03 кол / л).Последнее также относится к черному AgMn04 (растворимость 0,04 моль / л), и обменное разложение других металлов с хлоридами удобно использовать для получения пермаганата. Соль NTs04>обычно бесцветна.
58) В дополнение к обычному перензимату известны некоторые из щелочных металлов и щелочноземельных металлов, желтые или оранжевые соли, которые получают из более обильных форм рениевой кислоты и богаты водой-HjReOs(мезопропас) и HsRe06 (Орто-препарат).Оба они сходны по составу с соответствующими солями йодистой кислоты (добавление§ 4.
54).Их обычно получают сухим способом (путем совместного нагревания раствора с оксидом или карбонатом), но Ba3 (ReOs) 2 в желтом цвете также получают испарением Ba (Re04) 2 и большим избытком Ba (OH) » (в отсутствие COj).При использовании воды все ортомезоперенаты легко разлагаются за счет образования обычных пелленатов. Некоторые подобные соли также известны в технеции.
59) кислород HRe04 может быть частично или полностью заменен серой с образованием различных тиокислот. До HReS4.Соли этих кислот в растворе нестабильны и постепенно разлагаются с выделением РЖС. Свободный тиокат сам по себе еще более нестабилен. Поэтому при действии сероводорода на кислый раствор пероксидов можно легко получить черный осадок Re2S. осаждение этого сульфида замедляется даже в 10 растворах.
По сравнению с HCI, это коричневый Tc2S? Он осаждается сероводородом только из слабокислых растворов. Оба сульфида в водной среде легко окисляются до кислоты NE04. При нагревании Re2S? (108 ккал! сера начинает шептать и постепенно превращается в ReS2. 60) наиболее интересным производным 7-валентного рения являются рсниогидриды, где наиболее известен K ^ RcHq(ранее его ошибочно принимали за KRcH4 «2H20, а также за KRe-4H
20).впервые он был получен восстановлением Крео металлическим калием в водно-этилендиаминовом растворе, белом кристаллическом веществе. Аналогичные натриевые соли синтезируются взаимодействием NiRe04 и Na в спиртовой среде (Na2ReH * разлагается в вакууме только при 245 * С). Известный Барчу.
Обменное разложение других металлов с сульфатами может привести к их регидратации. Ион ReHj имеет трехгранную структуру prima с атомом рения в центре, атомом 6H в основании и атомом 3H в центре поверхности. Все соединения Rell одинаковы, frf (ReH)= * 1.68 A, ZHReli * =94е).Рений (PRi) 2 и RcH5 (PR3) j с составом ReH. R-органический радикал. Yuyu ZO JO * * 0°С Фигура V! 1-
25.Растворимость некоторых солей перелена(моль H10). При регидрировании калий легко растворяется в воде, и когда рН среды высок, он медленно разлагается вместе с ней. Кислота Кирех, быстро разлагается(по схеме: ReH «- f-2Н* » 5Н, 4-f ReV как производное отрицательного водорода, является сильным восстановителем. Аналогичные по составу, структуре и свойствам, но менее стабильные соединения известны для технеция.
61) под действием фтора при 400°С под давлением до ReFe, светло-желтого RcFr(mp 48. тп.72°C) было получено. Нанофторированная молекула рения имеет слегка искаженную пятиугольную пирамидальную структуру С d (ReF)= L. 83A в плоскости кольца и перпендикулярным ему 1,84 A 3 оксо-фуридом-ReOF $(mp 41. bp 73 eC), Re02Fj (b 90, bp 185°C) и ReOjF(mp 147, mp.164°с).Желтый FRe03, полученный взаимодействием KReO <и IFS, изучается прежде всего.
Его Полярная молекула (z = 0,85) представляет собой тетраэдр, содержащий рений. center | 4 (ReO)* = 1.69, 4 (ReF)= 1.86 A). Re02F3 содержит множество 1-валентных и 2-валентных фторидсодержащих бинарных соединений металлов. Бесцветный Реойчи(Мп.5. КД.13GS) и ReOjBr (mp.40. КД.163vC) известно из производных других галогенов, подобных оксофториду. желтый Csj / Re03CI3 генерируется из первого NNX.) Как и в случае Фреоа, молекулы ClRcOa имеют тетраэдрическую структуру с рением вблизи центра[d(ReO)= 1.76,<(ReCl)= 2.23 A).
На основе этого хлорида (и NjOj) получают бледно-желтый нитрат ReOaNOa OXO в отсутствие влаги ниже 70°C, и все соединения рения-оксо легко разлагаются водой. 62) для технеция установлено присутствие оксогалидов Tc03C1 и Tc03F. Бесцветный TcOjCl был получен экстракцией хлороформом из смеси KTs04. H> 50 << 18 Af) и HCL (12 Af), за которыми следует испарение chclj. Желтый TcOjF(mp.18. т. температура кипения (100°С) была получена реакцией TcOa с фтором при 150°С, что лучше studied. It активно реагирует с кварцем и гидролизуется с водой до HtcO и HF. 63) производные пероксида марганца H
Смотрите также:
| Подгруппа брома | Сера |
| Окислительно-восстановительные реакции | Круговорот серы в природе |

