Оглавление:




























Подгруппа цинка
- Подгруппы цинка. Цинк и его аналоги значительно позже соответствующих элементов кальциевой подгруппы в связи с их распространением в природе. Содержание цинка в земной коре составляет −0,001% cad-mil-8-10- оценивается ртуть-6-I0-7. Все 3 элемента встречаются в основном в виде соединений серы 3s типа. Наиболее важными рудами цинка и ртути являются минеральный сфалерит (ZnS) и песок(HgS).
- Подобный природный сульфид кадмия-минерал туриноцит (CdS) — сам по себе чрезвычайно опасен. rare. In напротив, небольшие количества компакт-дисков почти всегда содержатся в sphalerite. Цинковые минералы очень распространены наряду со свинцом и серебром. Большинство таких полиметаллических (содержащих несколько металлов) руд также содержат кадмий. Процесс получения цинковых элементов из руд осуществляется в 2 этапа.
In кроме последней, важной цинковой рудой является минерал смитонит (ZnC03). Людмила Фирмаль
Сначала сульфиды превращаются в оксиды путем сжигания на воздухе, а затем восстанавливаются углем. 2ZnS-f 302 = 2S02 4-2ZnO + 212 kcalZnO-С4-88 ккал =СО-F Zn Пар металла, образованный вторичной реакцией, уносится током CO и конденсируется в конденсаторе. Но некоторые из них еще больше уносятся, после чего оседают в виде мелкого порошка (так называемая цинковая пыль) — ® В дополнение к восстановлению оксида цинка углем, электролиз часто используется для отделения металлов от it.
In в этом случае руду ZnO, полученную окислительным прокаливанием, обрабатывают серной кислотой. Полученный раствор ZnSO4 также действует как электролит, из которого осаждается цинк. Из-за нестабильности HgO при высоких температурах производство металлической ртути сводится к одной реакции. HgS-f Oj-SOi-f Hg + 42 ккал Выделяющийся пар ртути улавливается в специальном приемнике, где он разжижается.
В свободном состоянии элементами подгруппы цинка являются белые металлы с голубоватым оттенком (Zn) или серебро (Cd, Hg) hue. In влажный воздух, покрытый оксидной пленкой, теряет свой блеск. 3 Все металлы (особенно ртуть) являются легкоплавкими и довольно летучими. Наиболее важные константы для них сравниваются ниже.
Компакт-Диск ЗН НД 7.1 дюймов 7 13.6 Температура Плавления,°C. 。 420321-39 Температура кипения, ° С. 。 。 。 913 770 357 Проводящий телевизор (Hg 1)• » 16 13 1 В отличие от пластичного и пластичного кадмия, цинк очень хрупок в нормальных условиях. Цинк и ртуть были широко использованы в течение длительного времени, но кадмий был использован в промышленности относительно недавно. 3. все элементы легко образуют сплавы друг с другом и со многими другими металлами.
Среди них особое место занимают ртутные сплавы (амальгамы), которые часто бывают жидкими или пастообразными. Циик и кадмий образуют только ряд соединений, соответствующих двухвалентным elements. In кроме того, производное характеризуется производным, которое является электрохимически одновалентным. Этот тип соединения описан в конце статьи. paragraph. In в отличие от малотоксичных производных НИАКА, растворимые соединения кадмия и ртути очень токсичны.
В серии напряжений ik находится на левой стороне железа, кадмий-на правой стороне немного, а Ртуть-на дальней правой стороне водорода. Несмотря на то, что Zn и Cd более металлические. Кроме водорода, поверхность металла сразу же покрывается защитной оксидной пленкой, поэтому он практически не заменяет ее на water. In разбавленный HC1 и H2S04, цинк растворяется легко, кадмий растворяется медленно, а Ртуть нерастворима. Азотная кислота легко растворяет все 3 металла.
Например, реакция с ртутью протекает по следующему уравнению 3hg хиллингдон + 8HNO3 = 3hg хиллингдон(с бортовым номером 03) й-ф 2НО-f4H20 отличается от аналогового, цинка по схеме Zn-f 2NaOH = 1 NaaZnOj-f Ha Он также растворим в сильных щелочных растворах. 8 этаж-44 При контакте с сухим воздухом Zn, Cd и Hg не изменяются при нормальной температуре. При достаточном нагревании Zn и Cd сгорают до оксида EO, но ртуть окисляется медленно.
Взаимодействие серы с Zn и Cd также очень активно, но для начала реакции необходимо нагревание. Напротив, на морозе ртуть соединяется с мелкодисперсной серой (если оба элемента стерты в ступке).Существуют аналогичные различия в отношении галогенов, и в нормальных условиях ртуть реагирует легче, чем Zn или Cd. Такое увеличение химической активности ртути обусловлено агрегатным состоянием жидкости, что значительно облегчает протекание реакции.
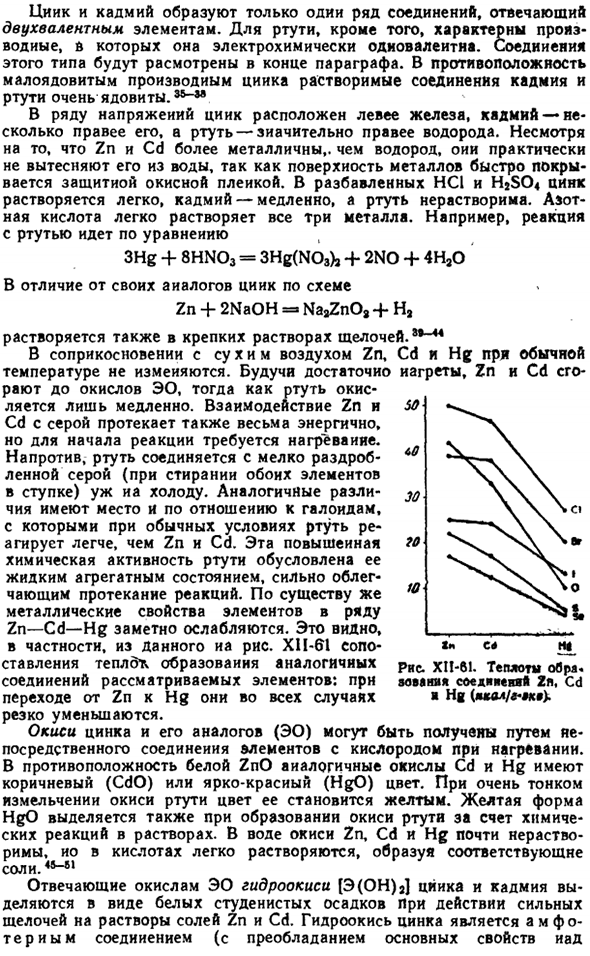
По существу, металлические свойства элементов серии Zn-Cd-Hg значительно ослаблены. Особенно это видно из данных рисунка. X1i-61 сравнение тепловыделения аналогичных соединений рассматриваемых элементов: при переходе от Zn к Hg они резко снижаются во всех случаях. Оксид цинка и его аналог (ЭО) получают путем непосредственного соединения элемента с кислородом, когда heated.
In в отличие от Белого ZnO, аналогичные оксиды Cd и Hg являются коричневыми (CdO) или ярко-красными (HgO).Из-за очень тонкого измельчения оксида ртути его цвет меняется на желтый. Желтая форма HgO также высвобождается при образовании оксида ртути в результате химических реакций в окружающей среде. solution. In оксиды воды, Zn, Cd и Hg почти нерастворимы, но легко растворимы в кислотах, образуя соответствующие соли 45-81 Гидроксид [E (OH) 2] цезия и кадмия, соответствующий оксиду EO, выделяется в виде белого студенистого осадка под действием сильной щелочи против растворов солей Zn и Cd.
Гидроксид цинка является аморфным соединением(преобладают основные свойства ИАД) Пятьдесят Тридцать 70. Десять Один » SHO К Ки Привет. Диаграмма XII-61.Соединение 2p, CD Zoe-образное тепло ■ Hg {lcal / g-zkvUОн растворяется в избытке сильно щелочной и образует цинкет (например, Na2Zn02). в гидроксиде кадмия четко выражены только основные свойства. Оба гидроксида легко растворяются в кислотах.
Подобный гидроксид ртути [Hg (OH) 2] разрезает воду уже в момент ее образования. Поэтому под действием сильной щелочи против ртутных солей, например по реакции 2NaOH + Hg (N03) 2 = 2NaN03 + HgO | + H20 Выделяется желтый оксид ртути. Выше щелочь практически нерастворима и легко образует соли с кислотами. Как и сами катионы Zn2+, Cd2* и Hg2, большинство солей nx бесцветны.
Нитраты и сульфаты цинка и его аналогов очень хорошо растворимы в воде. В серии Zn-Cd-Hg растворимость фторида значительно возрастает, но растворимость других галогенидов(и большинства других солей) уменьшается. Производные слабо неорганических кислот(H2COj, H2S, и т. д.) обычно слабо растворимы в воде. Очень разбавленный раствор HgCl2 (хлористая ртуть или хлористая ртуть) является одним из наиболее часто используемых дезинфицирующих средств.
Некоторые соли Cd2 +и Hg2 +(и частично Zn2+) в растворе гораздо менее диссоциированы, чем нормальный MX2 types. In в частности, это относится к Галогенидам Cd и Hg (за исключением фторида), которые снижают степень диссоциации ряда CI-Br-I. Цианид ртути[Hg (CN) 2], обладающий очень малым током в растворе, особенно слабо dissociated. In напротив, нитраты и сульфаты Cd2 +и Hg2 +диссоциируют нормально. Обычно соли Zn и их аналоги гидролизуются в воде. solution.
In напротив, слабо диссоциированные производные Cd и Hg слабо гидролизуются. Некоторые соли Zn, Cd и Hg легко образуют комплексные соединения, но типы M [ECC]и M2 [EC4]predominate. An примером может служить растворимый в калии иодид ртути-KJHglJ. 6, −121 В отличие от Zn и Cd, производные ртути, как известно, являются электрохимически активными. monovalent. In дело в том, что все такие производные содержат атом-HgJ -, оба атома ртути в нем двухвалентны, но 1 из каждой валентности тратится на синтез с другой валентностью по схеме: — Hg-Hg -.
Эта группа не разрушается при электролитической диссоциации, поэтому раствор содержит комплекс ионов Hg2. Вещество, содержащее группу-Hg2-называется соединением оксида ртути. Обычным исходным материалом для получения остальных производных этого типа является легкорастворимый в воде HG HG[Hg2 (N03) 2], образующийся при взаимодействии HNO3 с избытком ртути. 6 HG + 8HNO3 = 3Hg2 (N03) 2 + 2NO + 4H20 Ионы HgJ * бесцветны. Большая часть соли, получаемой из него, слабо растворима в воде.
Почти все, что хорошо растворяется, не диссоциирует и значительно гидролизуется. При достаточном разбавлении их раствора происходит осаждение основных солей (чаще всего желтого цвета). для предотвращения этого раствор Hg2 (N03) 2 обычно подкисляют азотной кислотой. Наиболее практически важным является водонерастворимый хлорид ртути (Hg2Cl2), известный как «карамель».Свойства взаимного расположения атомов в Кристалле видны из диаграммы. Л. с.-62.125-137
Под действием окислителя соединение оксида ртути легко переходит в производное оксида, например: Hg2Cl2-t-Cl2 = 2HgCl2 В растворе такое окисление протекает постепенно под воздействием атмосферного кислорода[для его предотвращения в раствор Hg2 (N’03) 2, подкисленный азотной кислотой, обычно добавляют небольшое количество металлической ртути].
Напротив, восстановители, например, легко превращают соединения оксида ртути в нитритные производные по реакции 2HgCl2 + S02 + 2H20 = H2S04-f Hg2Cl2 2HCI При избытке восстановителей процесс часто протекает с выделением металлической ртути, и — » 0 Если сравнить Zn, Cd и Hg с бериллием и магнием, которые являются основными элементами 2 — й группы, то можно восстановить, что некоторые свойства ряда Be-Hg изменяются очень естественно. Примерами являются температуры плавления и кипения элементов, которые постепенно уменьшаются при переходе от Be к Hg.
Однако аналогичная закономерность в изменении характеристик серии Be-Ra еще больше characteristic. In в этом ряду, например, атомный и ионный радиусы увеличиваются строго непрерывно, основные свойства гидроксида явно увеличиваются, растворимость в воде увеличивается, термическая стабильность физиологического раствора увеличивается. В целом, оба сравнения показывают, что с точки зрения закономерности изменения свойств элементов Be и Mg сами по себе могут быть включены в качестве первых членов обеих подгрупп, и что подгруппы кальция показывают только с точки зрения свойств соединений.
Добавь Из элементов рассматриваемой подгруппы Меркурий («серебряная вода», по Аристотелю), редко встречающийся в исконном состоянии, известен человечеству с незапамятных времен. Поэтому он был найден в гробнице в Египте, построенной в 1500 году до нашей эры. e. производство ртути из природных HgS описано в трудах ко Хуна (i§ 1 add.4).Есть признаки того, что ее лекарство использовалось в Китае еще в 3000 году до нашей эры для лечения проказы.
Е. ртуть была особенно важна для алхимиков, которые считали ее носителем металлических свойств и незаменимым компонентом всех металлов. Знакомство с Европейским цинком датируется концом Средневековья-он впервые упоминается в работах Парацельса. А рибавий называет его «восьмым металлом«(ср. В Китае цинк был известен гораздо раньше (рис. XI1-63).Кадмий был открыт в 1817 году.
Имеются монографии по кадмию и ртути. 2) естественный цинк, массовое число 64(48.9%)、66(27.8)、67(4.1)、68(18.6)、70(0.6)он состоит из изотопа: кадмий— 106(1.2% ) 108(0.9)、110(12.4)。 111(12.7)、112(24.1)。 Из(12.3). 114(28.8). 116(7.6); Меркурий-196(0.2%)、198(10.0)。 199(16.9)、200(23.1)、201(13.2)、202(29.8)、204(6.8)。 Не о 0 oci Рисунок XI1-62.Карамельная решетка. * Чижиков Д. М.. Кммна. Эд. 2-й. М..«Наука» 1 ″ 7 2-12 секунд. Мельников С., Меркурий М. М. Металл.^ Ргиздат *. 1951.360 секунд 3) в основном состоянии атомы Zn, Cd и Hg (n — 4, 5 и 6 соответственно) имеют структуру внешней электронной оболочки нулевой валентности type.
As как видно из рисунка XII-64, возбуждение до бивалентного состояния требует несравненных энергетических затрат, чем в случае атома щелочноземельного металла Ил 。 4С 6р 4 секунды SS 6С 7р 6С 7С 5 секунд, 6 секунд. * 6р Диаграмма XII-63.Добыча цинка в других » ВМ » и Kip. It-это хорошее место для начала. HP-64.Энергетический уровень мов ЗН. От Cd до Hg (ккал [*атом). (ср. РНС. хп-50).Непрерывная энергетическая ионизация элементов цинковой подгруппы показана ниже):
Компакт-Диск ЗН НД Я 9.39 8.99 10.43 Второй 17.96 16.90 18.76 4) Цник-это 1 из биологически очень интересных элементов. Обычно растение содержит Zn в количестве около 10-4%, но у некоторых видов его содержание значительно увеличивается. Именно поэтому подорожник содержит 0,02% цинка, а Violet-0.05%.It оказывается, для нормального роста и плодоношения растения необходимо небольшое его количество. Для животных, то же самое было доказано в экспериментах на мышах.
Цинк также вносит значительный вклад в развитие различных плесневых грибков и грибов (особенно дрожжей).в золе некоторых видов раковин содержится до 12% этого элемента. В организме человека содержится более 0,001% цинка, и он особенно богат зубами (0,02%), поджелудочной железой, гипофизом и половыми железами. Видимо, это относится и к коже.
С другой стороны, имеются признаки снижения содержания инков в крови онкологических больных(их предполагалось использовать при ранней диагностике).Суточная потребность человека в цинке составляет около 15 мг, полностью покрытых обычным food. At в то же время сообщалось об ускоренном заживлении ран, когда пациент принимал небольшое количество ZnSO. An интересное наблюдение было сделано в рыбе>оказалось, что к тому времени, как цинк был отложен из тканей мужского тела, он мигрировал в молоко.
Однако чрезмерное содержание пруда в воде, очевидно, приведет к неправильному развитию Яйца. б) содержание кадмия в организме значительно ниже, чем цинка, а ртути-значительно меньше. Для людей вес составляет около 10 «4 (Cd) или I0» 4(Hg).%Оба элемента в основном сосредоточены в печени и почках. Их биологическая роль не ясна. 6) Схема печи, используемой для выплавки цинка, показана на рисунке XII-65.
Смесь кальцинированной руды и пылевидного угля загружают в шамотовую реторту А. нагревают до 1200°С Эугеном окружающего газового пространства Топливо. Жидкий металл собирается в конденсатор B, соединенный с ретортой(температура реторты поддерживается на уровне около 450°C).Цинковая пыль-воздух с внешним охлаждением Оловянная форсунка B цинк очищается от примесей (Pb и Fe), обычно присутствующих в сырьевых продуктах, путем переплава или дистилляции при минимально возможной температуре.
7) цинковая пыль обычно содержит 80-90% Zn, 15-5 ZnO. Около 0.4 Znjnjj. Различные количества примесей Cd, Pb, Fe, а в некоторых случаях as, Sb. КР и сио».Смогите быть использовано немедленно как разбавитель mainly. It следует отметить, что если он вступает в контакт с влагой (особенно содержащей кислоты или щелочи), то может вызвать самовозгорание. Потушите горящий цинковый порошок сухим песком.
8) электролиз может быть разделен только при достаточно больших перенапряжениях водорода (V§ 8, 14). фактически электролиз осуществляется из сернокислотного раствора ZnS04, содержащего алюминиевые катоды и свинцовые аноды при высокой плотности тока (500-600 а / мг).Потребляемая мощность составляет около 3100 кВт * ч / т. производство цинка во всем мире распределяется примерно поровну между пирометаллургией (то есть с использованием высокой температуры) и электролитическим методом.
9) содержание кадмия в цинковой руде обычно не превышает 0,1%. me-700 700°C во время пирометаллургического процесса, цинк (rns. Должный к своей высокой улетучиваемости сравненной к (XI1-66), эта высота аккумулирует главным образом в пыли цинка. Рис. НР давления * для выхода er0, растворить ее(или другие содержащие □HjSQ * \ arov кадмий и цинк кадмиевые отходы от переработки полиметаллических руд в mmHg. ET g r yj ’ И они работают на решении с металлом ченчай.
Также、 Реакция компакт » — Ф ЗН = «ЗН» -Ф-CD кадмий выделяется в виде губчатой массы. Затем его очищают электролизом или перегонкой металла. 10) реакции окисления HGs, описанные в тексте, являются Интенсивно проходит при 200°С и 300-400 X. Рисунок XI1-67. Производство ртути в 16 веке. Их концентрат) производится в специальных печах с гораздо более высокой температурой.
На рисунке XI1-67 показана установка, использовавшаяся для получения ртути в 16 веке(согласно Книге Бириджуччо). как видно из рисунка X11-68 практически ничем не отличается от оборудования, служившего той же цели в Древнем Китае. Проводится очистка ртути Диаграмма XII-65.Схема * цник плавильной печи*. 300. Рисунок XI1-68.Производство ртути в Древнем Китае.
Его можно приготовить различными способами (принудительная, химическая обработка замши, вакуумная перегонка). 11) для очистки ртути в лабораторных условиях часто используется простое устройство, показанное на рисунке 1. XI1-60.Загрязненную ртуть заливают в бумажный фильтр, расположенный в воронке A. At в нижней части воронки делается тонкое отверстие с помощью иглы.
Через нее очень маленькие капли ртути попадают в длинную трубку В. 5%включая Hgj (NOj) HO. Для бумажной пленки После этого из ртути удаляют пыль и тому подобное. Проходя через раствор, например, по схеме Cu-f-HgjfNOjh » ^ = Cu (NOjh-f2Hg освобождается от всех металлов на левой стороне столба напряжений. Очищенную ртуть собирают в колбу В. ртуть можно перерабатывать несколько раз, как описано выше. Когда требуется дополнительная очистка (при освобождении ртути от примесей Ag и Au), ртуть перегоняют в вакууме. Очень чистая ртуть получается электролизом раствора хлорной кислоты HgO.
12) обратите внимание, что даже при повторной перегонке ртуть не освобождается от следовых количеств золота. Это было открыто в 20-х годах нашего столетия, когда внезапно возродилась старая алхимическая проблема получения золота из ртути. Рисунок XI1-69.Лаборатория-2 ученых почти одновременно(немецкий клещ, Нагаока ратория устаро (Япония)) с очень длинным электричеством для чистки Разряд ртути в парах ртути и на стенке реакционной трубы
По результатам анализа образуется небольшое черное покрытие, состоящее из мелкодисперсного металлического золота. С большой осторожностью (по данным того времени) такой же результат был получен в результате повторных опытов с очищенной ртутью. Наконец, оказалось, что золото не появляется только в том случае, если реакционный сосуд заполнен ртутью. Ртуть была выброшена в предыдущих экспериментах в течение длительного времени.
13) кристаллическая структура элементов цинковой подгруппы существенно отличается от наиболее плотной упаковки шариков. Существует предположение, что это связано с возросшей ролью ковалентных связей. Твердость цинка и кадмия составляет 2,5 и 2 соответственно (в основании 10).Что касается сжимаемости, то она близка к магнию, тогда как сжимаемость ртути ниже, чем у бериллия.
Электрическое сопротивление всех 3-х элементов уменьшается с увеличением давления, но это происходит плавно с Zn и Cd, и происходит скачок порядка 33,5 тыс. Ат. Электронные функции работы от поверхности металла 3.4 (Zn), 3.9 (Cd), и 4.5 cv(Hg). 14) температура плавления элементов цинковой подгруппы возрастает на 2 млн Ат с увеличением давления и равна 506°с(Zn), 440(Cd) и-f65(Hg).Теплота плавления и теплота сублимации (25°С) равны (ккал / г атом), соответственно: 1.76 n 31.1 (Zn), 1.45 и 26.8(Cd), 0.55 и 14.7 (Hg). в парах все 3 элемента в основном состоят только из атомов, но содержание молекулы E2 невелико (отношение Zn2 / Zn меньше 2-10-4).
Для их энергии диссоциации даны следующие значения (Луч! Кротов): 7 (ЗН). 3 (компакт) н 2 (НД). 15) при нагревании до 150°C цинк становится очень податливым и пластичным. Оппозиционный. Более 200°С-он очень хрупкий, поэтому его легко можно измельчить и припудрить. Изменение таких свойств, очевидно, связано с изменением нормального цинка на другой аллотроп более 200°C, но этот вопрос не ясен.
Мировое производство цинка в 1800 году составляло 1 тыс. тонн в год, но в 1900-48 млн тонн, а сейчас это около 300 млн тонн (без учета Советского Союза). 18) большая часть добываемого цинкового металла используется для изготовления сплавов с различными другими металлами и для цинкования железа (то есть покрытия тонким слоем цинка) для предотвращения ржавчины.
Тончайшая базовая пленка, образующаяся на поверхности цинка в атмосферных условиях Примерный состав карбонатов (nZnCOj-3 zn (OH) 2 H20, n = 1 или 2) защищает металл от дальнейшего окисления. Поэтому изделия из оцинкованного железа (кровельные, водосточные трубы, ведра и др.) может длиться относительно долго. Большое значение имеет расход цинка для изготовления различных типов гальванических элементов (например, см. IX§ 1 дополнение 38). 17) палочка из чистого кадмия будет гнуться и трескаться (подобно олову).
Этот металл расходуется в основном (с помощью электролиза) для нанесения защитного покрытия на железо и железные изделия. Такое кадмиевое покрытие превосходит цинкование и никелирование по антикоррозионной эффективности (однако оно не принято в изделиях для пищевой промышленности). 18) значительное использование кадмия связано с производством так называемых щелочных аккумуляторов. Кадмий также является распространенным компонентом легкоплавких сплавов, его можно вводить в металлические композиции для печатных форм, а ртутьсодержащие сплавы (25% Cd) используют для пломбирования зубов.
Легирование 1%Ni является высококачественным материалом для наполнения подшипников. — Кадмий используется в производстве электрических проводов, так как небольшое количество смеси Cd и меди значительно увеличивает прочность меди, не значительно уменьшая ее проводимость. В 1900 году было добыто всего 13 г кадмия, и сейчас ежегодный мировой выпуск составляет около 1 млн тонн(без учета Советского Союза). 19) твердая Ртуть имеет уникальную координационную структуру, число которой равно 12.А в жидком состоянии среднее число конфигураций уменьшается до 8.
Температура очень чистой ртути падает медленно, потому что она охлаждается до температуры на 20 градусов ниже нормальной температуры замерзания. Маленькие кусочки твердой ртути, соприкасаясь друг с другом, склеиваются почти так же легко, как их жидкость падает. Поверхностное натяжение ртути примерно в 6,5 раз больше, чем у воды, а ее сжимаемость примерно в 11,5 раз меньше. Ртуть подобна воде(VI§ 3 доб.10).Начальная теплоемкость-от точки плавления до 80°С-последовательно уменьшается, а затем начинает увеличиваться.
20) давление паров ртути при различных температурах показано ниже. Температура,°С……….. 0 10 20 30 40 50 60 80100 Давление пара, мм рт ст……. 0,0002 0,0005 0,001 0,003 г 0,013 0,025 0,09 0,77 Температура°C………. 200 300 350 400 450 UI 550 600 850 Давление пара, давление………. 0.023 0.325 0.885 2.08 4.28 8.04 13.9 22.8 34.7 Его критическая температура составляет 1490°C, а критическое давление-1510 бар. 21) растворимость ртути в воде(25°С) составляет от 3 до 10 ′ моль / л. гидрозоли ртути, полученные различными способами (например, путем восстановления Hg (N03) j гидразином), нестабильны.
В зависимости от размера частиц, он может быть синим или коричневым. Интересно, что ртуть слабо растворяется в расплавленном белом фосфоре (около 0,3 г).При охлаждении прозрачного раствора он выделяется в химически неизмененном состоянии. Даже в присутствии следовых количеств озона ртуть теряет подвижность и прилипает тонкой пленкой к содержащему ее контейнеру. 22) ежегодное мировое производство ртути составляет около 6 тыс. г(за исключением СССР).она применяется во многих разнообразных областях.
Крупнейшими потребителями являются предприятия электротехнической промышленности, которые в основном используют ртуть для изготовления выпрямителей переменного тока и кварцевых ламп. 23) В простейшем(и наиболее распространенном) варианте ртутный выпрямитель представляет собой сосуд под вакуумом с 2 электродами.1 из них-ртуть. Такие устройства имеют неполярную проводимость (III§ 2 дополнение 11) в направлении от ртути к электроду.
- Очень высокая мощность переменного тока может быть выпрямлена и надежна в эксплуатации. Ртутная коммутация является основным промышленным методом преобразования переменного тока в постоянный. 24) ртутно-кварцевая лампа («Горное Солнце»), широко применяемая в медицине, в плане восстановления энергии гораздо полезнее обычной. Лампочка. Суммарная светоотдача последних составляет всего около 10% от потребляемого тока, но около 70% идет на инфракрасное излучение, а около 20% — на прямое тепло. С ртутной лампой ситуация иная! Видимый свет (сине-зеленый) используется примерно в 25% текущего энергопотребления, а большая часть оставшейся энергии расходуется на возбуждение ультрафиолетового излучения.
25) медицинское применение кварцевых ламп основано главным образом на арнамическом и бактерицидном эффекте их излучения. как vdio НЗ рис. В случае ИФ-10 оба свойства близко лежат к свойствам ультрафиолета, но диапазон длин волн незначителен different. It следует отметить, что солнечная радиация с наиболее бактерицидной длиной волны менее 2900 а не достигает Земли, так как она поглощается озоновым слоем атмосферы(II§ 4 доп. 3).
26) спектральный состав сильно отличается от солнечного, поэтому свет одной только ртутной лампы не очень подходит для освещения. Людмила Фирмаль
Но эту разницу можно устранить с помощью правильно подобранного флуоресцентного вещества, которое под действием ультрафиолетовых лучей дает видимый свет, в котором спектральный состав добавляется к свету самой ртутной лампы. Флуоресцентный слой, нанесенный на его внутреннюю поверхность, может состоять из вольфрамата кальция, содержащего, например, небольшую смесь соединений Самария(характеризующуюся сильной Красной флуоресценцией).
Результат-это источник Белый свет гораздо экономичнее обычного света bulbs. It особенно очевидно, что такие люминесцентные лампы имеют большое значение для народного хозяйства, учитывая, что более 10% всей вырабатываемой электроэнергии используется для освещения. 27) объем не столь важен, но очень важное применение ртути связано с получением высокого вакуума(I добавлено II§ I. 13).Обычно этой цели служит стеклянный или металлический ртутный вакуумный насос.
XI1-70.By нагревая ртуть в нижней части сосуда до кипения, создается непрерывный поток пара, через тонкую трубку, через трубу а очень быстро поступает во внешнее пространство, которое охлаждается водой, подсоединенной к перекачиваемой емкости. , Эти молекулы находятся под воздействием более грубого насоса («быстрый кумий»), который дает всей системе предварительное разрежение порядка 0,1-0,01 мм рт. ст.
Сам пар ртути конденсируется в охлаждающем пространстве m, и жидкая ртуть возвращается в нагретый сосуд. Установка может работать непрерывно и создавать вакуум до 100000000 мин. 1 миллиметр ртутного столба. 28) ртуть довольно ограничена в своем использовании в качестве теплоносителя (рабочего вещества) в паровых установках. Сочетание такой установки с обычной паровой обработкой значительно повышает эффективность.
29) некоторые металлы(Au. Ag, СН и др.) легко плавится с ртутью, в то время как другие металлы (например, Cu) плавятся в мелкодисперсном состоянии или только когда heated. It часто бывает полезно производить амальгамы электролитически, выделяя соответствующий металл с ртутным катодом. Наконец, существует множество металлов (Ti, Zr, Nb, Ta, Mo, W, Re и др.) которые практически не сливаются с ртутью.
Метод извлечения этих металлов из окружающих их пород основан на хорошем смачивании Au и Ag ртутью. Некоторые амальгамы легко размягчаются при нагревании, но становятся твердыми при температуре человеческого тела (37°C).Используется для пломбирования зубов. Наиболее распространенный состав сплава(мас.%): 52 Рт. Ст., 33 АГ. 12.5 ЗП 2 кр, 0.5 ЗН ее важным преимуществом является небольшое расширение при отверждении. Рке. XII-70.Простая заковыристая схема. Разрушение зуба.
Амальгама таллия (8.56 Ат.%T1) используется при изготовлении низкотемпературных термометров. Амальгама очень широко используется в электротехнике и др. Есть монография по амальгаме. 30) амальгама похожа на другие сплавы благодаря своим химическим свойствам. Растворимость металла в ртути относится к максимальному содержанию жидкой амальгамы (или жидкой фазы, если она пастообразная).
Некоторые данные о растворимости металлов в ртути в нормальных условиях можно найти в нуйе(мас.% ) Сравнивается с: Тл компакт-диска ЗН РВ СН Ба мг е ал ю СБ пр 43 5.3 2.1 1.3 0.62 0.33 0.24 0.02 0.02 0.02 5-I0 — * 2-10 — ’ 4./ 0-Т Иногда (например, в системе Cd — Hg) растворение не сопровождается образованием соединений между растворимыми металлами и ртутью, но в большинстве случаев такие соединения образуются.
Например, максимальное содержание калия в жидкой фазе системы K-Hg составляет 0,8 Мас.% (то есть примерно 1: 25 по числу атомов), а соединения между обоими элементами известны следующим образом: KHg * K> Hg * KHg * KHga. ХПГ. Их температура плавления (за исключением Хг2-при разложении) одинакова, соответственно: 70. 173. 204. 279-178 С.
31) было установлено, что образование ХГ сопровождается достаточно эффектным выделением тепла (12 ккал / моль) и значительным уменьшением объема системы (25%).Аналогичный эффект наблюдается при взаимодействии ртути с другими наиболее активными металлами. Это может быть связано с появлением равновесия, обусловленного схемой E + Hg * * E * + Hg и частичным образованием соединений различной природы.
32) общая закономерность, связанная со структурой внешней d-электронной оболочки атома, была очерчена растворимостью металла в ртути. Если эти оболочки полностью свободны(в рядах аналогов 1 и 2), то металл бурно взаимодействует с ртутью и образует compound. In при наличии частично заполненной J-оболочки (ряды 3-10) металл слабо растворяется в ртути или практически не плавится. Наконец, когда на полке имеется заполненная d-оболочка (колонка 11-15), растворимость металла снова возрастает, но нет выраженной тенденции к образованию соединений с Mercury.
As количество периодов, в которых расположены элементы, увеличивается, растворимость металла в ртути обычно увеличивается. 33) металл, содержащийся в амальгаме, существенно не меняет своего химического состава properties. So, когда амальгама натрия вступает в контакт с водой, выделяется водород и образуется NaOH. То есть, реакция протекает таким же образом. Как и в случае металлического натрия. Но это гораздо спокойнее.
На этом основано применение амальгамы натрия в качестве восстановителя. Его полный переход l сравнивает температуру жидкого состояния со следующей. На содержание. Вес.%…… 0.5 1.0 1.5 2j0 2.5 3.0 Температура перехода. С….. 0 60100130196230320 34) взаимодействие амальгамы натрия с крепким раствором соли аммония сопровождается замещением натрия Нью-Хэмпшир Нью-Хэмпшир-Нью-Хэмпшир радикалов.
Последняя из Амальгам гораздо более стабильна, чем свободное состояние. А затем разложить на NH. Водород относительно медленный. Условно приобретают состав амальгамы, соответствующий Формуле MHg. Образование и разложение амальгамы аммония может быть выражено следующей формулой: NaHg + NH X X-NaX + NH4Hg и 2NH H Hg-2NH,+ H,+ + 3 HG.
Соединения состава 1N (CH3) 4] Hg±1, подобные амальгаме аммония, получали электролитически. Целоаскна М. Т.. Зебрева А. И.. Гладышев В. П. амальгамы и их применение. Алма-ата. «Наум» Кай. ССР. 1971.392 секунд 35) токсичность соединений цинка относительно невелика, но при приеме внутрь 1 г растворимой соли вызывает тяжелое отравление.
Симптомы острого отравления цинком-металлический привкус во рту, слюнотечение, тошнота и постоянная рвота. Молоко рекомендуется в качестве первой помощи. По другим данным, необходимо отыграться на том, что сами соединения цинка токсичны, а их токсическое действие обусловлено содержащимися в них примесями (As, Cd и др.).
36) токсичность кадмия очень высока, и тяжелое отравление уже было вызвано 100-1g соединения. В случае острого отравления (от вдыхания или изо рта) инкубационный период часто несколько дольше. Начальными симптомами отравления являются сухость слизистых оболочек, сладкий вкус во рту, головная боль (лоб), головокружение, эпигастрия pain. As рекомендуется первая помощь, свежий воздух. Полностью успокоившись, пейте теплое молоко с содовой.
Типичными начальными симптомами хронического отравления небольшим количеством кадмия являются снижение обоняния (вплоть до его полного исчезновения) и золотистое окрашивание десен в области шейки матки («кадмиевая граница»).Существует предположение, что накопление кадмия в почках может быть основной причиной гипертонии. Выведение кадмия из организма(через почки и кишечник) происходит очень медленно.
37) при остром отравлении ртутными солями деятельность кишечника быстро прерывается(часто сопровождается рвотой), губы опухают, возникает сильное воспаление десен, постепенно снижается деятельность сердца(снижение частоты сердечных сокращений, резкое падение температуры тела, обмороки). в качестве противоядия для оказания первой помощи применяют рвотные препараты(если нет лекарства, щекочут небо), затем глаза и яичный белок.
Ртуть в основном выводится из организма почками. Хроническая интоксикация (отрасль, связанная с переработкой ртути или ее соединений) протекает по-разному, так как препараты ртути хорошо усваиваются поверхностью всех органов (включая неповрежденную кожу).Обычно он в основном поражает слизистую оболочку полости рта. Характерной особенностью является металлический привкус во рту, рыхлость десен, интенсивное слюноотделение.
После этого на деснах образуются язвы, выпадают зубы, поражаются пищеварительный тракт и нервная система. Если поступление ядов в организм происходит очень медленно, то все описанные выше признаки интоксикации могут исчезнуть, и на первый план выходит эффект повреждения нервной системы: легкая возбудимость, небольшие толчки в определенных частях тела, потеря памяти.
Предельно допустимое содержание ртути в атмосфере промышленных предприятий составляет 0,00001 мг / л. для обнаружения можно использовать фильтровальную бумагу, покрытую слоем cul. Белый цвет может стать желтым, оранжевым или красным из-за действия паров ртути. 38) достаточно выраженное давление паров ртути(0,001 мм рт. Искусство.
При нормальных условиях), существует риск хронического отравления во всех помещениях, где Hg постоянно контактирует с воздухом. Опасность особенно остра, если множество мелких капелек ртути забиваются в различные щели, где давление пара еще больше и вся поверхность испарения очень высока. Поэтому ртуть, случайно пролитую в помещение, следует собирать самым тщательным образом way.
To для извлечения мелких капель воды, застрявших в зазоре, удобно использовать расплавленные медные пластинки или листья стайнола, которые достаточно увлажнены ртутью. После полного удаления его необходимо покрыть все места, которые еще могут остаться с серой или алюминиевой пылью. Существует профессиональное руководство по ртутной технологии*. П. п. технология использования ртути в лабораторных условиях. М.. Госхимнсдат. * Мопс 1961.142 секунды.
39) e * r + 2e-e сравним обычный потенциал элементов подгруппы cnn, соответствующий переходу по схеме (o): Компакт-Диск ЗН НД Кислая среда…….. — 0,76-0,4 е +0,85 Щелочная среда……. −1.22 −0.81 +0.10 Радиус ионов E2 * составляет 0,83 соответственно. 1.03 и 1.12 А. Для энергий гидратации zn1 и Cd1 значения составляют 496 и 439 ккал! Г-Ион. Для не-Hg2* тенденция к гидратации очень мала (встречаются кристаллогидраты, характерные для ртутных солей).Имеется обзорная статья*об электрохимических свойствах ртути.
40) установлено Рентгеноструктурными исследованиями различных растворов ZnBrj. Их координационный номер Zn2 *равен 4.Поэтому тетраэдрические Нони (ZnfOHah) побеждают в разбавленных водных растворах, в концентрированных водных растворах молекул (ZnBrj (ОНа) A), в молекулах (znbrj (ch3cocha) J] ацетона и в присутствии избытка ионов 1znbr в HBR) 」 41) в то же время он легко растворяется в разбавленных кислотах, подобно обычному цинку на рынке, который содержит смесь других элементов (в основном активных металлов и меньше As) (рисунок XII-71).
Химически чистый цинк взаимодействует очень медленно. Это связано с тем, что водород, выделяющийся в первый момент на поверхности чистого цинка, покрытого тонкой пленкой, изолирует его от жидкости. Напротив, если цинк содержит примеси менее активных металлов, то в них точно выделяется водород(V§ 8 add.2), часть поверхности, занятая самим цинком, не защищена. 42) вредное влияние примесей на устойчивость цинка к кислотам устраняется сплавлением его поверхности, в результате чего цинк снова становится однородным.
Подобно химически чистому металлу, амальгамированная цинковая пластина, погруженная в кислоту, не растворяется до тех пор, пока не соприкоснется с пластиной из менее активного металла, находящегося в том же состоянии. liquid. So, гальваническая батарея с амальгамированным цинковым электродом будет работать только тогда, когда 2 полюса находятся в контакте(через цепь, в которой используется работа батареи), а остальное время цинк не расходуется.
Напротив, неамальгамированные электроды, изготовленные из промышленного цинка, корродируются кислотой n в течение инертного периода элемента. Гальванический элемент с сульфатной средой, отрицательным электродом из NS-амальгамированного цинка и положительным электродом из диоксида свинца может генерировать ЭДС 2,5 вольт*.
43) В отличие от алюминия, цинк растворяется не только с сильными щелочами, но и с аммиаком. Химические свойства растворения в обоих случаях выражаются формулой Zn + 2HOH = Ha + Zn(OH) a, затем Zn(OH),+ OH ’=(Zn(OH).)’или Zn (OH)» + 4. 4NHj =(Zn (NH3)»] (OH) a. суть процесса заключается в удалении защитной пленки с металла (в последних 2 реакциях 1 по одной).
Сильный раствор соли аммония связан с частичным гидролизом. Это связано с тем, что в жидкости всегда присутствует небольшое количество NH $и свободной кислоты, которая снимает защитную пленку. 44) из-за взаимодействия с щелочью в вышеуказанных реакциях цинк в высокощелочной среде является очень активным восстановителем.
Например, нитраты восстанавливаются до аммиака в следующих условиях: NaNOj + 4 znn + 3 NaOH +6НаО = 4na [ZN (Oh)$) — f NH * Рисунок XII-7I. влияние примесей на скорость растворения Zn в серной кислоте * Сперанская Е. Ф. и Похвалитова Т. Г. успехи химии, 1968, Nt 9, 1658. 7 Б, В. Некрасов 45) оксид цинка и его аналоги обычно получают прямым синтезом из элементов. Теплота их образования составляет (ккал / моль): 83 (ZnO), 62(CdO) и 22 (HgO).Пары цинка горят до сине-зеленого цвета, а пары кадмия горят в красном пламени.
Ртуть окисляется при длительном нагревании до 300-350°С на воздухе. Кристаллы ZnO и CdO имеют ионную природу (ядерные расстояния 1,95 и 2,35 а соответственно), а кристаллы HgO-ковалентные связи (они состоят из цепи типа a-Hg-O-Hg-O с ядерным расстоянием 2,02 а). 46) все 3 окиси более или менее растворяются и испаряются по схеме 2EO * * 2E + Oj еще до достижения температуры плавления. В серии ZnO〜CdO — HgO летучесть возрастает, а термическая диссоциация усиливается.
Давление паров над оксидом цинка становится заметным примерно при 1300°с, превышая CdO-около 900, а HgO разлагается на элементы уже более 400 (энергия активации разложения составляет 57 ккол / моль).Давление пара достигает около 1720°С на оксиде цинка и около 1570 ° с на оксиде кадмия (кроме того, в паре мало молекул CdO).При повышении давления кислорода ZnO плавится при температуре 1969 ° C. растворимость ZnO, CdO и HgO составляет 1, 2, b и 50 мг соответственно на литр hjo.
47) оксид цинка уже упоминался в трудах доноса корнда и Принни(I add.9).Это на самом деле самое важное сочетание этого элемента, которое особенно широко используется в производстве резины, минеральных красок и керамики. Но во многих других областях он также потребляется: в качестве катализатора для синтеза лекарственных средств (порошков и мазей), косметических средств (порошков), метилового спирта (по формуле CO + 2Hj-CHjOH) и так далее.
48) нагрев оксида цинка выше 500 ° C сопровождается пожелтением, а при охлаждении белый цвет медленно recovers. It показано, что кристаллы ZnO, нагретые парами цинка, содержат дополнительный атом Zn (от 3 до 6-10 «на эл) в пустотах структуры. Поскольку исходный Кристалл в 1 см3 содержит 4-10 атомов цинка и кислорода. 49) процесс окисления ртути с получением HgO описан в книге неизвестного арабского алхимика «шаг мудреца», относящейся примерно к 1020 году.
Я поставила чашку в кастрюлю и поставила ее на очень слабый огонь, чтобы можно было дотронуться до кастрюли рукой. Я нагревал его все 4 дня и ночи и открыл кастрюлю. Я обнаружил, что ртуть (весом от 4 до 1 фунта) превращается в красный порошок с точно таким же весом и становится мягкой на ощупь. В настоящее время красный оксид ртути обычно получают нагреванием Hg (NOa) до 360-400°С, а желтый-воздействием на раствор этой соли щелочью. Обе формы имеют одинаковую кристаллическую структуру, разница между ними обусловлена только размером частиц, и если она желтого цвета, то это smaller.
In в связи с этим растворимость желтых форм несколько выше, чем красных (0,05 г / л) (0,08 г / л).Красный HgO становится черным при нагревании(до разложения), а при охлаждении он быстро возвращается к своему первоначальному цвету. Красный HgO добавляется в подводную часть судна и служит исходным материалом для многих других соединений ртути, а желтый HgO используется для медицинских применений(глазные и кожные мази).
50) относительно недавно гальванические элементы на основе оксида ртути были применены на практике. Отрицательный электрод прессован цинковым порошком, положительный электрод прессован HgO (добавлением графита), а электролит представляет собой диафрагму из бумаги, пропитанной KOH. Эксплуатация элементов осуществляется по схемам ЗН-ЗН — + 2е и 2е-НД «НД» (или ZN + зон ’-*-►ЗН (О) Джей + 2е и 2е-Ф ХГО + ю — * — ХГ + 20Н’).Его электродвижущая сила составляет 1,35 В, а среднее выходное напряжение-1,2 В. Этот тип элемента, размером с таблетку лекарства, можно использовать для питания небольшого оборудования, но он легко собирается в мощный аккумулятор.
61) пероксидные производные цинка и его аналогов гораздо менее характерны, чем пероксидные производные элементов подгруппы кальция. Соединение 2Zn0a H, 0( Потенциальная структура HOOZnOZnOOH получена непрерывной обработкой Zn (OH) f безводной перекисью водорода. Это вещество представляет собой белый порошок, который сокращает 220 bC кислорода. Кремовый CdOj получают действием 30% HNO на раствор Cd (N09) t (содержащий большой избыток NH»OH), 0, и при нагревании он взрывается примерно при 200 ° C. взаимодействие между желтой ртутью и 20% раствором н 30* prn-15°С дает нестабильный оранжевый Hg02.
При нагревании или выдувании он взорвется. Практическое применение (в косметологии и фармацевтике) находит только оксид цинка. Свои безрецептурные образования типично содержат около 50% из ZnO *по весу. 52) в процессе нейтрализации кислотного солевого раствора осаждение гидроксида цинка начинается приблизительно при рН■ = 6,0, гидроксида кадмия-приблизительно при рН-6,7, а оксида ртути-приблизительно при рН = ■ 7,3.Чистый Zn (OH) j получают путем воздействия аммиачного раствора оксида цинка на воздух.
Стоимость продукта растворимость (25°С) 3•!(>- **I-10 в активной форме, t в неактивной форме. Для Cd (OH) t аналогичный интервал равен 2•10 «14-4 ~ 10«».Гидроксид цинка теряет воду примерно при 250 ° C. Но при очень высоких температурах он снова становится стабильным. То есть он ведет себя как гидроксид бериллия(§ 1 add.28). Гидроксид кадмия обезвоживается примерно при 200°C, и в случае ртути равновесие HgO + H20 ** Hg (OH) s уже смешивается слева при нормальных условиях (/Hg(OH).) / IHgO] l 0,01).
Из-за присутствия гидроксида ртути это может быть невозможно. Ее растворимость в продукте явно находится в порядке 10-1*.Для 2-й константы диссоциации гидроксида (по схеме Zon * ** 3 «+ OH’) указаны значения 4-10» «(Zn), 5-10» «5 (Cd) и 5-10 »«» (Hg). 53) как станнит, алюминат и др. цинкат в водном растворе сильно гидролизуется и может существовать только с избытком щелочи. При непрерывной постоянной кислотной диссоциации гидроксида цинка по схеме HaZnOf H’ — f — + HZnOj и HZnO ^ H ’+ ZnO «были получены значения/ Ci = 3» 10-lt и Kt = 2-I0 «1’.
Но образование канавы в растворе связано не с замещением водорода Zn (OH) 2 металлом, а с присоединением ионов OH к молекулам гидроксида. В зависимости от постоянной диссоциации фокуса Иона Zn (OH) 4 (Схема Zn (OH)^ Zn «+40Н’), сформированной таким образом, задается значение/С» = 7-10〜| in. Некоторые из этих ледяных кислотных солей, например Na [Zn (OH) sl, Na2 [Zn (OH)], Ba2 [Zn (OH)i], в твердом состоянии разделены Кристаллом Na [Zn (OH) j), Анон Zn (OH)〜это структура треугольной плоскости d (ZnO)= 1,98[d (ZnO)] «2,65 a«два «разных»
Иона, разделенных » двумя «разными» ионами. вы можете использовать его для того, чтобы: гораздо больше цитратов было получено за счет слияния ZnO с оксидами других металлов. Примером может служить бесцветный BaZn02.Сухое цинкато, как правило, практически нерастворимо в воде. 84) компакт-диск (ах) функция f кислоты очень слабо выражена, и похожие кадмий цинк получается только при кипячении суспензии компакт-диск (ах) в концентрированной щелочи в течение длительного времени.
В виде бесцветных кристаллов, Najcdfohhl и М2 [компакт-диск (ах) е]были изолированы. Вот это М-3Р или Ба. Для полной константы диссоциации Иона Cd (OH) » дано значение A = 2-10 -.e. некоторые кадмии также были нечеткими на пути сушки. Желтый Бакдо служит примером.」 55) несмотря на нехарактерную «кислотную функцию Hg (OH) 2», была получена скорость Merr типа MiHgOs (M-щелочной металл).Это бесцветные, кристаллические вещества, которые очень чувствительны к влаге.
58) В дополнение к сильной щелочи. Zn (OH) 2 растворим в растворе аммиака. Cd (OH) 2 работает как well. In в обоих случаях растворение происходит за счет комплексообразования со схемой 3 — + x NHS = [3 (NHs) x] -.Здесь количество х зависит от концентрации аммиака. Вы можете использовать x = 4 в качестве наиболее распространенного значения. Константы стабильности для аммиака Zn и Cd, рассчитанные в этом предположении, составляют 3-I0-10 и 8-10 — * соответственно. [Для места Co силы соединения Zn-N Иона Zn (NH3)4P, значение f s » a 1.9.
67) Амид 3 (NH2) 2 известен цинком и кадмием. Они могут быть получены путем взаимодействия амальгамы цинка или Cd (SCN) i с раствором KNHj в жидком аммиаке. Оба Амида представляют собой аморфный белый порошок (соли кадмия быстро темнеют на воздухе) и практически нерастворимы в жидком аммиаке. При разложении с водой он становится E(OH)* n NH3 (кроме того, реакция с амидами кадмия очень интенсивна).При умеренном нагревании аммиак отделяет NH3 и переходит в соответствующий нитрид 33Nj. Оба Амида могут связывать KNHj с образованием комплексов типа KNH (3 (NHj) 4). он отлично кристаллизуется и почти не растворяется в жидком аммиаке.
58) в отношении своих соединений, связанных с аммиаком, ртуть существенно отличается от цинка и кадмия. Сложные продукты аддукта NH3 не характерны для не-Hg1 * n и образуются только в присутствии избыточно сильного раствора аммония salts. In в частности, он был получен в этих условиях. (Hg (NH3)4lSO4 иHg(NH3) 4 j. наиболее известным из соединений этого типа является (Hg (NH3) j) Clj («плавкий белый осадок»), который образуется в виде белого кристаллического осадка.
Раствор Hgclj с сильным избытком раствора nh4c (на NHOH OH).Аммиак прочно удерживается в этом соединении(его давление достигает 239 атмосфер только при 1 ° C).Интересно, что молекулы 2 NH3 удерживаются ионами Hg * * и не сильнее, чем другие 2 n в растворе сложного аммиака. 59) образование водородзамещенных продуктов в NH3 гораздо более характерно для Hg8*, что легко происходит из-за влияния NH4OH на различные соединения ртути. Таким образом, в растворе HgClj по реакции HgClj-f 2NH3 = NH4Cl + NHjHgCl осаждается белое осаждение соединения NHjHgCl. Это вещество представляет собой «непритязательный белый осадок» и используется в лекарственных средствах (мази, порошки) и в косметике (некоторые кремы).Постоянная мощности подключенного Hg-N равна 2,3.
Была установлена аналогичная структура тяжелого сульфата-HjNHgS03H-биполярного Иона (X§ 2 add.100): H, NHgSO. 60) среди других продуктов взаимодействия производных Hg3 *с аммиаком для ртути очень характерны соли различных желтых оснований, соответствующие формуле HgjNOH-2HjO. Свободное основание получают обработкой желтого оксида ртути аммиаком. Кристаллы образованы трехмерной структурой групп HgjN1, в которой каждый атом азота тетраэдрически связан с 4 атомами Hg.
Каждый из атомов ртути линейно связывается с 2 n атомами[d(NHg) * «2.07 A], а анионы OH’ молекулы HjO расположены в пустотах структуры. Слегка растворим соль HgjNXnHjO (X представляет собой моновалентную Анон, удобный исходный продукт для приготовления других производных этого типа (путем обмена разложение) — это желтовато нитрата образуется в результате реакции:2 НД(с бортовым номером 03) В J-4nh40h = 3NH4N03 + (HgjN) с бортовым номером 03 f4hjo.
Среди различных солей катионного Hg N коричневый йод является наиболее распространенным well-known. It представляет собой чистый осадок, образованный взаимодействием аммиака (аммонийной соли аммония) и щелочного раствора Kj (HgI4), формула: NH3 + 2KjIHgI4)+ЗКОН-HGJNI + 7KI — f3hjo. Эта реакция используется для обнаружения аммиака. 61) Галоидные соли Zn1, Cd8 *и Hg8 * являются бесцветными (за исключением красного Hgl}) кристаллическими веществами. Сравните численные данные, которые характеризуют их в таблице ниже (молярная растворимость на 1 л HsO в нормальных условиях). Молекула ЭГ (пара) представляет собой линейную структуру.
Характеристики муфты*константы длины и силы также включены в таблицу. 2стр, СБГ с hgr по、 Ф сі ВГ и Ф ИЦ ИЦ ч я Теплота образования, ккал ’ моль. 。 М 99 78 50 467 93 75 48 95 55 41 25 Температура плавления. °С. 。 。 。 875326394446 1078 564568388645277277238257 27 21 14 0.3 7 4 2.5 гидролиз 650 0.3 0.017 0.0001 Температура кипения. С…… 150E 722 656 624 1750 980 847 741 304 319 354 D (например) пара. И………. 1.81 2.05 2.21 2.38 1.97 2.21 2.37 2.55 2.29 2.41 2.59 k (например> …………… 2.7 2.3 1.8 1.9 1.6 2.7 2.3 1.8 В дополнение к молекулам мономера EG2, их dnmer по-видимому также содержит пары.
62) из особенностей отдельных солей следует отметить, прежде всего, чрезвычайно высокую растворимость (рис. XII-72) и крайнюю гигроскопичность галогенидов цинка, которые быстро распространяются в воздухе (за исключением малорастворимого фторида, для которого характерен кристаллогидрат ZnFa-4HjO). в отличие от других галогенированных ртутных соединений, HgF2 имеет ионную решетку капперного типа[rF (HgF) = 2,40 A1], а кристаллогидрат HgFj-2HjO является known.
In раствор, он подвергается интенсивному гидролизу. Электролитическая диссоциация HgCI2 протекает почти исключительно по схеме HgCl2 ** ClHg ’-+ SG (частичное связывание C1 ′ с «комплексами» hgclj и HgCl) и происходит лишь в небольшой степени(около 0,1% от общего числа растворенных молекул HgClj).Благодаря этому его гидролиз также становится меньше (хотя в растворе все еще присутствует реакция Норена).
63) хлорированная ртуть является проводником с плохой электропроводностью не только в растворе, но и в расплавленном состоянии (электропроводность составляет около 20% 1 от расплава NaCl). Электропроводность расплавов HgClj и других галогенидов ртути, очевидно, обусловлена незначительной диссоциацией при Rice> xiI-72.Растворимость схемы выглядит следующим образом: 2Hgrt^ HBH + Hgrj(для HgBr стекло является «dov zinc * {МОЛ, ЛHJOK, ДИССОЦИАЦИОННОЕ окрашивание 2-10»*).
64) расплавленный hgbr2 растворяет много неорганических и органических веществ well. As растворитель, его общие характеристики сходны с водой и служат средой для химических процессов, в том числе «реакции нейтрализации» (см. IX§ 2 доп. 5).Например, по схеме: 2KVg («основание»)+ Hg (Cl04> s («кислота»)= 2KS104(соль) — f HgBr2 (растворитель).Аналогичные реакции были также изучены в расплавленном HgCl2.Критическая температура HgBr2 составляет 738SS.
66) интересны данные о распределении бромидов щелочных металлов между HgBr2 и расплавом Линоя, которые фактически несмешиваются. Экспериментальные условия (температура 254 ° С, концентрация МВГ 0,66 mol. It оказалось, что коэффициент распределения изменяется на порядок 0,065 (Na), 0,98 (K), под знаком»%» (% ). 2.54 (РБ). 7.10 (ВС).Увеличение перехода в слой HgBr2 с увеличением радиуса катиона, по-видимому, связано с увеличением стабильности комплекса MHgBr. 66) при температуре выше 131°с Красный иодид серебра становится неустойчивым к желтому в нормальных условиях (теплота перехода составляет 0,64 ккалиола).
Желтый Hgl2, который получается при быстром разбавлении спиртового раствора йодида серебра водой, несколько stable. In в отличие от аналогично окрашенной формы ртутного окна (дополнительно 49), изменение цвета здесь связано с перестройкой кристаллической структуры. При нагревании Hgl2 сублимируется в виде легко бесцветного пара. При быстром охлаждении под пониженным давлением, по-видимому, получается 3-я (белая) форма ртути ртуть (легко краснеет).
67) сравните 2-ю константу диссоциации рассматриваемых галогенидов в водном растворе со следующей: ZnF-ZnCl * ZnBr-Zn! ’CdF * CdCl * CdBr * Cdf HgCt * Hggbr!-0.1 1.5 4.0 20 2.I0 «1 5.10» * 2-l0 — * 5. | 0 ″ S6-10 — ®9.JO 10 1-Ю_, Е Как видно из представленных данных, при переходе от цинка к ртути они изменяются не только количественно, но и качественно (если количество галогенов различно).
68) очень высокая прочность связи Hg-1 обусловлена способностью ртути вытеснять водород из раствора HI (см. VII§ 5, 15). Еще одним результатом прочности связи Hg — G является растворимость ртути в растворе галогенида щелочи. Когда выделяется нужное количество щелочи (степень небольшая, но одинаковая для CdO). так, если мы перемешиваем HgO в нормальном растворе кг, выход KOH составляет (% ): 0,24 (C1), 6,4(Br), 76(I).
Наконец, сложность анализа может быть 3-м результатом. Например, добавление NaCl в AgNOj решение. Включение Hg (NO») i в то же время может привести к образованию осадков AgCl. То есть серебро останется нераспечатанным. 69) галогениды рассматриваемого элемента (за исключением фторида) несколько растворимы в органических растворителях. Например.
Насыщенный раствор ZnBr*, насыщенный при 25°C 100 г, содержит эту соль 69 е. из нее можно выделить 2 достаточно стабильных эфира. ZnBr * * 2 (CiH) fO (менее+ 4°C) и ZnBr2•(canbo (менее-f-16°C). В целом растворимость галогенида кадмия значительно ниже, а в серии CI-Br-I растворимость быстро возрастает. Следующие данные доступны для наиболее растворимого Cdlt (г на 100 (г растворителя в нормальных условиях): CHjOHC2H5OH(СЭН9)ЗОСН»СООСН»С»Н» 154 74 0.14 25 0.05 В отличие от галогенидов ртути, растворимость серии CI-Br-I снижается.
Например, в ацетоне растворимость составляет 25 при 100 г в растворе 55°C (HgCU), 34 (HgBrs) и 3 (Hgl -) G. In в диоксановом растворе галогенидов ртути обнаружен дипольный момент 1,43 (CI), 1,53 (Vg), 1,6 1,67 (1), в бензольном растворе-1,23(01)и 0,95 (Vg). Поскольку сама молекула Hgr * неполярна, это прямо указывает на наличие взаимодействия с растворителем.
70) комплексообразование с соответствующими Галогенидными солями других металлов не встречается в Zn, Cd, Hg фториде(известны в основном производные цинка, такие как KZnF и BaZnF).Напротив, для них характерны хлориды, бромиды и nods. In кроме того, возрастает тенденция к комплексообразованию Cd и Hg в серии CI-Br-I и в обратном порядке Zn-I. В результате комплексной соли соответствует общей формуле из М | EG8]м [[[например]].Здесь M-одновалентный металл.
Практическое значение имеет, кроме бледно-желтого Kjhhgj•2HiO, Ba (Hg (]) * 5NgO: этот водный раствор солей красноватого цвета имеет плотность до 3,5 г / см *и используется для разделения минералов отдельными свободными кислотами H [HgIj]•4HtO. Hj (HgCI «]•ЗН20 получали в виде кристаллогидрата. Общие константы и стабильность композитных ионов [Cdr»] и[Hgr » J » сравниваются ниже. CdCl «CdBr» Cdl «’J HgCl »» gBr » Hgl » 9-МЕ — ’ 2-10 ’4 8.10 -я |.| 0 «w MO * * * 11 MO» * 0 Для констант диссоциации по схеме MCdClJ: — * M * ’ + CdCl «(4 M LiClO»раствор) найдено значение: 2.0 (Na), 0.8(K).0.6 (РБ), 0.4(КС).
Связывание ряда Na-Cs, по-видимому, обусловлено уменьшением энергии гидратации того же ряда катионов(V§ 8 add.21). 71) из производных с более высоким координационным числом наиболее интересным является желтый комплекс Agjhgre].Увеличение координационного числа пятичленных атомов сопровождается увеличением длины связи E-G.
Например. [ZnCU]rf (ZnCI)* «составляет 2 ^ 5 A (относительно 2,05 A ZnClj).[РФ (ХГФ) * в HgUP составляет 2,78(2.59 в Hglt).[Cdcu rf(CdCI)] 4 ′ равно 2.53 (2.21 в CdClj). 72) некоторые CD соли(некоторые Zn и некоторые HG) характеризуется образованием автокомплекса (по схеме, например, 3cddl2 ** компакт-диск [Cdf3} J), что существенно снижает концентрацию ионов компакт-диска.
Общая концентрация хмеля CdTj равна 0,01 м Осуществляется следующее распределение кадмия в его индивидуальной форме и в виде (% ). Компакт-диск » ЦДР-с <jr3 icdr и Р [Cdr4 |» С1 41.0 96.0 3.9 0.05 0.30 ″ Ч 3?.8 00.5 6.5 0.(6 0.097 Я 23.1 66.5 6.9 0.45 0.02 73) ZnCU и HgClj нашли самые разнообразные и обширные практические применения Галогенида цинка и его аналогов. Хлориды используются в трафаретной печати в таких отраслях промышленности, как органические красители. )
Является основой обычных стоматологических cement. It также может использоваться в качестве наконечника (объем не изменяется при затвердевании).Из многих оксо-хлоридов цинка состав, соответствующий 4ZnO•ZnCU-6H20, изучен лучше других. Хлорированное серебро используется в качестве консерванта и используется в различных других областях. Когда свет HB хранится в контакте с воздухом, он постепенно разлагается по следующей формуле: 4HgClt + 2HjO = QHgjCU +4НС1 + ОА.
Плавиковая кислота используется при фторировании брома, который является органическим соединением, в качестве катализатора для некоторого синтеза. Йодистое серебро часто вводят в мази, предназначенные для лечения кожных заболеваний. — 74) сильный раствор Галогенида цинка вызывает четкую кислотную реакцию за счет образования сложных кислот, таких как H [Zntoh] и Hj-nrt (OH) i] с water.
It основан, в частности, на освобождении поверхности от оксида, используя соляную кислоту (то есть по существу концентрированный раствор zncu), которая»травится»цинком при пайке металла. Это, например, FeO + HJZnrifOHh) — FelZnr, (OH) j)+ HtO согласно схеме, осуществляется в результате реакции, и поверхность самого металла не затрагивается. После этого, когда швы нагреются, корова испарится, а металл покроется расплавленной солью, которая защитит металл от загрязнения, получив таким образом хороший контакт с припоем.
75) концентрированный раствор хлорида цинка растворяет волокна. Это является основой для его использования в производстве пергамента. До широкого распространения бумаги в Европе свою роль играла пергаментная бумага, изготовленная из кожи молодых животных(телятины, баранины). Изобретателем бумаги считается Цай Лунь (105 г. н. э.). В 8 веке технология его изготовления была освоена арабами, а затем перенесена от арабов в Европу.
Первые Европейские бумажные фабрики были основаны в 1189 году, но затем долгое время в основном использовался пергамент. В настоящее время такой пергаментный пергамент используется только для барабанов, которые подходят почти вплотную. Напротив, растительный пергамент очень широко используется(например, в упаковке посуды) — бумага характеризуется прозрачностью, непроницаемостью для воздуха, высокой механической прочностью и стойкостью к воздействию воды, разбавленных кислот и alkalis.
To производят растительный пергамент, антипригарную бумагу кратковременно обрабатывают концентрированным раствором хлорида цинка (или сильной серной кислоты), который частично разлагает поверхностные волокна клеток, заполняя их продуктами порового разложения. После этого последний тщательно промывают водой и обрабатывают раствором глицерина(для придания пергаменту мягкости и мягкости).
76) самым простым способом растительную и пергаментную бумагу получают путем опускания фильтровальной бумаги на 8-10 секунд в холодную смесь концентрированной серной кислоты и воды (4: 1 по объему, заливают кислоту в холодную воду или наоборот).После удаления бумаги немедленно тщательно промойте ее (водой, слабым раствором аммиака и снова водой)и высушите.
77) бесцветная комплексная соль KJHgl»], легко растворимая в воде, входит в состав иодистого ртутного электрода и может использоваться в сочетании с водородом (см. V§ 8, 3).Для его изготовления, насыщенный KS! Раствор выливают на слой ртути и содержит 4,2 г ki и 1,3 г hglj в 100 мл. для аяход:; ^ В процессе работы с такими электродами ртуть переходит в раствор с образованием Ка [HgI»], а в катоде вместе с выделением металлической ртути высвобождаются комплексные ионы.
Если поверхность последнего достаточно велика, то электроды практически не поляризуются. Его потенциал для нормального водорода составляет+0,02 дюйма. 78) одновременное присутствие в растворе 2 галогенидов с низким содержанием ртути вызывает частичное обменное взаимодействие между ними, в результате чего образуется смешанная соль.
Поэтому, используя ультрафиолетовую спектроскопию, в растворе 0,001 м NSS»Hgr константа равновесия реакции по схеме+ Hgr; 2HgIT равна 14 (ClBr). 22 (SP) и 12 (Brl). 79) 2HgCIj•HgO (бесцветный), HgCb-2HgO (черный), HgCla-3HgO (желтый)-известно большое количество оксо-ртутного хлорида со специфическим составом. HgCI} — 4HgO (красный или черный).Все они получаются путем растворения HgO в кипящем растворе HgClj и последующей кристаллизации.
Первый из них является наиболее изученным, структура которого соответствует формуле[0 (HgCI) 3] CI и характеризуется почти плоскими катионами [0 (HgCI) 3J \3 параметров: d(OHg) = 2,05,d(HgCi)= 2 30A, ZHgOHg = 119°,ZOHgCI = 176″.таким образом, это оксоновое соединение, содержащее 3-валентность кислорода(VI§ 3 add. П).Известны и другие производные радикалов HgCI. Например, P (HgCl) 3 n C& (HgCl) E. последний является продуктом замены на HgCI всего циклопентадиенового водорода(x§ 2 add.34).
80) цинк и его аналоги цианид Холи, химические свойства которых сходны с Гундо[3 (CNb).Все они образуются за счет взаимодействия ионов Е в растворе. Осаждается в виде CN ’(без избытка) и jfg2 Zn (0,005 г / л) и Cd (17 г / л), который является умеренно растворимым цианидом PreCip-y-Hg-С-N белый осадок. Цианид цинка характеризуется высокой термической стабильностью 1,998 / м (он разлагается только при температуре около 800°с). w ^ wO2 ^^бесцветные кристаллы голубой ртути довольно хороши K-C растворим в воде (100 г / л в нормальных условиях).
Они являются Он состоит из бесконечной цепи Рисунок XI1-73.Участок сооружения Хрустальный тур. Молекулы соединены друг с другом долгим электричеством Связывание N-Hg(рис. XI1-73).Это приводит к некоторому отклонению валентного угла атомов ртути от 180°.Для ковалентной связи силы валентной связи приведены значения(HgC)= 2.7 и k(CN)= 17.3. 81) с цианидными солями многих других металлов цианиды Zn, Cd и Hg образуют комплексные соединения, преимущественно растворенные в воде, соответствующие формулам Mj | 3 (CN)4]и M (3 (CN) 3].
Смешанная комплексная соль типа M ’ JHgfCNhX], X представляет собой одновалентный Анон. Общая константа диссоциации ионов[3 (CN) «1»、2×10 * 7( Zn), 5-l0〜, f (Cd) n 4 1041 (Hg).Из ионной силы константы (НД (СN)»]—к (КГЧ) −1.9 н к(СМ)= 17, 0-первый пункт очень важен, и 2-ой один в НД (СN) J в молекуле. Появляются номера (HgfCN)»] и (НД(СN) е) » в концентрированных растворах цианистого калия. То есть число координат Меркурия увеличивается до 6. 82) Ioi [Zn (CN)4] * — в виде тетраэдра с атомом цинка в центре (rf (ZnC)=2.02,</(CN)= 1.16 AJ.
An интересный результат был получен при исследовании структуры K-Кристалла. (Zn (CN) 3l-2 ^ HjO. It оказывается, атомы цинка в нем не эквивалентны. N-я половина окружена октаэдром с углеродной связью, а другая половина настроена тетраэдром с азотной связью.) Твердое состояние рассматриваемого комплекса более точно сформулировано как KjZnlZn (CN) e] 5HjO.
Однако в химической реакции все атомы цинка равны, раствор содержит Ноны (ZnJCN)^. в результате химические свойства вещества правильно представлены формулой K [Zn (CN) 3)L * * 2,5 NgO. 83) электролитическая диссоциация Hg (CN) a незначительна, поэтому последняя образуется даже при минимальной концентрации CN ions. An интересным результатом этого, в частности, является реакция, используемая для измерения объема синильной кислоты по формуле 2HCN-f HgClj = Hg(CN)j +2НС1.
Это полный разворот обычного хода обменной реакции (V§ 6): слабые кислоты сильны salts. It также участвует в растворяющем действии солей Hg1 * и многих нерастворимых в воде цианидов (таких как AgCN).в то же время сероводород осаждает ртуть из раствора цианида. При нагревании выше 320°C Hg (CN) a разлагается на ртуть и цианид. .84) разбавленный (0,01-0,02%) раствор цианида ртути находят медицинское применение (очистка, прнмочкн).
Его насыщенный раствор может растворять оксид ртути путем образования Оксоцианида Hg (CN) j-HgO. Белые кристаллы этого соединения состоят из молекул, структура которых соответствует формуле 0 (HgCN) a и соответствует параметру D (OHg) 2.15″. d(HgC)=2.02, d (CN)= 1.21 A. взаимодействие Hg (CN) a с Hgfj в растворе устанавливает равновесие между ними и смешанной молекулой HgT (CN).Константы этого равновесия — (Hg(CN)] l / lHgra | [Hg (CN)i] — равны 8,5(C1), 1,9(Br) и 0,11 (I) соответственно и имеют примерно одинаковое значение value. In доксоксановая среда.
85) родинид исследуемого элемента-Эрод, где род-род, А I-бесцветное кристаллическое вещество (связанное с Zn через азот, с Cd и Hg через серу) группы. Молекула Hg(SCN) a характеризуется следующими структурными данными: d (HgS)= 2.38. d (SC) α= 1, 62 d (CN)1.18 A. ZSHgS = ■ 180°, ZHgSC = 98e. для константы диссоциации Ионов ZnNCS и CdSCN приведены значения 0.3 и 0.05.При воспламенении сухой родановой ртути начинает происходить экзотермическая реакция ее разложения (х§ 1 дополнительно 160).
Для комплексного роданида цинка. Cd и Hg являются наиболее характерными типами M2ER0D4.Большинство из них очень хорошо растворимы в воде. Общая константа диссоциации соединения Анон равна 5•10«(Zn), 4•10-3 (Cd) и 2-10 «„(Hg).в результате Анон (Hg (SCN) 4) более стабилен, чем другие 2.Из соли, полученной из него, он растворяется slightly. In в частности, Zn(Hg (SCN)“] (PR = 3 ’10-c) 4) (PR = 4-10»).
Соответствующая свободная кислота, HjHg (SCN) 4]была выделена в виде желтого кристалла. 86) CD (N03) 2 и желтый адиат кадмия-Cd (N3) j -, который получают взаимодействием раствора NANS, не взрывается при impact. In напротив, двухвалентный азид ртути белого цвета-Hg (N3) a-очень взрывоопасен. В зависимости от способа приготовления(HGO и HN3 или HgCl1 и NaNa) указываются различия в их структуре. Для цинка известно комплексное соединение составаN (CjH$) α 4].
87) на основе E1a и LiAlH получен твердый белый гидрид EN цинка и его аналогов(в этом случае в качестве промежуточного продукта образуется нестабильный аранат E (A1H4) a).Из них ZnHj стабилен в сухом воздухе и разлагается на элементы только при температуре около 90°C, в то время как CdHa имеет температуру начала разложения −20 ° C, а HgH2 уже нестабилен, когда он превышает −125 ° C. гидрид цинка легко окисляется и нерастворим в эфире, и он разлагается медленнее в воду по схеме Znhaoa-f-2haoa= 2Ha + Zn (OH). При получении взаимодействия Znlj с LiH в эфирной среде также может образовываться смешанный гидронодид-ZnHI (также нерастворимый в эфире).
88) Zn (BH») s», представляющий собой плохо растворимый Белый Борат цинка, получают путем обменного разложения ZnCl с » LiBH «(или взаимодействия Znhi, суспендированного в эфире С В»Н»).Известный смешанный цинк хлорборановой кислоты (CI) BH4.It это смешно. Стабилизированный к 85°С, Борат цинка разлагает сразу в элемент нагретый более далее(отсутствие расщепления дибола).Бораты кадмия медленно разлагаются таким же образом при комнатной температуре.
89)безводный нитрат цинка и его аналоги, в частности, получают за счет взаимодействия металла с NaO$.Интересно, что по некоторым своим свойствам ртуть ближе к цинку, чем кадмий. Например, Zn (NO>) i-2Nj04 и НД (без»н•НТО<, компакт-диск (Ной) и Nj04 объединяются. Нитраты цника и ртути слегка улетучиваются в вакууме. Кристаллогидраты этих солей характеризуются составом Zn (NO») t•6HjO. Cd (NO|) t 4 4HaO и Hg (NO) a * HjO. Все 3 нитрата хорошо растворяются в воде, обычно диссоциируют, а соли ртути подвергаются очень сильному гидролизу. Комплексообразования с нитратами других металлов не является их особенностью.
Нитрат ртути является исходным материалом для производства многих других соединений этого элемента. 90) нитрит элемента (3 (N0a) a]подгруппы цинка неустойчив и подвергается сильному гидролизу в растворе. Соли соединений с нитритами щелочных металлов, такими как Ma[3(NOt) 4), гораздо более стабильны. Серия Zn-Cd-Hg улучшает стабильность этих солей. 91) хлорид кадмия с достаточно стабильным хлорированием представляет собой кристаллогидрат е (C10bb * 2HaO. Известен в виде).
Первая растворимость этих солей (при 1°С при 51 г / л и 70°С при 104) является второй (4,9 г / л при 1 ° С и 70 ° С при 14,3). При взаимодействии раствора NaCIOa и Hg (NOs) был получен красный осадок Hg (C10a) a. 92) для всех 3 элементов известна соль кислоты НГ03 (большинство из них находятся в форме кристаллогидратов).Zn и Cd хлората и бромата очень растворимы, как элемент, так и ртутная соль гораздо хуже.
Рентгеноструктурные исследования Zn (BrOi) a-6HaO показали, что вся кристаллическая вода имеет сложный катион[Zn (OHa) » p \ 93) перхлорат цинка и его аналоги хорошо растворимы в воде (и спирте) и характеризуются кристаллогидратом е (CU) а-6HaO. Константы диссоциации Ионов ZnCl04 и CdCl04 составляют 410 — и B-10«, respectively. In отличие от других растворов солей ртути Сильная кислота, Раствор Hg (Cl04), остается прозрачной даже после значительного разбавления. На рисунке показана зависимость РН перхлората Е от свойств эквимолярного раствора (СУ4) и элементов II группы. X1I-74. 94) бесцветные сульфаты Zn, Cd и Hg легко растворимы в воде, и при нормальных условиях они отделяются от раствора в виде кристаллогидратов: ZnS04-7Hj0 («сульфат цинка»), 3CdSO»-8HaO и HgS04-Ha0«.
Растворимость ZnSO «и CdSO» при 25°С равна 100 г NaO 57 и 77 г соответственно, а константы их диссоциации и растворения оцениваются при одинаковых значениях 5•10″. НАО 100 снижается с 53,4 г до 1,6 г. Взаимодействие HgS04 с большим количеством воды сопровождается осаждением основных солей. Это заставило Парацельса узнать о желтом (если красный) HgS04-2Hg0.Структура этой основной соли, вероятно, соответствует формуле (Hg (OHg) a] SO».Когда hgs04 безводный нагревается, он становится желтым, становится красным и разлагается при температуре около 500 ° С по схеме. HgSO» = НД-Ф-СОА + ОЖ.
Сульфат кадмия и ica прогрессируют только при более высоких температурах и проходят через образование основных солей. Сульфат цинка и кадмий образуют комплексные соединения типа шенита-Ma [3(S04)aJ-6Ha0-и, хотя более сложные, последние характерны для ртути, например, KaS04•3HgS04 * 2НаО. Автокомплексное образование в растворе[23S04 3 [3(S04) AJ сульфата цинка и его аналогов обладает значительно меньшими свойствами, чем галоидная соль. Цинковый купорос является наиболее важной промышленной солью cic и обычно служит исходным продуктом для получения остальных соединений этого элемента.
Его гидролиз в растворе относительно невелик (’более 0,2%).Сразу сульфат цинка широко использован в индустрии минеральной краски, медицины (глаза- Рисунок XI1-74.PH значение раствора перхлората. Сульфат ртути является подходящим катализатором для некоторых органических реакций. 95) бесцветные 3sjo » тиосульфат цинка и кадмия легко растворяются в воде, но диссоциируют относительно неадекватно(константа диссоциации составляет 4-10 «и I•10-4 соответственно) и неустойчивы.
Аналогичное соединение ртути-HgSaO» — HgS + SO $уже находится в момент образования. Тоносульфатный комплекс характерен для всех 3-х элементов. Например, KJZn (сто») и AJ•Ю, к» [компакт-диск (с, 0″)] и K4Hg (Коста-Рика) 4л были получены. В случае Hg-Cd-Zn стабильность аналогичного комплекса non равна reduced. So, нестабильные константы Ravia lHg (S80.) J / / и[Cd(s O Ot) tT равны 4-10 * °и 4 −10-7 соответственно. 96) Zn и его аналоги сульфиты-ZnSO » 2Н, 0, CdS0> — 2H20 и HgSOa плохо растворимы в воде, но растворимы в растворах сульфитов щелочных металлов.
Растворение происходит за счет образования комплексных солей, часть которых, например, Ki [Hg(SO») s] * HjO была получена в твердом состоянии. Для константы нестойкости Иона СУГ (так |)А]»Н [кд (так») а] «значения 9-10«б «х, соответственно. Этот тип ртутного комплекса устойчив в щелочной среде, но разлагается кислотами. Согласно схеме, SPE разлагается очень медленно.1Hg(С03)г „= — ХГ-F, так что ’4′ — ф так.
Пиролиз CdSO „становится заметным примерно с 350°C. наряду с основной реакцией CdSO“ — CdO-f-SOj, в этом случае частичный инвариант происходит по схеме 4CdSO „= 3CdSO “ -f-CdS. 97) нормальный карбонат (ESO) известен в Zn n Cd. Они представляют собой белые нерастворимые в воде вещества, которые при нагревании очень легко отсекают койку(давление диссоциации достигает 760 мм рт. ст.
Искусство при 297 или 357°C respectively. it это не так. Присутствие HgCO „подозрительно, но основная газированная ртуть известна-коричневая HgCO“ — 2HgO и желтая HgC03-3Hg0.It было также сообщено, что только стабильные низкие температуры были получены для всех 3 элементов, бикарбонат 3(HCOj). 98) Ортоснл и цинк и кадмий кошки-Zn2Si04 (mp 1509) и Cd2SiO “ (1252°С) практически нерастворимы в воде.
Они используются в производстве люминесцентных композиций для люминесцентных ламп. Соли цинка редко встречаются в природе(минеральные и Рем и Т). 99) нормальный фосфат цинка. Cd и Hg почти не растворяются в воле. Пирофосфат и метафосфат также известны. Производные цинка характеризуются следующими точками плавления (°C): 10G0 [Zn3 (P04).]. 1017 (ZnjP207), 872 [Zn (POj) 2]. 100) 3cj04 растворимость оксалата в воде очень мала (г / л): 0.008 (Zn). 0.03(CD) и 0.1(НД). Zn и CD характеризуются кристаллогидрата ZnC204.2Hj0 и CdCa04-3Hj0.
Константы диссоциации ZnC204 и CdC204 составляют 1•10 »*и 3 * 104 соответственно. Сложные оксалаты, полученные из них, в основном относятся к типу Mj {3 (Cj04) i], где M-одновалентный металл. Оксалаты чувствительны к ртути. 101) e ацетат (CH «COO)» цинка и его аналоги легко растворимы в воде. Из раствора oi отделяется 2Н»0 (Zn), 3HjO (Cd) или безводным состоянием (Hg). для константы диссоциации nons CHjCOOZn — и CHjCOOCd -, приблизительно то же значение равно 2 * 10″, а общая константа диссоциации Hg (CHjCOO) 2 равна 4 * 10〜.
То есть эта соль почти не диссоциирует по сравнению с 2 другими. Hd (CH»COO) t разлагается при температуре около 180°C, в то время как ацетат кадмия фоточувствителен. 102) кристаллический основной ацетат (OZn4 (CH3COO)] этого элемента получают путем выпрямления кубического ацетата под высоким вакуумом. , д (ЗНО) −1.98.д(ОУ) «= 1.24, г(куб. см)-1.55 а СОКО»= » 125°.Это вещество плавится при 252 ° С (по другим данным, 272); хлороформ (1, 6) слабо растворяется в бензоле (0,60) и толуоле (100 г, 0,15 мл).в воде ацетат цинка нерастворим, но гидролизуется гораздо быстрее, чем аналогичные соединения бериллия.
Это явно неполно Экранирование цинка соседними атомами обусловлено значительно большим размером Zn **(0,34 а) по сравнению с Bea *(0,83 а). 103) ацетилацетонат е (C»HtO»L известен для всех 3 элементов. Их общие свойства сходны с аналогичными соединениями бериллия (§ 1 доп. 62) и очень хорошо растворяются в воде. Выраженный гидролиз наблюдается при нагревании. В серии Zn-Cd-Hg, растворимость и воды и органических растворителей уменьшена.
Наиболее хорошо изученный Zn (C»H7Oa) j плавится при 138 ° C и перегоняется при пониженном давлении без деградации. Циклопентадиенильные производные Zn (C) также известны для цинка. ДС)на. 104) сульфиды Zn и его аналогов встречаются в виде природных минералов. Непосредственно они потребляются в основном в виде минеральных красок. Тепло, выделяемое из элементов, и энергия кристаллической решетки равны (ккал / моль) соответственно 46 и 865 (ZnS), 36 и 813(CdS), 14 и 854(HgS).
Чистый ZnS(mp.1182 ° С) белый, CdS (10MP при давлении атм.1475) бывают желтыми, оранжевыми или красными в зависимости от способа приготовления. При осаждении сероводорода из растворов солей он обычно выделяется в виде желто-желтого осадка. Образованию красных форм способствует нагрев среды и повышенная кислотность. Только известный и стабильный ниже −50°C гидросульфид кадмия-Cd (SH). 105) сернистая ртуть известна в 2 формах: черной (плотность 7,7) и красной (8,1 г / см9).Первый имеет структуру монокристаллов ZnS типа(рисунок XI-12), 2-й
Кристалл состоит из бесконечной цепочки типов-НД-с-НД-с — [параметр J в(иго) −2.36 а ZHgSHg =105е, ZSHgS■ = 172°].В природе, менее 386 х, устойчивую красную форму(Кин песка Минеральных) в основном обнаружили, а в реакции в растворе, иго, как правило, черный с меньшей устойчивостью, осадка(см. VII и§ 2 73).Переход к красному цвету является слегка пирогенным (I ккал / моль), и в одиночку, с замечательной скоростью, прогрессирует только при 200°C или more.
It может быть значительно ускорен путем измельчения сажи с раствором полисульфида щелочного металла, и это быстро осуществляется в результате сублимации HGS (то есть 580°С).Такой же переход происходит и при высоком давлении. Интересно, что красный коэффициент сжатия HgS примерно в 2 раза больше, чем у Черного, несмотря на его небольшой объем. 106) растворимость ZnS, CdS и HgS в воде очень мала-значения PR составляют MO 14, 8-U » 2 ’и 2-U» 5, respectively.
In параллельно с растворимостью в воде изменяется и растворимость в кислотах. Уксусная кислота, но уже очень разбавленная соляной кислотой, CdS-только при достаточной прочности, HGs-растворим только в кипящей концентрированной соляной кислоте. Лучший растворитель для HGS является иодистоводородной кислоты. 107) растворимость по величине PR, определяемой электрохимическим методом Сернистая ртуть равна Y 2•10 — «-1.4•I0-w моль / л, то есть 1.4-10» «-6-10» «= 8.4-10-„молекулы или литры очевидно, что такие величины лишены реального физического смысла.
Прямая измеренная растворимость HgS составляла 3 “ 10 » моль / л, то есть 2-1015 молекул на литр. Это эквивалентно 150 молекулам HgS на 1 миллиард молекул HgO(включая возможный продукт их гидролиза). 108) ZnS используется в качестве основы для белых минеральных красок, но он часто используется для этой цели и представляет собой близкую смесь с BaSO < — t. It это горько-сладкий момент.
Последнее получается при взаимодействии со схемой. Но он обладает относительно низкой кроющей способностью и постепенно затемняет свет(за счет разложения ZnS ультрафиолетовыми лучами). в связи с развитием производства титанового белого, расход литопона не уменьшился 109) в потоке HaS (в присутствии небольшого количества щелочного металла или хлорида магния) можно перевести в кристаллическое состояние путем прокаливания аморфного сульфида цинка.
Получение кристаллических ZnS、 Если есть следы Cu (1: 10 000) или других металлов, он приобретает способность фосфоресцировать(§ 3 add.86).То есть, после предварительного освещения, он будет светиться в темноте. dark. In кроме того (и в отличие от сульфидов щелочноземельных металлов), такие кристаллы ZnS также светятся под воздействием рентгеновских лучей и излучения радиоактивных веществ.
Это является основой для использования экрана, который закрывается им при работе с радиоактивными препаратами или рентгеновской техникой. Цвет свечения зависит от природы элемента, используемого в качестве активатора. C обозначает желто-зеленый цвет. АГ-синий. МП-оранжевый и т. д. Кристаллический ZnS, полученный в присутствии небольшого количества MnS(1: 5000), также светится под действием трения(то есть фрикционной люминесценции).
Конструкция источника света, работающего за счет механической энергии, может осуществляться по этому принципу (например, при вращении или встряхивании контейнера, содержащего соответствующий порошковый материал, возникает необходимое трение). 111) представлен обзор новой интересной области применения монокристаллов CdS (полупроводников типа полуп с энергетическим зазором 2,4 ЭА).
Квантовые генераторы на основе жидкостно-гелиевого охлаждения на их основе могут возбуждаться высокоскоростными электронами (Энергия около 100 млн ЭВ) и излучать излучение в очень широком диапазоне длин волн (от дальнего инфракрасного до Дальнего ультрафиолетового).С другой стороны, одновременное поглощение энергии возбужденными фотоквонами может привести к резкому увеличению выхода ультразвука, проходящего через кристалл CdS.
Монокристаллы CDs могут быть получены синтезированием из элементов в газовой фазе (температура около 900°C). Образцы массой до 100 г также получали из расплава(при 200 ° С под давлением 1500 АГ).Очевидно, что ZnS и CdSe имеют схожие характеристики с CD. 3 соединения эффективный атомный заряд во всех кристаллах близок к±0,7 э. 112) HgS отличается растворимостью в сильном растворе сульфида щелочного металла (не аммония), в отличие от сульфида цинка и кадмия.
Это растворение происходило за счет образования комплекса сульфида ртути, часть которого выделялась в твердое вещество state. An пример-Ka IHgSj• * 5НаО. Образование подобных солей натрия в растворе иногда используется для извлечения песка из пород, содержащих его. Используя сухой метод, были получены тиосинаты 3ZnS2(E is Ba. Sr). 113) при обработке диоксида серы высокотемпературной концентрированной серной кислотой Ия постепенно переходит в белое нерастворимое вещество состава 2HgS-HgSO.
При кипячении в воде ионы S04 частично отсекаются и не производят ионов Hg**, поэтому их следует рассматривать как комплексное соединение, соответствующее Формуле IHg (SHg) a] SO». Аналогичные комплексные производные ионов Hg1 *, содержащие молекулы HgO. При растворении этих веществ в растворе перхлората ртути образуются внутренние Hgla, AgBr и другие.
114) аналогичная соль общего типа{Hg (SHg) 2jr2t с белым(C1).Бледно-желтый(Br) или оранжево-желтый(1) цвет, более или менее светлый (I> Br> C1) быстро становится черным и возвращается к своему первоначальному цвету при длительном воздействии темноты или средней зрелости. Причина очевидна. Разрушение связей Hg-G и последующее восстановление. Получены также производные аналогичных по составу селена и теллура.
115) сульфид типа 3S2 (производное сероводорода) описан в отношении ртути и цинка. Бесцветные кристаллы с высоким показателем преломления HgSa получают реакцией при 250-300 ° С (Hg (SHg)2JCl2 ″ = » HgjCljf +HgSa. При температуре выше 390 ° С сера удаляется и превращается в HgS. «+2S2Oj ’ = » ZnSa-4-S20 ^’когда соли цинка нагреваются с избытком раствора гипосульфита, пиролиз ZnSa начинается при 120°C, но только при 500°C и выше.
Полученный сульфид цинка очень черный. По-видимому, компакт-диски *можно получить аналогичным образом. 116) элементы соленид и Теллурид в подгруппе цинка, в общем случае, соответствующие сульфиды аналогичны. Некоторые из данных, характеризующих их, сравниваются со следующими. ZnS » Компакт-Диски. Кгс| / Znte На Сате Фирм ВМТ.»»Л. * ………Желтый красный черный Образование богослов кмиЦмолъ……… Тридцать один» Температура плавления. «ОСГ. 1240 799 2000 (15 атмосфер))
Для энергии кристаллической решетки селенида приведены следующие значения (ккал / моль): 863 (Zn), 808(Cd) и 867 (Hg).Большинство из этих соединений обладают полупроводниковыми свойствами. Например. Znte на Р-тип полупроводника и ЦИАМ является полупроводника р-типа. Халькогоиды Чика и кадмия могут быть перекристаллизованы из расплава bismuth.
In растворенный висмут, растворимость увеличивается с температурой (ZNS> ZnSe> CdS> CdSe> ZnTe> CdTe). 117) Теллурид ртути (HgTe) является редким примером соединения, образование которого из элемента связано с увеличением объема. Впервые можно было наблюдать химическое разложение веществ под действием давления.15000ат. HgTe и происходит медленное разложение элементов.
118) азот и его аналоги не связаны напрямую. Черные пластины, ZniNt(теплота, получаемая из элементов 5 ккал / моль) и низкоустойчивый CdjNj (теплота, получаемая из 30 ккал / моль) могут быть получены путем тщательного нагрева Амида (дополнительные 57).Специфический азотирующий азот также образуется, когда цинковая пыль нагревается до 600°C потоком аммиака. Оба нитрида разлагаются в воде по схеме: 3, Na-f 6H20 = 2NH, + 33(0H) образование за счет взаимодействия Hgl2 и KNHS в жидком темно-коричневом аммиаке HgjN, высоковзрывчатом.
Нагревание смеси Zn „N и Li“ N потоком аммиака приводит к образованию смешанного нитрида ZnNL1 черного цвета, который менее стабилен, чем аналогичные соединения магния (§ 1).67). — ZnNZnT (Γ — CI, I). Из фосфидов рассматриваемых элементов известны серые Zn » Pa и Cd, P2l-оранжевые ZnPa и CdPa, а также темно-коричневые Hg Pa Pa. Производные цинка и кадмия обычно получают синтезом из этого элемента.
При нагревании фосфид ER легко разлагается по схеме ZER* = P » f-3jPa. Zn3P производит тепло (mp 1180 *С) и Cd, P,(mp.700) составляют 55 и 27 ккал / моль соответственно. Оба разлагаются разбавленной соляной кислотой (в отличие от фосфида эры).Благодаря своим кристаллическим полупроводниковым свойствам ZnjPj может быть очищен дистилляцией с потоком водорода 1100 ° C. It широко используется в качестве яда для грызунов (крыс и др.).Белый ZnPH также известен.
Полубурая фосфорилированная ртуть получается реакцией P «l» — F5 HG = s2Hgl » + HgiPa(или спирт-рН в эфире medium. By взаимодействие KOH и HgU). 120) в соответствии с композиционной формулой Арсениды цинка и кадмия аналогичны фосфидам. Они также получают синтезом из элементов. Серый ZnjAs и Cd3Asa плавятся при 1015 и 721°C соответственно, а серый и черный ZnAsA и CdAsa являются 77 |и 621 ° C черный аморфный порошок ртути гортензии образуется в результате реакции^ 3HgCl2 + 2Aeii, e• — Hg и Afe-beHCI.
Аминокислоты цинка и кадмия относятся к типу 3, Sba и 9Sb. Для znsssba n Cd » Sba (mp 424 ° С) дается результирующая теплота 48 и 14 ккал / моль. Интересно, что они больше, чем Zn3Asa и CdjAsj производят тепло (23 и 10 ккал / моль). 121) из подгруппы элементарных карбидов известны белые производные ацетилена ЗСа-типа. Когда металл нагревается за счет газового потока, сформированного acetylide Zn и СD. Из них ZnCa уже выделяет ацетилен водой для разложения, а CdCj — только разбавленной кислотой.
При пропускании ацетилена через раствор ртутных солей образуется очень взрывоопасная HgCa. По структуре кристаллов oi напоминает карбид кальция (рисунок X-5).Для параметров значения d (CC) составляют 1,19, А D (HgC)≈2,17 A. вода-ртуть-ацетилид эффективен и разложение керотамии-oi происходит по схеме HgCi + 2CH1 + NaO-H HgCla + CHCCHO Краснолицый. Черный! 29 24 3 1239 1050 S67 ayetaldegnda (X§ 2 дополнение.
73).Это является основанием для использования ртути в качестве катализатора при получении ацетальдегида из ацетилена(например, путем взаимодействия последнего с кипящим раствором 40% H2S04 в HgS04). 35 000 Ат. Под давлением ацетила ртуть разлагается (иногда сопровождается взрывом), и углерод выделяется в виде графита. Некоторые сложные ртутные ацетилиды также известны, такие как бесцветное взрывчатое вещество Ba [Hg (ССН) 4]•2nhj. 122) переход 2Hg + a + 2e-HgJ ’(+0,91 В) и Hgj * + 2 2.5.
Есть обзорная статья о его характеристиках. 123) многие грязевые потоки Hg£характеризуются разложением до соответствующей соли Hg1 *и металлической ртути по схеме Hg2X2-HgXa-fHg (X-одновалентный анион).в одних случаях (например, HgaClj, Hg, S04) он очень медленный только под воздействием света или нагрева, а в других случаях[Hgs (CN) 2, Hg2S и др.), Hg} 4 протекает очень быстро даже с образованием солей.Последних вообще нельзя отличить.
Например, взаимодействие Hg2 (NO>) 2 с KCN протекает по формуле. Hg2 (N0a)2 + 4KCN = K * IHg (CN) 4J 4-Hg + 2KN03. 124)HgJ * Hga + — f поскольку распад аммиака по схеме Hg очень ускорен, он протекает почти instantaneously. In в этом случае ионы Hg * образуют производное соответствующей водонерастворимой двухвалентной ртути(дополнительно 59), а выделяющаяся мелкодисперсная металлическая ртуть делает осадок черным. Например, используя HgjClt, реакция протекает по уравнениям Hg2Cl2 + 2NH3e» NH2HgCl-fHg + NHG » Cl. Он используется в аналитической химии для обнаружения ионов ртути.
125) при получении нитрата ртути рекомендуется использовать холодную азотную кислоту плотностью 1,2 г / см (то есть обычную концентрированную, разбавленную в равных количествах водой).Кристаллический гидрат Hg» (N0″) характеризуется 2-2H20, легко растворим в воде (3: 10 по массе) и выветривается на воздухе. Катион в нем явно представляет собой группу (H2OHgHgOH2)*.
Некоторые основные соли определенного состава, например, Нд2(с бортовым номером 03) 2-2Hg2(0ч) есть. Взаимодействие Нд2 (Ноа) 2 с heptasulfimide (добавлен ІХ§ 1) также описывается. 55) было получено желтое (темнеющее на воздухе) соединение Hg2 (NS;) a, и полимер (Hg4N4S4) * прореагировал с тетрасульфостертермидом(IX§ 1 add.56). 136) Hg2 (NO») когда сильная щелочь воздействует на раствор 2-сильной щелочи, выделяется 1 гидрат HG HG (OH) 2J оксид. Однако это соединение очень неустойчиво, и равновесие Hg2 (OH) 2 ** Hg20-f H20 сильно смещается вправо.
Таким образом, черный оксид (Hg20) ртути, который почти нерастворим в воде, выпадает в осадок. Последний постепенно разлагается на HgO и металлическую ртуть(Hg20 + 0,2 ккал—HgO-fHg).При нагревании (или при сильном освещении) избыточное присутствие щелочей значительно ускоряет распад. Оксид ртути также образуется при медленном окислении металла во влажном воздухе.
127) металлическую ртуть можно получить в виде светло-серого порошка, воздействуя на восстановитель, суспендированный в воде Hg20(формальдегид и др.).Такой порошок ртути характеризуется высоким давлением паров из-за его высокой реакционной способности. * Т А Р А и в М. успех * Хаммам. 18″, J. 8. Одна тысяча два 128) с атомами HgJ * каждый атом ртути имеет только 1 положительный заряд(а не 2 в Hg1*), поэтому основные свойства Hga (OH) a гораздо более выражены, чем Hg (OH) f. In в этом соединении вторая соль оксида ртути подвергается меньшему гидролизу, чем соответствующий оксид salt.
As как правило, они имеют низкую растворимость и обычно диссоциируют в растворе. Для ионов Hg’a’ в растворе было найдено d(HgHg) » −2.52 A. Очевидно, что non-Hg / *в основном гидратируется 2 молекулами воды и образует линейный радикал[HjOHgHgOHj] С d (HgO) * * 2.15 A. На практике отсутствует тенденция к комплексообразованию ионов HgJ*.
Отчасти это связано с нестабильностью всех молекул и молекул, которые более или менее прочно связываются с ионами Hg1 *(G*, CN», NCS » и т. д.). В то же время распределение суммарного заряда между 2 атомами Hg не способствует комплексообразованию. Таким образом, структура соединения нитратов типа 2Hga(N03) j-M (NOi) a, известного для железной ртути, вероятно, имеет формулу(Hga) A [M (NOj) el.
Истинным комплексным производным железа ртути может быть соединение 2-х N — * — Hg связей в составе NaH4Hga (N03) a, которое способствует стабилизации ионов Hg|*. 120) Галоидная соль оксида ртути плохо растворима в воде, и растворимость уменьшается в серии HgjClj (110 * e)-HgjBrj (4-10’*)- Hgjlj (4-10〜и моль / л).Гораздо более растворим во фтористых солях (Мп.570°с) подвергается гидролизу в растворе, быстро темнеет на воздухе. Очень чистое состояние ртути (HgaIa) является желтым, но обычно появляется в виде зеленоватого осадка(из-за частичного распада).
Стабильность серии CI-Br-I галогенидов Hgara значительно снижается, и Hgala уже очень нестабильна. Под действием раствора ki, Hgala-2к1 ф-ка(Хилтон Гарден Инн»] — Ф НД. Расстояние Hg-Hg Галогенида NdaGa сильно зависит от природы галогена-(A): 2.42(F), 2, 53(C1),2.58(Br).2.69 (я). » 130) карамель можно получить путем пропускания диоксида серы в кипящий раствор HgCla (обратите внимание на выраженное улетучивание водяного пара и хлорида ртути) или путем замены разлагающегося Hga (NO») a на NaCl.
При нагревании он желтеет, разлагается и почти полностью сублимируется по схеме HgaCU = HgCla-f Hg (то есть при 384 ° С) под воздействием света(а при кипячении в воде) карамель постепенно темнеет за счет частичного разложения на HgCla и Hg. 131) в частности, карамель образуется по следующей формуле: 2hgcla+(NH4) aCa04 =α= 2NH4C1-f 2COa-F Hg ^ U J.
An интересной особенностью этой реакции является именно она. Только под влиянием света она течет пропорционально его количеству. Таким образом, количество света, падающего на реакционную систему, можно определить по массе высвобожденной карамели. Первый раствор получают путем растворения в 25 г (NH 04) fCa04, 15 г HgCla и некотором количестве воды Hg (NO). 132) в электрохимии, HgaC!
А служит основой для карамельного электрода, который является важным электродом сравнения. Для его изготовления (в присутствии раствора KC1) HgaC! Пасту из смеси А и ртути наносят на слой металлической ртути (контактирующей с внешним контуром), после чего сверху заливают раствор КС1.Если последний насыщен, то потенциал каломельного электрода для нормального водорода (V§ 8, дополнительный 3) изменяется линейно от 0°C до+0.26 ° C при 50 ° C до+0.23. 133) HGA (N03) вследствие взаимодействия растворов а и КНКС образуются галогениды ртути, подобные галогенидам, в виде белого вещества precipitate.
It очень нестабилен и легко разбирается по схеме Hga (SCN) a-Hg (SCN) a-f Hg. 134) Белый азид железной ртути-HGA (N.) A-осаждается при взаимодействии HGA (N’0.) t и NH4N. It светочувствителен и взрывоопасен. 135) сульфат железа (HgaS04) образуется в виде бесцветного кристалла под действием has04, разбавленного нитратом ртути solution. In вода (И разбавленный с H3SO») оно бедно soluble(0.6 g / l), но оно постепенно hydrolyzed для того чтобы произвести желтое низкопробное соль Hg3SO » * Hg3(OH) 3. 136) в электрохимии сульфат железа используется при изготовлении обычных элементов, который служит эталоном для точного измерения напряжения.
Схема наиболее распространенной структуры таких элементов показана на рисунке. XI1-75.Его работа основана на реакции Cd-fHg3S04 = CdS04-f2Hg, а его электродвижущая сила при 20°C составляет 1,0186 В (и почти не зависит от температуры). 137) осадок, осажденный в виде белого осадка под действием раствора Hg’4-карбоната (HgjCOj) растворимых карбонатов и ртути двухвалентной, при частичном гидролизе быстро желтеет. Очень трудно расплавить(L0 — * mol! Л порядок), НД, НП, ПС имеют обыкновение ломаться. 138) ионы HgJ +аналогичных кадмия и цинка существуют только в особых условиях.
Металлы кадмия хорошо растворимы в расплавах CdT3-Галогенида[например, их растворимость при 600°C (Ат.% ): 16 (C1), 14 (Br) и 1,5 (I)]. в полученной красновато-черной жидкости равновесие левого сдвига устанавливается по схеме: Cd-f CdT3 * * Cd3r3.Когда вы добавляете соответствующий галлон алюминия, равновесие смещается вправо (и зеленый и желтый цвета меняются).
Поэтому при 335°с раствор кадмия Cdrj-fAl3r $плавится[т. e. Cd система + Cd (Air ^ a * * * * Cd * (Air») j}характеризуется следующим содержанием CdJ +(mol%)> 67 (C1), 58 (Br) и 31 (1). Связь CD-Cd Иона Cd задается величиной k = 1,1, и процесс ее образования является эндотермическим(рассчитанным в газовой фазе для Cd3Cl3—35 ккал / моль), а постепенное охлаждение расплава сопровождается расщеплением металлического кадмия (с образованием черной массы).
Расплав, охлажденный быстро кипячением бензола, Cd3 (AlCl4) 3, может быть отделен в явно свободном состоянии, и вода быстро разлагается с выделением кадмия. 139) растворимость цинка в его Галогенидном расплаве значительно ниже, чем кадмия(например, при 600 ° С (АТ.% ) Равно: 0,6 (C1)и 0,9 (I)].Природа этих решений до сих пор ясна. Но это установлено. Znr3 контакт с Галогенидом резко увеличивает летучесть металла в вакууме (C1 <Br <I), что обусловлено равновесием по схеме: Zn + ZnT3 * * Zn3I * 3.Температура смещается влево на cavity.
It может использоваться для очистки металла, как в случае алюминия (XI§ 2 add.87). 140) для тех, которые могут присутствовать в течение короткого времени с парой свободных радикалов EH и EH, даны следующие значения связи e — H (A)и их силы.1.59 и 1.5 (znh по). 1.51 n 2.1 (ZnH); 1.76 и 1.2(CdH); 1.67 и 1.9(CdH); 1.74 и 1.4(HgH); 1.59 и 2.4(HsH*). как видно из представленных данных, когда изолированные электроны удаляются во время ионизации электронов, валентная связь значительно усиливается(III§ 5 add.12).
141) первые элементы II группы-бериллий l и y-во многом напоминают 2-й элемент III группы-алюминий. Действительно, оба металла пассивны против сильной холодной хной. Оба гидроксида являются амфотерными, а оба карбида-производными метана и т. д. Бериллий, с другой стороны, в некоторых отношениях демонстрирует особенно близкое сходство с zinc.
In помимо Амфотерной природы гидроксидов обоих элементов и их стабильности при очень высоких температурах примером такого сходства является наличие в зуноле основного Аннета, аналогичного соответствующим производным бериллия. Ни магний, ни другие элементы II группы таких соединений не образуются. Насыщенный ■ Шорох CdSO < CdS04 — / HP Я CD омаг з ^ н \ N_02. 5%кд) НСГ $ о. * Hg В Рисунок XI1-75.Схема! Нормальный элемент.
Смотрите также:
| Кристаллы | Первая группа периодической системы |
| Щелочноземельные металлы | Щелочные металлы |

