Первый закон термодинамики
Первое начало (первый закон) термодинамики это закон сохранения и превращения энергии для термодинамической системы. Согласно ему, работа может совершаться только за счёт теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первый закон термодинамики был сформулирован немецким учёным Ю. Л. Майером в 1842 г. и подтверждён экспериментально английским учёным Дж. Джоулем в 1843 г.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
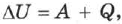
где 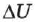 — изменение внутренней энергии, А — работа внешних сил,
— изменение внутренней энергии, А — работа внешних сил, 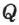 — количество теплоты, переданное системе.
— количество теплоты, переданное системе.
Из (2.23) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то 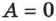 и
и 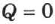 , а следовательно, и
, а следовательно, и 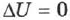 .
.
При любых процессах, происходящих в изолированной системе, её внутренняя энергия остаётся постоянной.
Если работу совершает система, а не внешние силы, то уравнение (2.23) записывается в виде:
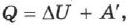
где 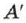 — работа, совершаемая системой
— работа, совершаемая системой 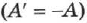 .
.
Количество теплоты, переданное системе, идёт на изменение её внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счёт внутренней энергии).
Действительно, если к телу не поступает теплота 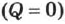 , то работа
, то работа 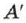 согласно уравнению (2.24), совершается только за счёт убыли внутренней энергии
согласно уравнению (2.24), совершается только за счёт убыли внутренней энергии 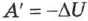 . После того как запас энергии окажется исчерпанным, двигатель перестаёт работать.
. После того как запас энергии окажется исчерпанным, двигатель перестаёт работать.
Следует помнить, что как работа, так и количество теплоты — характеристики процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определённое количество теплоты или работы. Система в любом состоянии обладает лишь определённой внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
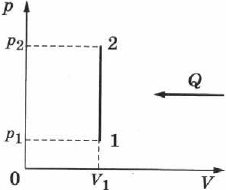
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объёме. Его можно осуществить в газах и жидкостях, заключённых в сосуд с постоянным объёмом.
При изохорном процессе объём газа не меняется 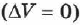 , и, согласно первому началу термодинамики (см. уравнение (2.24)),
, и, согласно первому началу термодинамики (см. уравнение (2.24)),
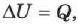
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа 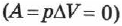 газом не совершается (рис. 77).
газом не совершается (рис. 77).
Если газ нагревается, то 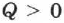 и
и 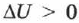 , его внутренняя энергия увеличивается. При охлаждении газа
, его внутренняя энергия увеличивается. При охлаждении газа 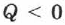 и
и 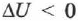 внутренняя энергия уменьшается.
внутренняя энергия уменьшается.
Изотермический процесс — это термодинамический процесс, происходящий в системе при постоянной температуре.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется (см. формулу (2.21)), 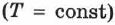 , то всё переданное газу количество теплоты идёт на совершение работы:
, то всё переданное газу количество теплоты идёт на совершение работы: 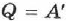 .
.
При получении газом теплоты 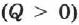 он совершает положительную работу
он совершает положительную работу 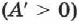 . Если газ отдаёт тепло окружающей среде
. Если газ отдаёт тепло окружающей среде 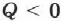 и
и 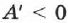 . В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой
. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой  (см. рис. 76, б).
(см. рис. 76, б).
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с постоянным давлением  . Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
. Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле (2.24), передаваемое газу количество теплоты идёт на изменение его внутренней энергии  и на совершение им работы
и на совершение им работы 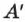 при постоянном давлении:
при постоянном давлении: 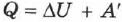 .
.
Работа идеального газа определяется по графику зависимости 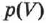 для изобарного процесса (рис. 76, а)
для изобарного процесса (рис. 76, а) 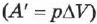 . Для идеального газа объём пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
. Для идеального газа объём пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой 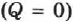 .
.
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Её внутренняя энергия 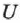 может меняться только за счёт работы, совершаемой внешними телами над системой, или самой системой.
может меняться только за счёт работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики 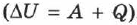 , в адиабатной системе
, в адиабатной системе
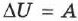 , где
, где 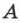 — работа внешних сил.
— работа внешних сил.
При адиабатном расширении газа 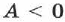 . Следовательно,
. Следовательно,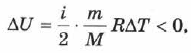 что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому что давление газа уменьшается более резко, чем при изотермическом процессе.
что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому что давление газа уменьшается более резко, чем при изотермическом процессе.
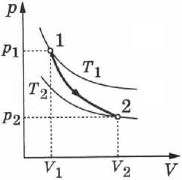
На рис. 78 адиабата 1-2, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объёма 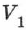 до
до 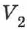 .
.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатном сжатии используется в двигателях дизеля.
Эта лекция взята со страницы лекций по всем темам предмета физика:
Возможно эти страницы вам будут полезны:
| Количество теплоты в физике |
| Работа в термодинамике в физике |
| Уравнение теплового баланса в физике |
| Второй закон термодинамики в физике |

