Оглавление:
Определение условий выпадения осадка и разделения ионов
Малорастворимое соединение начинает выделяться в виде твердой фазы, когда произведение концентраций (точнее, активностей) ионов данного электролита (так называемое ионное произведение, обозначаемое ИП) достигает величины произведения растворимости. Если 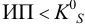 , осадок не образуется, т. е. растворяется.
, осадок не образуется, т. е. растворяется.
Пример 6.1.
Образуется ли осадок гидроксида марганца, если к 20 мл 0,20 М раствора хлорида марганца прилить 10 мл 1,0 М раствора 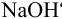 ?
?
Решение:
Образование осадка происходит по реакции:
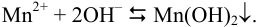
Значение 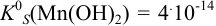 . Так как реакция протекает в растворе сильных электролитов, необходимо провести расчет с учетом ионной силы раствора. Находим концентрации ионов в растворе после разбавления:
. Так как реакция протекает в растворе сильных электролитов, необходимо провести расчет с учетом ионной силы раствора. Находим концентрации ионов в растворе после разбавления:
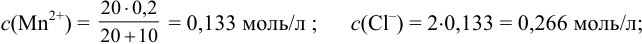
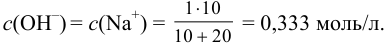
Вычисляем ионную силу раствора по формуле (2.1):
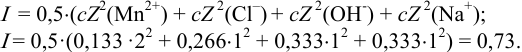
По табл. 1 приложения для полученного значения I находим коэффициенты активности:
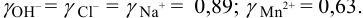
Вычисляем ионное произведение с учетом того, что ионы в растворе взаимодействуют по основной реакции в соответствии с равновесными концентрациями, равными общим, побочных реакций нет (не учитываем гидролиз 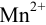 ),
), 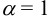 .
.
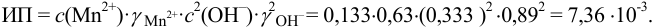
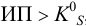 , следовательно, осадок выпадет.
, следовательно, осадок выпадет.
Пример 6.2.
Может ли образоваться осадок 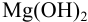 , если смешать равные объемы 0,5 М
, если смешать равные объемы 0,5 М 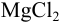 и 0,1 М раствора
и 0,1 М раствора 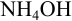 ? Расчет провести без учета ионной силы раствора.
? Расчет провести без учета ионной силы раствора.
Решение:
При сливании двух равных объемов суммарный объем увеличивается вдвое, а концентрация веществ уменьшается вдвое, т. е. концентрация 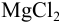 станет равной 0,25 моль/л, а
станет равной 0,25 моль/л, а 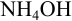 — 0,05 моль/л.
— 0,05 моль/л.
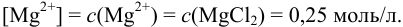
Равновесную концентрацию 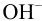 рассчитываем, используя константу диссоциации
рассчитываем, используя константу диссоциации 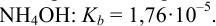
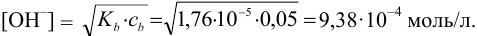
Взаимодействие ионов с образованием осадка протекает по реакции 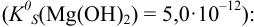
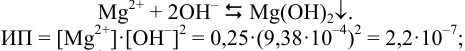
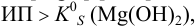 т.е. осадок выпадает.
т.е. осадок выпадает.
Пример 6.3.
Найдите pH начала выпадения осадка 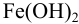 из 0,10 М раствора
из 0,10 М раствора 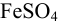 . При каком значении pH осаждение будет практически полным?
. При каком значении pH осаждение будет практически полным?
Решение:
Образование осадка можно представить уравнением:
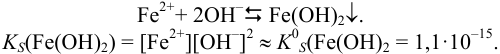
Так как FeSO4-сильный электролит, 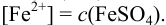
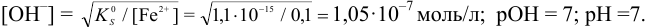
Следовательно, при pH = 7 начнется выпадение осадка  из 0, 10М раствора
из 0, 10М раствора  .
.
Осаждение (связывание) иона считается практически полным, если его концентрация в растворе становится <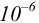 моль/л. Тогда
моль/л. Тогда 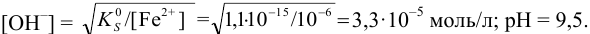 Таким образом, при pH = 9,5 образование осадка из 0,10 М раствора
Таким образом, при pH = 9,5 образование осадка из 0,10 М раствора 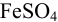 практически закончится.
практически закончится.
В растворе могут присутствовать несколько ионов, участвующих в реакциях образования осадков с одним и тем же реагентом. Это используется при объединении ионов в одну аналитическую группу аналитических классификаций катионов и анионов. По схеме расчета, подобной приведенной в примере 6.4, можно рассчитать условия начала и конца совместного осаждения группы катионов. Практический интерес представляет также определение возможности разделения двух ионов (при достаточно заметной разнице в As их соединений с одним и тем же реагентом), т. е. возможности их фракционного осаждения.
Пример 6.4.
Какой осадок выпадет первым и какая доля первого иона останется в растворе к началу осаждения второго, если к раствору, содержащему по 0,10 моль/л нитратов кальция и бария, постепенно добавлять 0,10 М карбонат аммония. Возможно ли количественное разделение ионов 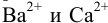 с такой концентрацией при осаждении карбонатом аммония?
с такой концентрацией при осаждении карбонатом аммония?
Решение:
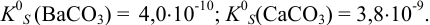
Ионную силу учесть в данном случае сложно, поскольку меняется ионный состав раствора в ходе осаждения. Однако её изменения одинаково скажутся на изменении коэффициентов активности ионов, входящих в состав осадков, и не повлияют на общий вывод. Поэтому будем считать 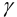 ионов равными единице и
ионов равными единице и 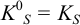 . Найдем
. Найдем 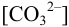 для начала осаждения ионов
для начала осаждения ионов 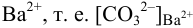
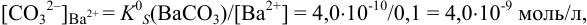
и для начала осаждения ионов 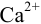 :
:
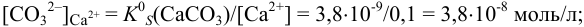
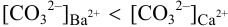 , поэтому для
, поэтому для 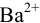 раньше будет достигнуто соотношение
раньше будет достигнуто соотношение 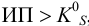 , и осадок
, и осадок 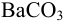 выпадет первым.
выпадет первым.
К началу осаждения 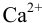 в растворе останется
в растворе останется 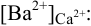
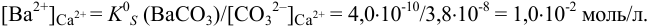 Это составляет
Это составляет 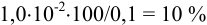 от первоначального количества, следовательно, полного разделения ионов не произойдет, они будут соосаждаться.
от первоначального количества, следовательно, полного разделения ионов не произойдет, они будут соосаждаться.
При практически полном осаждении доля иона в растворе составляла бы величину менее 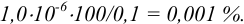 .
.
Пример 6.5.*
Найдите условия количественного разделения 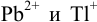 путем насыщения сероводородом
путем насыщения сероводородом 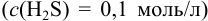 раствора, содержащего по 0,10 моль/л каждого катиона.
раствора, содержащего по 0,10 моль/л каждого катиона.
Решение:
Представим равновесия двух главных реакций:

Найдем концентрации 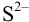 , необходимые для начала осаждения ионов, пренебрегая влиянием ионной силы:
, необходимые для начала осаждения ионов, пренебрегая влиянием ионной силы:
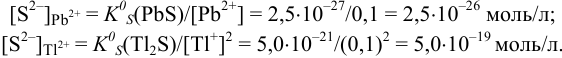
Следовательно, первым будет осаждаться 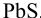 . Для количественного осаждения
. Для количественного осаждения 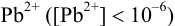 необходима
необходима 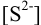 , равная:
, равная:
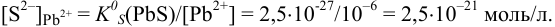
При сравнении полученной величины с концентрацией 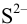 , при которой начинает осаждаться
, при которой начинает осаждаться 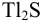 , видно, что осаждение ионов
, видно, что осаждение ионов 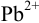 к этому моменту практически закончится. Таким образом, для полного разделения этих ионов следует поддерживать концентрацию
к этому моменту практически закончится. Таким образом, для полного разделения этих ионов следует поддерживать концентрацию 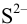 между
между 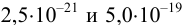 моль/л. Поскольку
моль/л. Поскольку 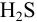 — слабая кислота, концентрация ионов
— слабая кислота, концентрация ионов 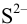 , т. е. условия осаждения, зависят от pH раствора. Поэтому найдем интервал pH, обеспечивающий указанные концентрации
, т. е. условия осаждения, зависят от pH раствора. Поэтому найдем интервал pH, обеспечивающий указанные концентрации 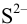 , используя выражение (2.5).
, используя выражение (2.5).
Предварительно вычислим молярные доли для иона S» в этих двух случаях при c(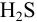 ) = 0,1 моль/л:
) = 0,1 моль/л:
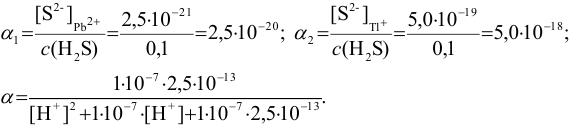
Решая последнее уравнение относительно 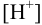 , получаем
, получаем 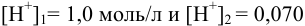 моль/л. Таким образом, в интервале pH от 0 до 1,2 в данном случае будут осаждаться только ионы
моль/л. Таким образом, в интервале pH от 0 до 1,2 в данном случае будут осаждаться только ионы 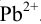 .
.
Пример 6.6.*
Установите возможность образования осадка 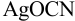 , если в раствор, содержащий
, если в раствор, содержащий 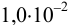 М
М 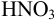 и
и 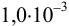 М
М 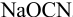 , ввести
, ввести 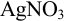 до концентрации
до концентрации 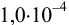 моль/л. Гидролизом ионов
моль/л. Гидролизом ионов 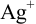 пренебречь.
пренебречь. 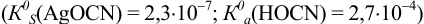 .
.
Решение:
Реакция образования осадка:
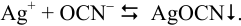
Условие осаждения: 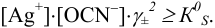
По величине ионной силы в исходном растворе, равной 0,011, находим 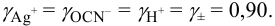 . Из условия задачи
. Из условия задачи 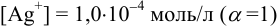 .
.
Равновесную концентрацию 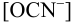 можно найти из системы двух уравнений (поскольку
можно найти из системы двух уравнений (поскольку 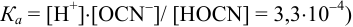 :
:
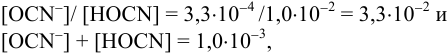
или предварительно вычислив 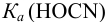 (пример 3.3).
(пример 3.3).
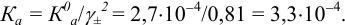
Учитывая, что 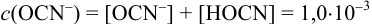 моль/л и молярная доля
моль/л и молярная доля 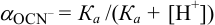 , с учетом уравнения (2.4) находим
, с учетом уравнения (2.4) находим 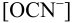 :
:
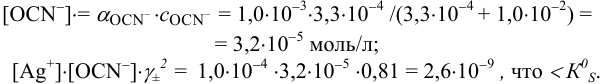
Осадок не выпадет.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

