Оглавление:

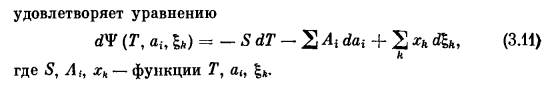

Определение свободной энергии для неравновесного состояния
- После того, как вы определили энтропию системы в неравновесном состоянии, вы можете определить свободную энергию V, используя ту же формулу, что и в равновесии state. By определение, в случае термически однородной системы (3.8).
Системы, у которых оболочка не препятствует обмену ни веществом, ни энергией, называются открытыми. Людмила Фирмаль
В случае термически неоднородной системы свободная энергия равна сумме свободной энергии термически однородной части. Разница в свободной энергии 2 неравновесных состояний равна работе, необходимой для перехода системы из одного состояния в другое полустатическим и изотермическим способом (с учетом включения работы, равной энергии потенциального поля), которая реализуется введением поля внешних сил (П. Это поле).
- Действительно, свободная энергия 4f * = E * — TS при наличии силы (относительно квазистатического перехода) (3.4) d’V * = — SdT — ’ZAₗdaᵢ -’ Z ^ dxK. (3.9) разность значений свободных энергий двух состояний равна работе изотермических квазистатических переходов между этими состояниями.
Свободная энергия в неравновесном состоянии равна В = Е-Ц = Е * + — Ц = В * + 2 ^、 (3.10) Из T получается вычитание работы, выполняемой системой при включении силового поля, а из P =равной потенциальной энергии этого поля- (3.9) и (3.10).
Теплопроницаемую оболочку называют также диатермической; если такая оболочка препятствует обмену веществом, то соответствующую систему называют закрытой. Людмила Фирмаль
Процесс, характеризующийся внутренними параметрами свободной энергии (необратимой или обратимой) Удовлетворяет уравнению дв (т, а,,£) = — СДТ-+ 2 ** Где S, Aₕxk-функция от T, a,,£. З. И.
Смотрите также:
| Отрыв пограничного слоя | Изменение энтропии при необратимых процессах |
| Пограничный слой | Изменение свободной энергии при необратимых процессах |

