Оглавление:
Окислительно — восстановительные реакции (овр)
Задача 50.
Закончить уравнения реакций и уравнять их используя метод электронного баланса. Указать окислитель и восстановитель:
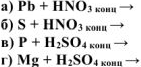
а) Металл + 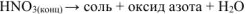
Формула оксида азота зависит от активности металла:
- в основном выделится
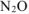 , если в реакцию вступает активный металл (стоящий в ряду стандартных электродных потенциалов в интервале
, если в реакцию вступает активный металл (стоящий в ряду стандартных электродных потенциалов в интервале  );
); - в основном выделится NO, если в реакцию вступает металл средней активности
 ;
; - в основном выделится
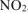 , если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
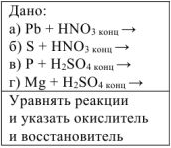
Решение:
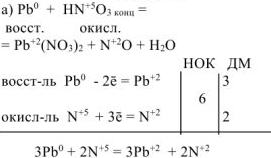
Переносим полученные коэффициенты в молекулярное уравнение:

Поскольку азотная кислота расходуется не только на получение
2 моль 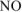 , но и на получения 3 моль
, но и на получения 3 моль 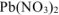 , в которых содержится
, в которых содержится 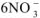 со степенью окисления
со степенью окисления 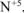 , то для протекания этого процесса необходимо дополнительно 6 моль
, то для протекания этого процесса необходимо дополнительно 6 моль 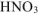 .
.

Суммируем число моль 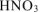 и уравниваем количество водорода и кислорода
и уравниваем количество водорода и кислорода 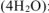 :
:
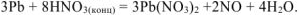
б) Неметалл + 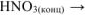 кислота, в которой неметалл проявляет высшую степень окисления +
кислота, в которой неметалл проявляет высшую степень окисления + 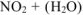 :
:
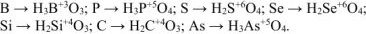
Решение:
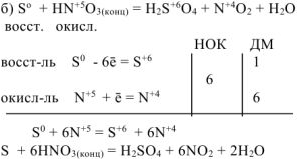
в) Неметалл + 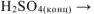 кислота, в которой неметалл проявляет высшую степень окисления +
кислота, в которой неметалл проявляет высшую степень окисления + 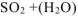
Решение:

г) Металл + 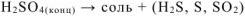
(в зависимости от активности металла) + 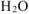 .
.
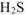 выделится, если в реакцию вступает активный металл
выделится, если в реакцию вступает активный металл 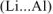 ,
,- S выделится, если в реакцию вступает металл средней активности
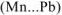 ,
, 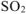 выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
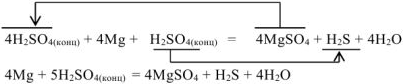
Решение:

Аналогично примеру (а) уравниваем реакцию:
Задача 51.
Уравнять реакцию. Указать окислитель и восстановитель.
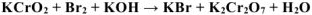
Определить массу 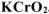 , необходимую для взаимодействия с 4 г брома.
, необходимую для взаимодействия с 4 г брома.

Решение:
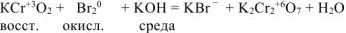

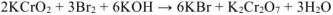
Согласно уравнению реакции 2 моль 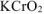 реагирует с 3 моль
реагирует с 3 моль 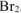 , т.е.
, т.е.
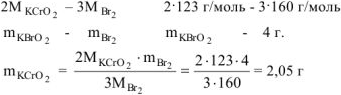
Ответ: окислитель — 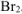 , восстановитель —
, восстановитель — 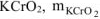 2,05г.
2,05г.
Задача 52.
Уравнять реакцию. Указать окислитель и восстановитель:
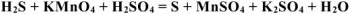
Определить 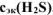 , если на взаимодействие с 3,16 г
, если на взаимодействие с 3,16 г 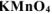 израсходовано 200
израсходовано 200 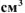 раствора
раствора 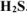 .
.

Решение:

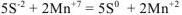
Переносим полученные коэффициенты в молекулярное уравнение:
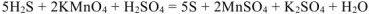
Подсчитываем количество 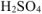 необходимое для получения 2 моль
необходимое для получения 2 моль 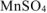 и 1 моль
и 1 моль 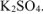 . Для этого необходимо 3 моль
. Для этого необходимо 3 моль 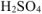 :
:
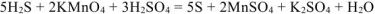
Уравниваем количество водорода и кислорода 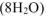 :
:
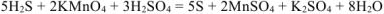
По закону эквивалентов 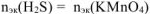

где 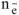 — число электронов, принятых одной молекулой
— число электронов, принятых одной молекулой 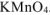 .
.
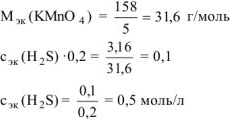
Ответ: окислитель — 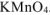 , восстановитель —
, восстановитель — 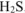 ,
,
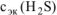 = 0,5 моль / л
= 0,5 моль / л
Задача 53.
Определить направление протекания реакции:
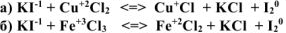
Расставить коэффициенты, указать окислитель и восстановитель.
Вычислить константу равновесия реакции при стандартных условиях.
Дано:
Уравнение реакции.
Уравнять реакцию и указать окислитель и восстановитель. Определить направление протекания реакции.
Кс-?
Решение:
а) Для того, чтобы определить направление протекания окислительно-восстановительной реакции, надо сопоставить силу окислителей для следующих полуреакций (см. таблицу)

Из двух приведенных окислителей более сильным окислителем будет 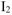 , поскольку
, поскольку 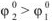 .
.
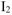 находится в продуктах реакции, следовательно, реакция будет протекать справа налево т.е. реально протекающей будет реакция:
находится в продуктах реакции, следовательно, реакция будет протекать справа налево т.е. реально протекающей будет реакция:
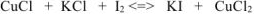
Расставляем коэффициенты методом электронного баланса:
где z — число отданных или принятых электронов (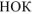 = 2);
= 2); 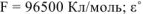 — стандартное напряжение ОВР, В
— стандартное напряжение ОВР, В
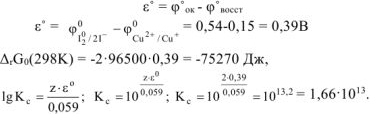
Ответ: окислитель — 12; восстановитель —  , приведенная в условии задачи реакция (а) протекает справа налево,
, приведенная в условии задачи реакция (а) протекает справа налево, 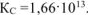 .
.
б) Из таблицы определяем стандартные электродные потенциалы окислителей для реакции
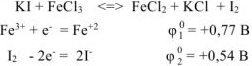
Из двух приведенных окислителей более сильным окислителем будет 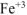 , поскольку
, поскольку 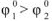
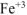 находится в исходных веществах, следовательно, реакция будет протекать слева направо т.е. реально протекающей будет реакция (б), приведенная в условии задачи:
находится в исходных веществах, следовательно, реакция будет протекать слева направо т.е. реально протекающей будет реакция (б), приведенная в условии задачи:
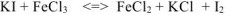
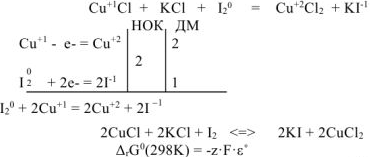
Расставляем коэффициенты методом электронного баланса:

Поскольку после реакции образуется четное число атомов иода, значения НОК и ДМ удваиваем.
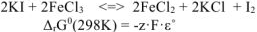
где z — число отданных или принятых электронов (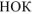 = 2);
= 2); 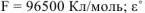 — стандартное напряжение ОВР, В
— стандартное напряжение ОВР, В

Ответ: окислитель — 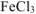 ; восстановитель —
; восстановитель — 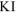 , реакция протекает слева направа,
, реакция протекает слева направа, 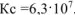 .
.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Растворы сильных и слабых электролитов задачи с решением |
| Гидролиз солей задачи с решением |
| Гальванические элементы коррозия металлов задачи с решением |
| Электролиз растворов задачи с решением |

