Оглавление:











Окислительно-восстановительные реакции
- Окислительно-восстановительная реакция. Все процессы неорганической химии можно разделить на 2 типа. А)действовать без изменения валентности реагирующего элемента и Б) действовать с изменением валентности. Первые примеры их включают различные случаи обмена атомов или неонов, уравнения которых обычно очень просты. 2-й тип включает реакции замещения(V§ 8) и во многих других случаях очень сложные химические реакции. processes.
- To быстро и правильно сформулировав уравнения таких реакций, необходимо овладеть специально разработанной методикой. 2-й тип реакции называется окислительно-восстановительной реакцией, или короткой (хотя и не совсем точной) реакцией окисления. Первый * Мэддок А. Д.. Достижения в области химии. I960. NV 11.IJS*.Неффедов В. Д. нос вам. В. .. Т о р о 8 и М. А. Х и.1 К и В. А. успехи в химии. Л * 2.
Первоначально было понятно, что окисление означает только добавление кислорода к веществу и его удаление. Людмила Фирмаль
Понятия «окисление» и «восстановление» можно существенно обобщить, учитывая, что кислород почти всегда притягивает к себе электроны от элементов, которые соединяются с it. As в результате, суть окисления заключается в потере электронов оксидом. Наоборот, когда восстановят!!!!Получите ранее возвращенное electrons. As в результате сущность восстановления заключается в n, который связан как электронами, так и восстановительными веществами.
Для дальнейшего вывода не имеет значения, полностью ли электрон переходит от 1 атома к другому (ионная связь) или более или менее расширен (полярная связь).Таким образом, этот раздел описывает возврат или присоединение электронов, независимо от фактического типа валентного электрона coupling. In в целом окислительно-восстановительные реакции можно определить как процессы, связанные с переходом электронов от одного атома к другому.
Рассмотрим ряд соединений хлора. Нет! C12 C120 C \ \ 207 В гидрохлорид, хлор-это отрицательно однокорпусное. В молекулах С12 заряд каждого атома равен нулю, так как ни один атом не притягивает больше электронов, чем другие. На С120 хлор снова одновалентен, но он уже стал агрессивным. С CI2O7 хлор имеет положительную 7-валентность.
Схематически все это можно представить следующим образом. — Я о + | +7 НС1 С12 C120 C1207 А Б В Г Д Электрохимическая валентность (состояние окисления) отдельных атомов, определяемая этим методом, может не совпадать с обычной (структурной) валентностью. Например, для молекул C1-C! Каждый атом хлора электрохимически неэффективен, но структурно он одновалентен.
Поэтому, чтобы избежать путаницы, рекомендуется говорить о значении атома, а не об электрохимической валентности, применительно к участникам окислительно-восстановительного процесса. Как только они установлены, они обычно двигаются вперед от зависимости+1 для водорода и −2 для кислорода.
Говоря о переходе хлора из состояния а в состояние G, можно сказать, что при переходе из B в G, 6 электронов, из B в G, 7 электронов, мы отказываемся от 8 электронов. И наоборот, при переходе от Г К В каждый атом хлора объединяет 6 электронов от Г до B, 7 электронов и 8 электронов от/ *до А.
Вещества, содержащие элементы, соединяющие электроны, называются окислителями. Вещество, содержащее электронодонорный элемент, является восстановителем. От 3 до 4 Чтобы сформулировать уравнения окислительно-восстановительных реакций, сначала нужно знать химическую формулу вводимых в них веществ и продуктов.
Конечно, первое мы знаем, но второе должно быть установлено либо специальными химическими исследованиями, либо на основе известных свойств элемента. Однако, поскольку окислительно-восстановительные процессы обычно происходят в водных растворах, часто невозможно непосредственно определить, участвует ли вода в реакции, и это становится очевидным только тогда, когда формулируется уравнение.
Самым простым примером окислительно-восстановительного процесса является реакция замещения. Рассматриваются следующие вопросы Насколько сложным является взаимодействие раствора хлорной кислоты с элементом фосфором? Изучение продуктов этой реакции показывает, что в результате взаимодействия H3PO4 и HCI являются formed. So … НСУе + р-h3po4 + HCI ( I)
Найти обвинения в изменении значимости элементов и переписывании съеденного и И И и над мной: Нсуз + П- * 33Х4 + НС! (Второй) Из уравнения (II) видно, что значение хлора уменьшилось с −5 до −1.A в результате NSSC является окислителем, и в процессе реакции 1 его молекула (точнее, хлор) связывает 6 электронов.
Значение фосфора, с другой стороны, увеличилось с 0 до+5.So, фосфор является восстановителем, каждый атом которого испускает 5 электронов. Заметим, что под соответствующим веществом мы получаем: HCIO3 + P-H3PO4 + HCI (III) Тсс. Но все молекулы обоих веществ, участвующих в реакции, и полученные молекулы электрически нейтральны.
Поэтому общее число электронов, выделяемых в ходе реакции восстановителем, должно быть равно общему числу электронов, присоединенных окислителем. Отсюда мы находим главный коэффициент уравнения-коэффициент окислителей и восстановителей: 5NSSU3 + 6Р — * Н3РО4 + ТХП(ИЖ) [б] | _5 |
Теперь проверьте количество атомов в каждом элементе обеих частей уравнения и поместите соответствующий коэффициент(рекомендуется начинать проверку с элементов, которые меняют свою значимость во время реакции. Водород и особенно кислород, если они не включены в уравнение как простое вещество, обычно должны быть проверены в конце).
Используя коэффициент, уравнивающий число атомов C1 и P в обеих частях, получим следующую формулу: 5NSSYuz + 6P — * 6H3RO4 + 5HCI(V) Если вы проверите водород, вы увидите, что на правой стороне больше водорода, чем на левой. Так как свободный водород не был введен в систему, это означает, что вода участвует в реакции.
Так, в конце это будет выглядеть так: 5 HCIO3 + 6P + 911.0 = 6H, P04 + 5HCI(VI) Проверьте кислород, мы в этом уверены.5 что уравнение является правильным Если кратко сформулировать вышеизложенный анализ, то при создании уравнения окислительно-восстановительной реакции мы получим следующую логическую последовательность мыслительных операций(попутно взаимодействие AS2S3 и HNO3 рассматривается как более сложный пример):
I. установите формулу вещества, возникающего в результате реакции. As2S3 + HNOj — * HjAS04 + H2SO4 + NO П. Мы определяем важность элементов, которые изменяют его до и после реакции: + 3-2 D. L + 5. +6 +2 AS2S3 + HNOs — * H3ASO4 + H2SO4 + NO III. подсчитайте количество электронов, отданных молекулой окислителя в сочетании с молекулой восстановителя: + 3 −2 +5 +5 dc +2 As2S3 + HNO3-H ^ As04 + H2SO < + NO 2.2 + 8.3 jTj 1( ИЖ.
Найти основной коэффициент, то есть коэффициент окислителя, и восстановить гель: 3As2S3-f 28HNO3 — > HvAs04 + H2S04 + NO я-2 * — я-ГЗТ V. Проверьте атомный номер каждого элемента исходного материала и продукта реакции (пока нет водорода и кислорода), установите коэффициент и уравняйте его. 3As2S3 + 281INQ3-6113AsOj + 9H2SO4 + 28NO VI.
Проверьте водород и узнайте количество молекул воды, участвующих в реакции:、 3As, S3 + 28HN03 + 4H20 = 6113As04 + 9H2S04 + 28NO VII. Проверьте кислород и убедитесь, что уравнение настроено правильно. Излишне говорить, что нет необходимости переписывать реакцию несколько раз, и все вышеперечисленные операции выполняются последовательно с использованием одного и того же уравнения(с определенным навыком в виду).
Признаком правильности размещенных коэффициентов является то, что число атомов в каждом элементе по обе стороны уравнения равно. Приведенная выше методика составления уравнения окислительно-восстановительной реакции может быть применена непосредственно к большинству реально встречающихся процессов.
Однако в особых случаях это следует уточнить еще больше. Наиболее важные из этих случаев будут описаны ниже. А) если имеется общий большой делитель между числом электронов, отданных восстановителем, и числом электронов, присоединенных окислителем, то при нахождении основных коэффициентов оба числа делятся на него.
Например, реакция НСУ3 + H2S-НС1-t-h2s04 Тсс. Основными коэффициентами являются не 8 и 6, а 4 и 3.Если же, наоборот, число электронов, участвующих в реакции, нечетное, и в результате получаются различные атомы четных чисел, то основной коэффициент равен 2 times. So, для реакции FeS044-HN03 + H2S04 — * Fe2 (S04)3 + NO Hm GzT Основными коэффициентами являются не 3 и I, а 6 и 2.Окончательно、 6Fe SO4 + 2HN03 + 3112 S04 = 3Fe4S04) j + 2NO + 4H2Q Б. окисляющего или восстанавливающего агента тоже потребляемого продукта.
Например, если мы обсудим из предыдущего примера, во время реакции (в зависимости от стадии I-IV уже выполненной) +2 +5 +5 +3 +5 +2 3Fe(с бортовым номером 03)2 + HN03 — * Фе(с бортовым номером 03) 3 + ч0 ГП | 3 | На каждые 3 молекулы восстановителя-Фе(с бортовым номером 03) молекулы 2-1 агента-HN03-окислительные должны быть использованы.
Однако если сравнить левое и правое вещества формулы, то можно увидеть, что при переходе от Fe (N03h) к Fe (N03) 3 и каждой молекуле восстановителя 1 молекула HN03 должна быть потрачена на дополнительное связывание железа. Поэтому, азотная кислота вообще необходима.1 молекула на окисление плюс 3 молекулы на связь, то есть только 4 молекулы.
Уравнение принимает вид: 3Fe (N03) 2 + HN03 + 3HN03 — * Fe (NOj) 3 + NO ИА Окса-Саяэ-Ленке автобус Наконец(после стадии V и VI): Существуют аналогичные примеры восстановителей в реакции 3Fe (N ’ 03) 2 + 4HN03 = 3Fe (N03) 3 + NO + 2H20 KgMpOTs + 4NO — * Ks1 + Mps!2 + С12 Тсс. Здесь мы находим, что в дополнение к 4 молекулам HCI, которые реагируют в качестве восстановителя, необходимы еще 4 молекулы для связывания 2K ’и Mn. K2Mp04 +4НС1 + 4HCI — * КС1 + mnci2 +С12 sma noah восстанавливается.
И напоследок: K2Mp04 + 8NS1 = 2KS1 + MpS12 + 2S12 + 4N20 В) оба элемента-и донор, и присоединенный электрон — находятся в одной и той же молекуле n. Это включает разложение веществ и одновременное превращение их в соединения одного и того же элемента более высокого и более низкого значения (так называемые инвариантные реакции).
Простейшим примером дисмутаинина (в других случаях диспропорционирования) является взаимодействие хлора с водой. С12 + Н20 = НС1 +нос! 。 D) окислитель (или восстановитель) представляет собой пероксидное соединение. Такие соединения обычно являются производными перекиси водорода и ведут себя аналогично последнему(IV§ 5).
Чтобы найти главный коэффициент, такой процесс рассматривается как бы идущий справа налево. Людмила Фирмаль
В молекулах H_O_O_HMOLECULES связь между атомами кислорода неполярна, поэтому значение каждого из них равно −1. Вследствие окислительного разложения H202 значение кислорода становится равным −2, а при уменьшении его до zero. So, в самом деле, в другом случае перекисная группа-О-О-соответствует 2 электронам. Ю-Б-В-Некрасов В заключение необходимо кратко описать зависимость окислительно-восстановительного процесса от реакции среды.
Чаще всего тот или иной окислитель или восстановитель существует только в определенной среде (кислой или щелочной).Сам процесс протекает более или менее активно в зависимости от его кислотности(щелочности).Влияние природы среды настолько велико, что возможны изменения в направлении процесса. Например, взаимодействие по схеме Я-щелочь. — год 312 + 3ч, 0 = = Неве + 5×1 х— В кислой среде В щелочной среде двигайтесь вправо, а в кислой среде-влево.
На самом деле, серная кислота чаще всего используется для создания кислой среды в растворах(первый может окисляться, а второй сам является окислителем, поэтому HCl и HNO3 используются не очень много. Поэтому побочные реакции могут возникать в обоих случаях).Как правило, вы используете NaOH или KOH для создания щелочной среды. Вещество, из которого создается та или иная среда, не всегда входит в конечное уравнение реакции.
Например, рассмотрим следующий случай окисления KMp04 в щелочной среде: Я так * 4-KMn04 + Кох-K2SO4 4-Mn02 второй с 4-KMn04 4-ко-K2S04-fMn02 в III Н2Ѕ + KMn04-Ф ко-K2S04 + Mn02 Если найти основные коэффициенты и уравнять число атомов, изменяющих свою значимость в процессе реакции, то получим: 3S02-f 2KMn04 + K0N — * 2K2S04-f 2MnOg S + 2KMn04 4-KOH — * K2S04 2Mn02 3H2S2 + 8KMn04 + KON — ► 3K2S04 + 8Mn02 Теперь осталось только начать проверку количества атомов вещества, которое создает определенную среду (пока без водорода и кислорода).
Если уравнять число атомов калия: 3S02 + 2KMp04 + 4KOR — ► 3K2S04 + 2Mn02 S-f-2KMp04 — * K2S04 4-2Mn02 3H2S4-8KMn04 — * 3K2S4 4-8Mn02 4-2KON Наконец, после выравнивания водорода и кислорода、 Поэтому щелочь или кислота, вводимые в систему для создания специфической среды, ведут себя подобно воде: она может расходоваться во время реакции(случай I), не участвовать(случай II) или за счет нее (случай III).17-19. Добавь !Интересно, что если заменить электронного слона слоном-флогистоном в определении тела, то теория флогистона автоматически выражается(i§ 1).
Последнее, таким образом, обеспечило интерпретацию более общего (хотя и формального) окислительно-восстановительного процесса, чем кислотная теория лабоажа, которая заменяет it. It именно это широкое толкование определило успех теории флогистона, несмотря на неоднозначную природу самого флогистона.
2) отчетливо проявляется значительная (окисленное состояние) несогласованность валентностей и структурных валентностей, особенно в тренде хлорирования метана: все они предполагают, что валентность углерода ω равна 4 и, в силу своей значимости, значения водорода и хлора равны+1 n-1 соответственно.、 −4 −2 о +4 CH * CH3Cl CHtCU CHClj CCl4 Аналогично, присвоение значения+1 водороду и значения −3 водороду дает+2 углерода (из-за электрической нейтральности молекулы).
3) простейшей окислительно-восстановительной системой является электролитическая установка (рис. VI1-20), в которой катод всегда обеспечивает электронами свои ионы. То есть он действует как восстановитель, и анод всегда удаляет из них ионы. То есть он действует как окислитель. Обратите внимание, что электролиз является самым мощным и универсальным из всех доступных окислительно-восстановительных химий.
4) при использовании окислителя и восстановителя удобно использовать нормальную концентрацию. Нормальный раствор окислителя или восстановителя означает раствор, содержащий 1 грамм молекулы, что соответствует 1 грамму нормального окислительного веса 1 литра («эквивалент окисления»), то есть 1 электрону, который дается или присоединяется к каждой молекуле.
Например, при использовании НСУз в качестве окислителя он восстанавливается до нс1 в ходе реакции, а величина хлора изменяется от + 5 до-I. То есть 1 из его атомов (и в результате 1 молекула nssc) связывает 6 электронов. Поэтому обычный раствор ГСК, как окислитель, содержит молекулу 1 л/грамм (и 1 г молекулы в виде кислоты).Все характеристики концентрации остаются прежними.
Аналогично обычному раствору кислот и оснований (v§ 5). 5) Следует подчеркнуть, что значения, приписываемые атомам соединений, по существу условны и никогда не соответствуют действительным эффективным зарядам этих атомов (III $ G).4).Такая плата нам практически неизвестна, и пока могут быть только более или менее достоверные оценки.
Однако характер внутримолекулярного распределения значений не влияет на коэффициенты окислительно-восстановительного процесса equation. So для реакции горения кислорода 4hcn 4-50 1icn 2НгО-f4coa + + 2nj рассчитываются основные коэффициенты 4 и 5 для каждой молекулы HCN, независимо от того, принимает ли она вышеуказанное (дополнительное 2) значение или другое (например, нулевое) value.
It само собой разумеется, что для распределения значений необходимо обеспечить электрическую нейтральность каждой молекулы. Что касается вопроса о фактическом протекании окислительно-восстановительных реакций в растворе, то существует монография. •
6) в редких случаях выбор коэффициента удобно начинать с атомов элементов, которые не меняют своей значимости. Например, светящаяся нодата * Поворот и т. к. механизм окислительно-восстановительного процесса reaction. In английский. А. И. Бутч. М.«Мир», 1963.233 С. Генератор Катод Восто N08LSNTSV Потеря материала для получения электронов Рисунок VI1-20.
Схемы электролитического окисления и восстановления. ♦5-2 + 7-2 О О Плохая ОЖ), — ► Ba5(я о +12 + 02 Если уравнять число непропорциональных атомов, то 5Ba(10 3) 2- * — Ba 5 (10 4) 2.Затем, принимая во внимание количество атомов йода и кислорода, мы, наконец, получаем следующее:5Ва (юе) s=Ва5 (Ю4)2 — ±4l2 + 902. Рекомендуется разделить сложный процесс на более простые.
Например, нитрат кобальта разлагается при нагревании по схеме ♦2 +5 −2 +3 −2 +4 −2 O Колорадо (Ной) а — * Co203 + с n02 + 02 То есть при восстановлении азота окисляются как кобальт, так и часть кислорода. Если вы ограничитесь кобальтом, то получите 2Co (N03) 2- * Coa03 + 4NO. Затем проверьте кислород. 2пк (с бортовым номером 03) 2- «- Co203-Ф 4Н ’ 02 + 0 найдено:4Co(с бортовым номером 03)* =. =2Со203 + 8n02 + о,. 7) поскольку полярность связей органических соединений мала, трудно определить, какие атомы KZ в молекуле положительно поляризованы, а какие-отрицательно.
Поэтому при составлении уравнения окисления органических соединений удобнее найти главный коэффициент, не считая непосредственно количества электронов, а предварительно определив количество атомов кислорода, необходимое для превращения первой молекулы в реакцию product. At в это время легко найти основные коэффициенты уравнения, так как мы знаем, что каждый атом кислорода, вступивший в окисление, соответствует переходу 2 электронов. Образцы.
При окислении этилового спирта (C * H $ OH) до уксусной кислоты (CH3COOH) в исходную молекулу вводится дополнительный атом кислорода, а из исходной молекулы удаляются еще 2 атома водорода. molecule. So, каждая молекула этанола потребляет 2 атома кислорода, что соответствует высвобождению 4 электронов. Это, по уравнению основной фактор вы найдете: ЗСаН3ОН+ +4КМпО«=ЗСнеСООК+4МпО,+КАН+4Н, 0
Пример 2.Благодаря действию KMp04 в кислой среде глюкоза полностью окисляется по схеме «С|Н / 20в-» — bC02+ bN20.Если мы подсчитаем количество атомов кислорода в глюкозе и продуктах ее окисления, то увидим, что на каждую молекулу глюкозы приходится 12 атомов кислорода. Это соответствует возврату 24 электронов, и в связи с этим мы находим основные коэффициенты уравнения: 5С «Н» 20в-f-24кмп04 36h2s04■»=. 12K * S04 + 24MnS04 + ZOSO,+ 66N20.
8) инверсия dnsmutation-это процесс, целью которого является выравнивание значений атомов в 1 к одному и тому же элементу(его реакция t a-qin).примером может служить пиролиз азота и аммиака. с + с NH4N02-2H20 + N、 9) так как вещество слева от приведенного в тексте уравнения почти Несвязано, а правая сторона, наоборот, сильно диссоциирована, то реакция формы войны такова: 3l2 +ЗНаО6Н ’+ Ioj-F 51’.Из этого видно, что кислотная среда должна предпочесть равновесную смесь левой(за счет увеличения концентрации ионов Н).
А щелочность-с правой стороны (для того, чтобы N * отверстие связывалось с OH-OH средой). 10) интересным примером полного обращения восстановленной кислородной функции соединения с относительно небольшим изменением рН является следующая реакция перекиси водорода. I, Н-5Н202 — ►2НЮ3 + 4н20prn PH-1 2Н103+5Н202 — ► 12 +6Н20+ 502 pr pH-2 В первом из этих процессов Н ^ О * действует как наполнитель, а во втором-как восстановитель.
11) соотношение между понятием со-восстановителя и со-восстановителя может быть выражено в схеме окислитель+электрон * * восстановитель. Например, в системе I7-f 2e 7 ″»»» IV свободный йод является окислителем, а V-ионы-восстановителем. Такая система подобна стандарту, с помощью которого устанавливается электродный потенциал металла (V§ 8 доп. 3).
12) в растворе, содержащем равные активные звенья окислителя и восстановителя (v§ 5-26), опускают платиновую пластину, если такой электрод совмещен с водородным электродом(рис. V-34), обычный окислительно-восстановительный потенциал(£ 0) этой системы. Эта возможность (в связи с тем, что были установлены другие методы) характеризует тенденцию некоторых окислителей связывать электроны или восстановителей к отдаче, по сравнению с водородом в стандартных условиях.
Если есть положительные признаки потенциала, то система преимущественно окислительная, а если есть отрицательные признаки, то она в основном восстановительная. Например, стандартный потенциал системы F,+ 2e = 2F-к Na + 2e = 2H-равен+2,87 и-2,25 е соответственно, и таким образом тенденция окисления молекул Ft значительна. И в случае не-н-редукции. Поскольку обе эти реакции протекают без участия ионов воды, их потенциал не зависит от рН среды.
Однако в большинстве случаев такая связь существует. Например, потенциал водородного электрода, соответствующий реакции 2Н — f2e*Н2 при рН = 0, равен 0,00 в(по определению), а в общем виде о Ian = » −0,06 рН, или −0,0. при рН = 7, при 42 в, РН = 14-0, 84 в (рис. V-35). в таких случаях для рассматриваемой системы часто задаются 2 значения потенциала: кислотный (рН = 0) и щелочной (рН =
14).Например, тенденция окисления различных активных форм кислорода характеризуется следующими данными: Окислитель Oz HjOj 02 «Я в кислой среде+2.42 + 2.07 +1.77 +1.23 Возможность[ I * щелочная среда+1.59 +1.24 +0.88 +0.40 Из этих династий видно, что наиболее ясная теория окисления выражается в атомах кислорода. Окислительный потенциал Н * 02 в кислой среде значительно выше, чем в щелочной, но его окислительная активность противоположна.
Реакции окисления в кислой среде обычно протекают медленно, в то время как в щелочной среде реакция окисления протекает быстро. Тенденция восстановления H ^ Oa характеризуется потенциалами+ 0,69 в (кислотная среда) и −0,05 в(щелочная среда). 13) Как правило, окислительно-восстановительные процессы происходят в водных растворах.
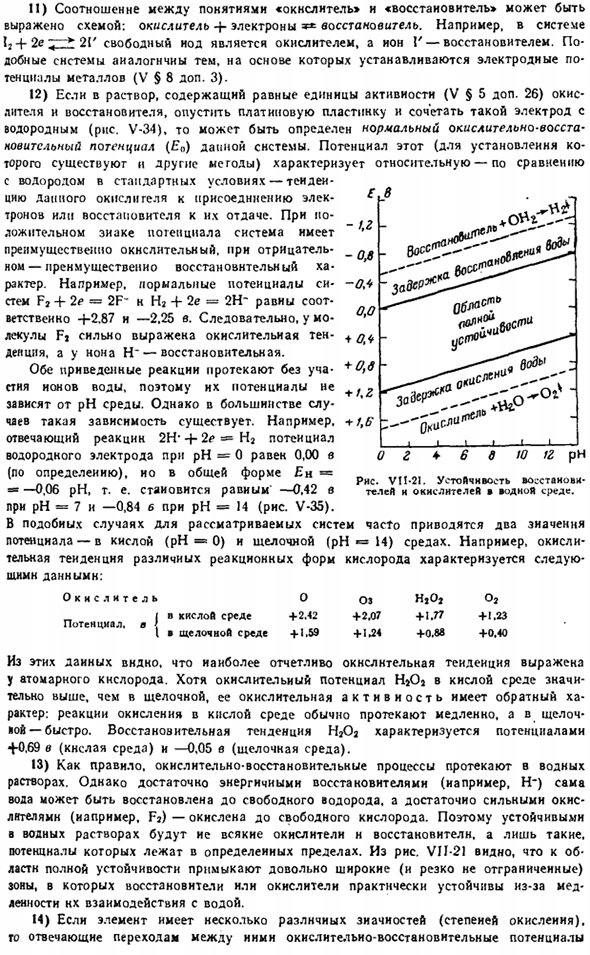
Однако при достаточном количестве энергетических восстановителей (таких как H) сама вода восстанавливается до свободного водорода, а достаточно сильный окислитель (такой как Fj) окисляется до свободного кислорода. Поэтому все виды окислителей и восстановителей стабильны в водных растворах, но на рис. VII-21 показано, что очень широкая (не резко разделенная) зона примыкает к области полного stability.
In эта область, она практически стабилизирована должная к медленному восстановителю или оксиданту. При взаимодействии с водой. 14) если элемент имеет несколько разную зиачность(степень окисления).Окислительно-восстановительный потенциал, соответствующий переходу между ними Е в кг — o, in-ol 0.0 + o, if +0.6+/, 2 + t. Six ^О < ри > с (Пи — 4-Б Д 10 изъ рН Да. Рисунок VI1-
21.Стабильность восстановителей и окислителей в окружающей среде. Это удобно представлять schematically. At при этом, как и в первом приближении, можно отвлечь внимание от некоторых веществ (обычно кислородных соединений), которые используются при установлении потенциалов.
Например, в случае галогенов такая примерная схема * теории приведена ниже(на рисунке выше показана кислотная среда, а на рисунке ниже показана щелочность). Диастность G-I 0 +1 +3 +4 +5 +7 ДИ ДЖЕЙ +1.36 {+1.63 ! + 1.36! +0.40! БР:+1.09! +1.59. 1 j+ 149 * +0.45 * | Я! +0.54 я +1.45 Джей _ я + У. 54 +0.45 \ * + 1.15 Дж +1.19 +0.30:+0.36 。 } +1.76 + 1.27 Дж + 1.16 я + 1.49 | + 0.54 я Я + 1.H I 1 +0.14 я + 1.04 +0.С6 Нормальный потенциал + 1.6 +0.6
Потенциал перехода, который не указан в такой схеме, часто может быть рассчитан на основе представленных данных. Например, для переходов flCIO » — » Cli в кислой среде、(+ 1.15 + 1.27+ 1.64-2 + 1.63):5 «+1.47 е. Взаимосвязь между окислительным потенциалом различных соединений галогенов четко показана на диаграмме. VII-22.In в частности, следует энергетическое обоснование примера, приведенного в основном тексте, где направление процесса зависит от реакции medium.
In кислотная среда, окислительный потенциал I? Ниже, чем IU, выше щелочной, чем IU^. для окислительного потенциала астатина при pI = 1 приведено значение ©. + 1л помощник тактика. NOS1 кислоты Ух… + Т Шол HB4 nde4 nsyu » СиДжей. !U1 Новг, 1С,°3 В граммах nude3 Нос Шелк средний vgo; y; ОГ, ОГ + На Q50 Сай.; сы; 1С * + ол + Мод ОС! ’ At0 В В По At*, вы должны четко понимать OAS.
15) при использовании окислительно-восстановительного потенциала следует помнить, что его величина зависит от активности (концентрации в первом приближении) окислительно-восстановительного типа этого свойства. Форма этой зависимости такова К-С, 0,06 (Охжнсл.) * О ±ЛГ-Р ^- N {Овосст. Г Здесь хна-это коэффициент окислителей и восстановителей, а an-количество электронов, переданных в основном процессе.
(Окси) * (а occr. Если он равен a) V, то фактический потенциал (£) может существенно отличаться от нормального (£<>).Особенно отчетливо такой сдвиг потенциала (обычно в отрицательную сторону) проявляется, когда 1 из форм так или иначе связан. Например, нормальным потенциалом системы является Ag + e-Ag + 0.80 E.
С другой стороны, плохо растворимые AgCI(PR 1•10-10), AgBr(PR-3•I0-w) или Agl(PR = s 4• Yu -«) уменьшаются до+0.22 в,+ 0.07 В и-0.15 е соответственно. Последняя цифра показывает, что серебро может вытеснять водород из раствора HI. 16) не менее важным является тот факт, что возможные процессы в отношении потенциальных значений всегда протекают с поразительной скоростью.
Например, шо окисляет HI уже в слабокислой среде(рН <7), но вероятный окислительный эффект НСО начинает проявляться только в сильно кислой среде (рН <1).Другой пример: в щелочной среде Ион ОС1 является одним из самых мощных окислителей 1, но Ион Су с высоким потенциалом фактически ничего не окисляет.
Поэтому окислительный и восстановительный потенциалы позволяют установить только основные возможности (при правильном использовании). И + г♦С + с + С Диаграмма VII-22.Схема окисления галогенидов связана. Спонтанное течение рассматриваемого процесса. Таким образом, фактические окислительно-восстановительные свойства вещества могут существенно отличаться от тех, которые задаются потенциальным значением теоретического значения.
Например, в водных растворах I * легко окисляет HaS, SOj и др., но NSCH <s nnm не реагирует. Результат. В этих условиях свободный йод является более сильным (точнее, более энергичным) окислителем, чем хлорная кислота. Обратная задача-возможность и установление других процессов НЛ при определенных условиях, естественно протекающих-может быть полностью решена с помощью окислительно-восстановительных потенциалов.
Это связано с практически самым важным илом. Имеются монографические сообщения об окислительно-восстановительном потенциале неорганических соединений. * 17) изменение температуры обычно влияет только на скорость окислительно-восстановительных процессов в растворе, но не изменяет его direction. An интересным исключением является взаимодействие теллура и щелочи: 3Te-6KOH-2KjTe-f KjTeOj + 3HjO.
При нагревании эта реакция протекает слева направо. Во время охлаждения-справа налево. 18) хорошим примером окислительно-восстановительного процесса, протекающего под действием Счетного (ультрафиолетового) излучения, является реакция по схеме: Fe » 4- Fe «» + Hg. In темные, очень медленно протекающие обратные реакции могут быть использованы для генерации тока (напряжение до 0,1 в).Поэтому рассматриваемая система в целом может играть роль фотоаккумулятора.
Коэффициент полезного действия незначителен, поэтому он практически не подходит для этой цели. Однако не исключена возможность нахождения и других технологически продвинутых процессов такого типа. 19) несколько отличается от приведенных выше случаев. Реакция сопряженного окисления. сущность КХ заключается в том, что некоторые окислительные процессы протекают только при одновременном развитии других аналогичных процессов с 1 общим участником (то есть актором), который является либо окислителем, либо восстановителем.
Вещество, реагирующее непосредственно с действующим лицом, называется индуктором, а вещество, реагирующее только в присутствии индуктора, называется акцептором. Например, HBrO *(действующее лицо в данном случае) непосредственно окисляет H2SO3, а H3ASO3-нет. Однако в смесях этих восстановителей он окисляется до h3aso3 (акцептор) с броматной кислотой и H2S03 (индуктор). Теория реакции сопряженного окисления начинается с того, что химические взаимодействия обычно не являются прямыми, а протекают по всему уравнению реакции, но через ряд промежуточных стадий (элементных процессов).
Например, уравнение HBrOj-Ф 3Н, С03 «3Н, поэтому» + Тгг Отражает результат реакции, но ничего не говорит о ее прогрессировании. Очевидно. Взаимодействие молекулы HBrO3 с 3 молекулами K3SO3 нельзя ожидать сразу, и развитие на этой стадии более вероятно: HBrOj-f H2SO, — H, SO «+ Hbroa, HBrOa-f HJSO J = H2S04 + HOBr NEWr + HjSOJ = » H2S04 + HBg
Если актер не может непосредственно реагировать с акцептором (HaAs03) в исходном состоянии (HBrO3), то такая реакция может быть возможна в промежуточном состоянии (HBrO3, NOVr).Это связано с наличием сопряженных реакций окисления. Они встречаются в химии гораздо чаще, чем кажется на первый взгляд. * V. защелка: состояние окисления элементов и их потенциал в воде и воде. АЙГЛ. ред. К. В. Астахова. М.. Мадатмилкт. Первый ИА. 39б с
Смотрите также:
| Адсорбция | Подгруппа марганца |
| Подгруппа брома | Сера |

