Оглавление:

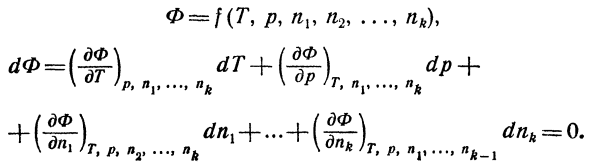



Общие условия равновесия в гомогенной системе.
- Однородные условия общего равновесия Система Как уже упоминалось выше, система Он состоит из 1 фазы и является однородным. Не столько. (полная взаимная растворимость).Если Не смесь или раствор Происходит химическая реакция, состав системы постоянен、 В таких системах компоненты находятся одновременно Это тоже компонент.
Система состоит из смеси жидких и твердых газов Раствор Людмила Фирмаль
Например, N2 и HJ, N2, O2 и Ar И так далее Особый интерес представляет термодинамика Химикаты Химическая реакция. Каково равновесное состояние системы Химическая реакция происходит между компонентами Частично? Сколько в пропорции Компоненты? Ответ на эти вопросы дают законы поведения. Количество активности, но прежде чем мы перейдем к этому выводу В законе мы находим общее условие равновесия такой системы.
- Учитывая, что происходит много химических реакций При постоянной температуре и давлении、 Система использует термодинамический потенциал Гиббса. Т). (8.11) Как известно, в равновесных системах Формула (8.11) указывает, что масса Компоненты системы остаются constant. In генерал、 Если масса компонента также изменяется, то: м Любовь = / Г \ п н Н2、 + (<«) ДП + r = const и/?Если= const, то Μ ( ^ ))
Удобно выводить однородные равновесные условия Людмила Фирмаль
Tnd dnk =° — (8> 12) В уравнении (8.12) частная производная dtii равна Химический потенциал.: Поэтому формула (8.12) проста Мы пишем следующее: 2My * = 0.(8.120 Сумма произведения химического потенциала Изменение массы каждого компонента равно нулю. В последнем уравнении масса представлена числом месяцев.
Молярные компоненты реакционной смеси Химическая реакция Выражено изменение количества родинок второго компонента Продукт ВДНХ. dn — это число преобразований в граммах. Грамм-эквиваленты реагентов. Тогда равенство (8.12 ’) Он принимает форму: 2 0.(8.12 «) Условие равновесия в развернутом виде Идеально подходит для газовых смесей. Чтобы проанализировать эту систему, необходимо Конкретное выражение по параметру внутреннего состояния Энергия?/ , Энтропия s, объем V
Смотрите также:
Решение задач по термодинамике
| Учение о термодинамическом равновесии в сложных системах. | Внутренняя энергия и энтропия смеси идеальных газов. |
| Правило фаз Гиббса. | Закон действующих масс. |

