Оглавление:




Мольный объем жидкости при температуре кипения
Мольный объем жидкости при температуре кипения. Определение молярного объема жидкости осложняется ассоциативными явлениями и вызывает значительные отклонения от аддитивного правила. Эффект сцепления уменьшается при температурах, близких к температуре кипения 7’I’ip и критической Tyr. Существует несколько правил расчета молярного объема жидкости при температуре кипения путем суммирования пропорций молярного объема. KMkip = 11.0©+ 7.8(О ’)+ 12.2(О ’)+ 5.5(П)+ + 22.8 (C1)+ 27.8 (Br)-| −37.5(1)+22.6(5)см ^ моль(11-1) Где 11.0-это доля.
Согласно правилам Коппа, расчет производится путем суммирования долей атомов, без учета разницы между методом связывания и группировкой этих атомов в молекуле. Людмила Фирмаль
- Число атомов углерода в молекуле. 7.8-совместное использование. (O’) это число атомов кислорода в молекуле, связанных с 2 атомами углерода 0^^. 12.2-разделение; (о») число атомов кислорода в молекуле, связанное с 1 атомом углерода 0 =С. 5.5-доля; (H) число атомов водорода. 22.8-общее; (С1) число атомов хлора. 27.8-доля; (Br) число атомов брома. 37.5-доля; I) число атомов йода. 22.6-доля; (8) число атомов серы. Рассчитайте молярный объем фурана при температуре кипения в Примере 11-2.Решение. ХК. \ Да. / НС = СН 1л.= 4•11.0 4-4■5.5 4-7.8 = 73.8 см ^ / моль Аппаратура Температура кипения KiKip 3= 76,3 см молярный объем раствора экспериментально наблюдался в Chmol. Погрешность расчета составляет 3,3%.
- По данным Шредера [4], молярный объем жидкости можно более точно рассчитать, используя значения следующих фракций: фтор 10,5; хлор 24,5; бром 31,5;йод 38,5;сера 21; кольцо 7.Тройная связь C = C 14 см ^ / моль обычно, по правилу сложения, дробь умножают на количество атомов или связей и суммируют. Результат расчета весьма удовлетворителен[5]: средняя погрешность расчета в 35 случаях составила 2,8%. Пример 11-3.Рассчитайте молярный объем этилпропилового эфира и бромбензола при температуре кипения. Решение. 1, C2H6-0-C3H7 K» k | / n = 18•7 = 126 см3!Литератор Найдено экспериментально ^ mK / W = 129 см.
Учитывая влияние встречи, молярный объем обычно определяется относительно точки кипения при нормальном давлении. Людмила Фирмаль
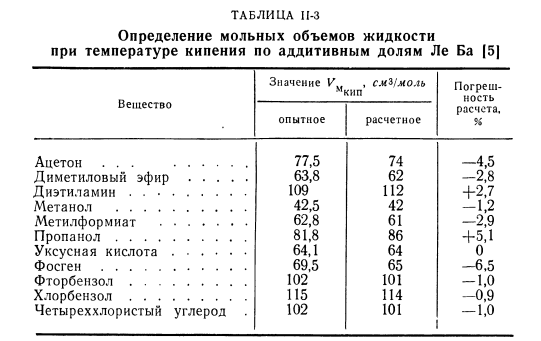
- Погрешность расчета составляет 2,3%. 2.С6Н5Вг KMkip =и. 7 + 31.5 + 3•7-7 ″ 1 122.5 моль на моль ^ mkip = 120 ЦМГ! М0Л. Погрешность расчета+ 2,0%. Часто используют таблицу молярных объемных долей, предложенную Le Ba (таблица N-2). Фракции для расчета молярного объема (см9 |моль) точки кипения{4 / Расчет Ле Ба дает лучшие результаты, чем Копп или Шредер. Точность расчетов показана в таблице. ЗАПРЕТНЫЕ ЗОНЫ. Таблица N-3 Определение молярного объема жидкости при температуре кипения по аддитивной части Le Ba / 5 | Значение В. Увидеть, Смол «Утепленные приборы Вещества Расчет Экспериментальная оценка% Ацетон… 77.5 74-4. Диметиловый эфир 63.8 62 −2.8 Диэтиламин 109112 +2,7 Метанол 42.5 42 −1.2 Метилформиат 62.8 61 −2.9 Пропанол 81.8 86 + 5.1 Уксусная кислота 64.1 64 0 Hosgen, 69.5 65-6.5. Фторбензола 102101-1.0 Хлорбензол 115114 −0.9 Четыреххлористый углерод 102101 −1.0
Смотрите также:
Возможно эти страницы вам будут полезны:

