Металлы. Краткие теоретические сведения
Металлами называются химические элементы и их простые вещества, обладающие металлическими свойствами. Физические свойства металлов — металлический блеск, сравнительно высокие тепло- и электропроводность и пластичность. Химические свойства металлов — их восстановительная способность:
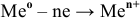
а) Действие кислорода на металлы
При обычных условиях взаимодействуют с кислородом активные щелочные и щелочно-земельные металлы, металлы, стоящие в ряду напряжений до Си включительно. Остальные малоактивные металлы, стоящие в конце ряда напряжений, с кислородом не взаимодействуют. Чаще всего образуется основный оксид.
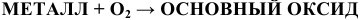
Примеры: 
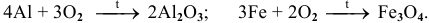
Рекомендую далее написать несколько примеров самостоятельно и запомнить общую схему.
б) Действие неметаллов на металлы
В большинстве случаев металлы взаимодействуют в тех или иных условиях с неметаллами, чаще всего с образованием соли по схеме:
МЕТАЛЛ + НЕМЕТАЛЛ  СОЛЬ
СОЛЬ
Примеры: 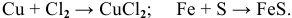
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
в) Действие водорода на металлы
Многие металлы, в том числе щелочные и щелочно-земельные взаимодействуют при нагревании с водородом и образуют гидриды металлов по схеме:
МЕТАЛЛ + 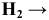 ГИДРИД МЕТАЛЛА
ГИДРИД МЕТАЛЛА
Примеры: 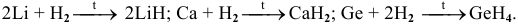
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
г) Действие воды на металлы
Щелочные и щелочно-земельные металлы взаимодействуют с водой при обычных условиях или в случае Mg при t = 100 °C по схеме:
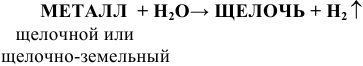
Примеры:
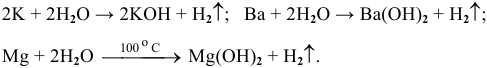
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
Менее активные металлы, стоящие в ряду напряжений до олова включительно, реагируют с водяным паром при высоких температурах по схеме:
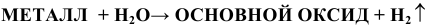
Примеры:
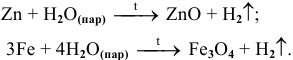
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
Остальные малоактивные металлы с водой не реагируют:
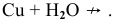
д) Действие кислот типа 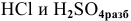 на металлы
на металлы
Металлы, стоящие в ряду напряжений до водорода, реагируют с обычными кислотами типа 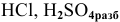 по схеме:
по схеме:

Примеры:
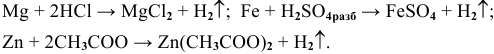
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
Металлы, стоящие в ряду напряжений после водорода, с вышеуказанными кислотами не реагируют:
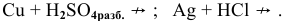
е) Действие щелочей на металлы
Типичные металлы не взаимодействуют с водными растворами щелочей. Водные растворы щелочей действуют только лишь на нетипичные металлы, оксиды которых проявляют амфотерные свойства, на такие как 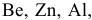 ,
, 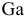 и др., по схеме:
и др., по схеме:

Примеры: 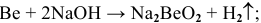 ;
;
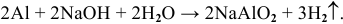
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
С расплавами щелочей в присутствии окислителя (например, кислорода воздуха) со щелочами реагируют многие металлы, проявляющие высшую валентность V, VI, VII и VIII по схеме:
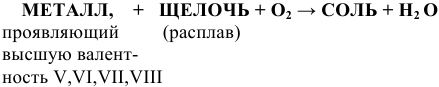
Примеры: 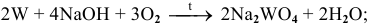
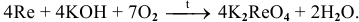
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
ж) Действие растворов солей на металлы
Более активные металлы согласно ряду напряжений вытесняют менее активный металл из его соли:
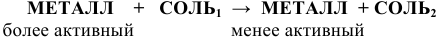
Примеры: 
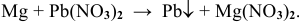
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
Получают металлы:
1) Действием при высокой температуре на оксиды восстановителей, таких как 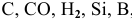 , по схеме:
, по схеме:

Примеры: 
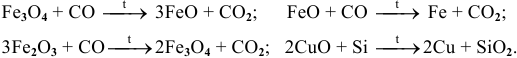
Рекомендую написать несколько примеров самостоятельно и запомнить общую схему.
2) Электролизом расплавов и растворов.
Электролизом растворов солей получают все металлы, кроме щелочных, щелочно-земельных и алюминия, последние получают электролизом расплавов их солей или оксидов.
Например: 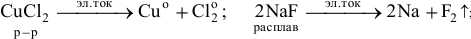
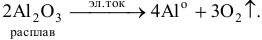
Рекомендую самостоятельно привести несколько примеров.
3) Действием более активного металла на водный раствор соли (см. п. ж «Действие растворов солей на металлы», подразд. 1.2 «Металлы. Краткие теоретические сведения»).
Эта теория взята со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Неметаллы в химии. Краткие теоретические сведения |
| Оксиды в химии. Краткие теоретические сведения |
| Кислоты в химии. Краткие теоретические сведения |
| Соли в химии. Краткие теоретические сведения |

