Оглавление:
Металлы III — IV группы
Задача 86.
Составить ионно-молекулярные и молекулярные уравнения гидролиза солей. Указать реакцию среды.
а) хлорида алюминия;
б) нитрата свинца (II).

Решение:
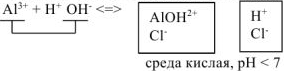
а) 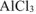 диссоциирует в водном растворе:
диссоциирует в водном растворе:
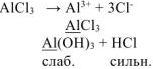
Сокращенное ионно-молекулярнное уравнение:
Молекулярное уравнение:
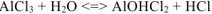
б) 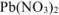 диссоциирует в водном растворе:
диссоциирует в водном растворе:
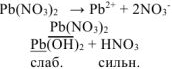
Сокращенное ионно-молекуляоное уравнение:
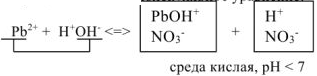
Молекулярное уравнение:
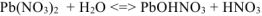
Задача 87.
Написать уравнения реакций, подтверждающие амфотерные свойства оксида свинца (II). Назвать продукты реакции.

Решение:
Амфотерные свойства 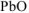 подтверждают реакции его взаимодействия со щелочью и сильной кислотой:
подтверждают реакции его взаимодействия со щелочью и сильной кислотой:
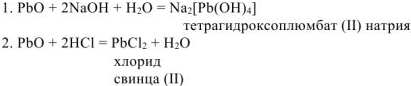
Задача 88.
Уравнять реакцию методом электронного баланса. Указать окислитель и восстановитель:
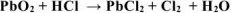

Решение:
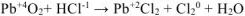
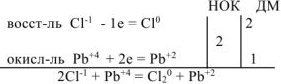
Переносим найденные коэффициенты в молекулярное уравнение, окончательно уравниваем его, учитывая при этом количество ионов 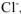 , необходимое для получения
, необходимое для получения 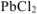 .
.
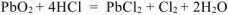
Задача 89.
Определить объем 1 и раствора гидроксида натрия, который расходуется на взаимодействие с 4,5 г хлорида алюминия при образовании тетрагидроксоалюмината натрия.

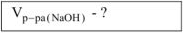
Решение:
Тетрагидроксоалюминат натрия образуется при протекании следующих последовательных реакций:

Ответ: 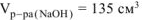
Задача 90.
Определить, образуется ли осадок хлорида свинца (II), если к 0,05 М раствору нитрата свинца (II) добавить равный объем 0,02 М раствора хлороводородной кислоты.

Решение:
При сливании растворов протекает следующая реакция:
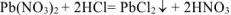
Осадок  образуется только в случае, если
образуется только в случае, если
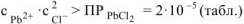
С учетом увеличения объема раствора при сливании в 2 раза:
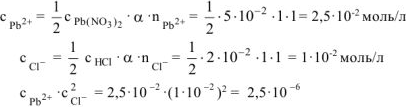
Так как 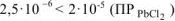 , то осадок
, то осадок 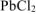 не образуется.
не образуется.
Ответ: осадок 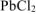 не образуется .
не образуется .
Задача 91.
Составить схему коррозионного ГЭ, возникающего при контакте оловянной пластинки, площадью 35 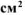 с медной в растворе хлороводородной кислоты. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
с медной в растворе хлороводородной кислоты. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 70 минут в процессе коррозии выделилось 1,5 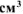 газа (н.у.).
газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 80 минут потеря массы корродируемого металла составила 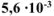 г. Плотность металла 7,3 г/
г. Плотность металла 7,3 г/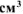 .
.
Решение:
По таблице находим значения стандартных электродных потенциалов олова (II) и меди (II):
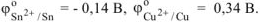
Так как 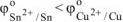 то анодом в коррозионном ГЭ будет олово, катодом — медь.
то анодом в коррозионном ГЭ будет олово, катодом — медь.
Составим схему коррозионного ГЭ:
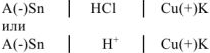
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
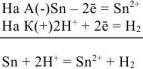
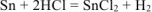 — суммарная реакция процесса коррозии.
— суммарная реакция процесса коррозии.
а)

Рассчитываем объемный показатель коррозии 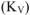 по формуле:
по формуле:
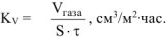
При расчете 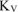 принимаем:
принимаем:
S — площадь поверхности анода, 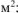 ;
;
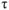 — время процесса коррозии, час;
— время процесса коррозии, час;
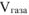 — объем выделившегося газа,
— объем выделившегося газа, 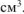 .
.
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, 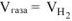
Тогда, 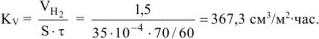
Рассчитываем весовой показатель коррозии 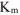 по формуле:
по формуле:
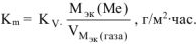
В процессе коррозии разрушению подвергается олово и выделяется водород.
Следовательно:
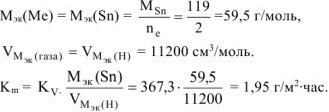
Ответ: 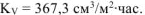 .
.
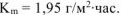
б)

Рассчитываем весовой показатель коррозии 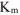 по формуле:
по формуле:
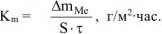
Коррозии подвергается олово.
Тогда потеря массы металла
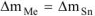
При расчете 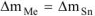 принимаем:
принимаем: 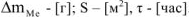 .
.
Тогда: 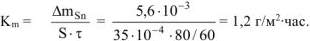
Рассчитываем глубинный показатель коррозии по формуле:
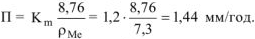
Ответ: 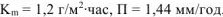 .
.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Жесткость воды задачи с решением |
| Высокомолекулярные соединения задачи с решением |
| Металлы V — VI группы задачи с решением |
| Металлы VII группы задачи с решением |

