Масса молекул
Масса молекул (за исключением молекул органических веществ, например, белков) очень мала. Так, масса молекулы воды составляет около 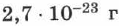 . Работать с такими малыми цифрами неудобно, поэтому в физике и химии принято выражать массы атомов и молекул в относительных единицах.
. Работать с такими малыми цифрами неудобно, поэтому в физике и химии принято выражать массы атомов и молекул в относительных единицах.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 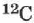 :
:
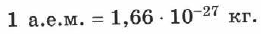
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества 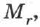 в единицу массы СИ (кг), пользуются формулой:
в единицу массы СИ (кг), пользуются формулой: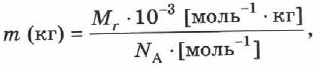
где 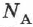 — постоянная Авогадро.
— постоянная Авогадро.
Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы: 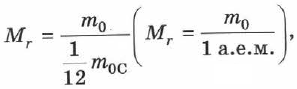
где 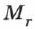 — относительная молекулярная (атомная) масса;
— относительная молекулярная (атомная) масса;
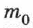 — масса молекулы (атома), выраженная в единицах СИ (кг);
— масса молекулы (атома), выраженная в единицах СИ (кг); 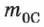 — масса молекулы изотопа углерода
— масса молекулы изотопа углерода 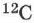 , выраженная в тех же единицах, что и
, выраженная в тех же единицах, что и 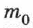 .
.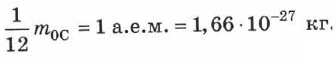
Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.), входящих в молекулу элементов. Например: 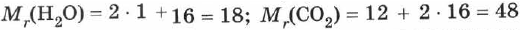 .
.
Атомные массы всех химических элементов точно измерены.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 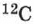 с атомной массой 12.
с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается 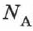 :
:
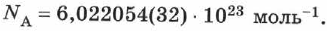
Постоянная Авогадро (число Авогадро) — это число атомов (молекул или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например в постоянную Больцмана.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества 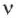 равно отношению числа молекул
равно отношению числа молекул 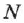 в данном теле к постоянной Авогадро
в данном теле к постоянной Авогадро 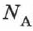 , т. е к числу молекул в 1 моле вещества:
, т. е к числу молекул в 1 моле вещества:
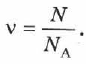
Молярной массой вещества 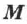 называют массу вещества, взятого в количестве 1 моль:
называют массу вещества, взятого в количестве 1 моль:
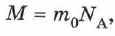
где 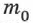 масса молекулы данного вещества.
масса молекулы данного вещества.
Поскольку для любого тела его масса 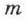 связана с количеством молекул
связана с количеством молекул 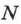 в нём соотношением
в нём соотношением
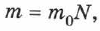
то из (2.1), (2.2) и (2.3) получим:
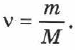
Количество вещества равно отношению массы вещества к его молярной массе.
Из (2.4) и (2.1) получаем: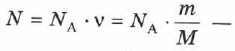
выражение для числа молекул в теле с массой 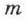 и молярной массой
и молярной массой 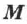 .
.
Эта лекция взята со страницы лекций по всем темам предмета физика:
Возможно эти страницы вам будут полезны:
| Звук в физике |
| Скорость звука в физике |
| Броуновское движение в физике |
| Диффузия в физике |

