Оглавление:

























Кристаллы
- Кристалл. При переходе вещества из жидкого (или растворенного) состояния в твердое могут иметь место 2 типичных случая. Есть вещества, которые выделяются как в виде более или менее крупных частиц определенной формы, так и в виде бесформенной массы. Первый тип твердых веществ(например, соль, сахар) называется кристаллами, а второй тип (например, клен, резина) — аморфным.
- Кристаллическая или аморфная природа вещества зависит прежде всего от его свойств, а затем от условий, при которых происходит переход в твердое состояние. Детальные исследования показали, что многие другие аморфные вещества на самом деле состоят из кристаллов, но настолько малы, что их нельзя увидеть даже под микроскопом.
Поэтому, изменяя эти условия, можно было получить даже типичное аморфное вещество, такое как резина или клей, в кристаллическом состоянии. Людмила Фирмаль
Итак, основой структуры твердого вещества является кристалл. На его размер сильно влияют условия кристаллизации, которая обычно осуществляется из раствора. Поскольку вы хотите получить мелкие кристаллы, быстро охладите насыщенный раствор при высоких температурах. Напротив, чтобы вызвать образование крупных кристаллов, раствор оставляют при комнатной температуре, так что кристаллизация протекает медленно по мере испарения растворителя.
По мере быстрого охлаждения насыщенного раствора во многих местах начинается кристаллизация (особенно при перемешивании).Это означает, что многие центры кристаллизации, то есть мельчайшие эмбриональные кристаллы, являются formed. As в результате медленного охлаждения число таких впервые возникших центров кристаллизации невелико, и дальнейшее выделение твердых частиц из раствора происходит преимущественно вблизи них, образуя кристаллы, которые значительно меньше, но больше по количеству.
Чтобы очистить соль путем перекристаллизации, обычно стараются получить мелкие кристаллы. Это связано с тем, что крупные кристаллы часто содержат маточный раствор, что приводит к снижению его purity. To исследуйте форму кристалла, наоборот, желательно сделать Кристалл достаточно большим. Наиболее характерной особенностью кристаллов является анизотропия. То есть свойства кристалла зависят от направления (прочности, теплопроводности, скорости растворения и т. д.).
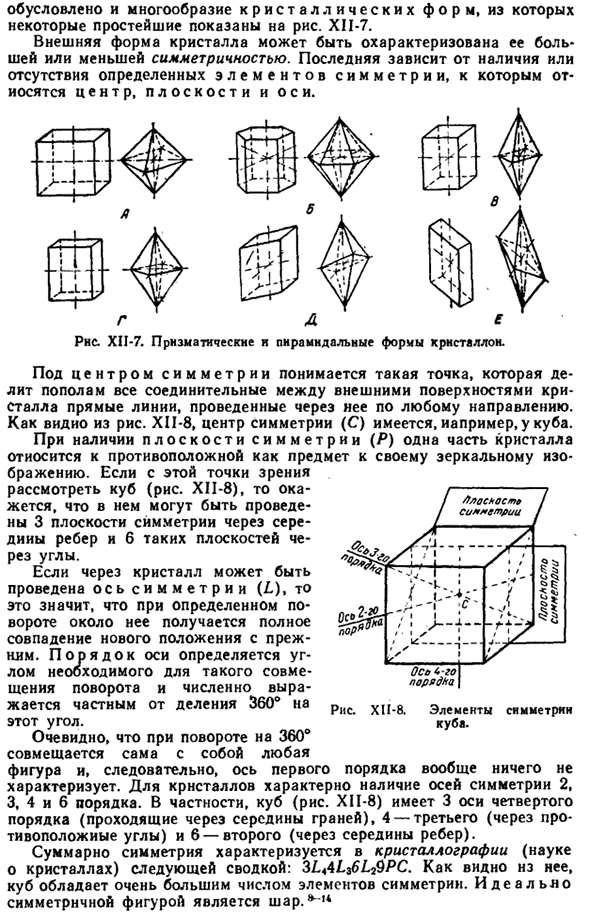
В частности, одинаковы, то есть от разных скоростей роста отдельных граней、 Также определены различные формы кристаллов, некоторые из самых простых из которых показаны на рисунке. XII-7. Внешняя форма кристалла характеризуется большой и малой симметрией. Последнее зависит от наличия или отсутствия определенных симметричных элементов, в том числе Центра, плоскости и оси. •- это ч- ф Рисунок XII-7.Призматический и пирамидальный Кристалл.
Центр симметрии означает точку, которая делит пополам все прямые линии, соединяющие внешнюю поверхность кристалла и проводится в любом направлении через Crystal. As как видно из рисунка XII-8, центр симметрии © находится, например, в кубе. Если существует плоскость симметрии (Р), то часть кристалла относится к объекту, противоположному зеркальному отражению. Если мы рассмотрим куб с этой точки зрения (рис. XII-8), то увидим, что 3 симметричные плоскости проходят через средние точки ребер, а 6 таких плоскостей проходят через углы.
Если ось симметрии (L)можно провести через кристалл, то это означает, что определенное вращение вокруг нее даст полное совпадение нового положения и предыдущего. Походка оси определяется углом, необходимым для такого сочетания поворота и числовых значений От расщепления на 360° Симметрия Этот угол является частным. Очевидно, с вращением на 360°、 Рисунок, следовательно, 1-го измерения ничего не характеризует. Кристаллы характеризуются наличием 2, 3, 4 и 6 осей symmetry.
In в частности, куб (рис. XII-8) имеет 4 следующие 3 оси (через середину грани), 3 оси (через противоположный угол), 6 осей (через середину ребра). В целом, симметрия характеризуется следующим конспектом в кристаллографии (кристаллографии): ZZA4L36L $ PC. As как видно из рисунка, куб имеет очень большое количество симметричных элементов. Идеально симметричная фигура-это шар. — г- С 0-го я закажу J Рисунок XI1-8. Элементы Куба.
Ранее отмечалось, что изучение внутренней структуры кристалла стало возможным только после 1912 года (III§ 8). Свойства частиц, заполняющих узлы пространственной решетки Кристалла(рис.111-55), могут быть очерчены на основе основных типов валентных связей. Именно поэтому в соединениях, построенных по ионному типу, кристаллическая решетка состоит из регулярно расположенных отдельно ионов (а, рис. XI1-9).
Наиболее характерным моментом такой решетки является то, что каждый ион применяется одинаково ко всем ионам непосредственно вокруг противоположного знака. Таким образом, индивидуальность отдельных молекул полностью теряется, и весь Кристалл становится, так сказать, огромной одиночной частицей(III§ 8).в отличие от ковалентных соединений, решетка состоит из отдельных молекул(B, рисунок XI1-9).
Схему Б на рисунке XI1-9 можно считать промежуточным случаем. Однако образование ионов здесь уже намечено, они все еще соединены друг с другом в отдельные части. pairs. As в результате решетка такой общей природы приближается к решетке молекул. Наименьший возможный объем пространственной решетки Кристалла, полностью отражающий все особенности структуры, называется элементарной ячейкой.
Весь Кристалл в целом может быть построен простым применением таких элементарных ячеек в 3 пространственных направлениях, как схематически показано. И / N 1 п } Рисунок XII -!!。Пример элементарной ячейки. Рисунок XI1-10.Поэтому, чтобы понять внутреннюю структуру конкретного кристалла, достаточно знать форму элементарной ячейки, ее размер и расположение частиц, образующих Кристалл.
Например, рассмотрим элементарную ячейку, показанную на рисунке 1. XII-11.Координатные оси a, b% c расположены под прямым углом друг к другу: a(т. е. r! СЭ) = п(я. е. ZbOc)= г(я. е. jLaOb)^ 90°.Отрезанные этими осями отрезки также равны, то есть a = b = c. эти соотношения (a = ($=y = 90°и a-b = c) определяют форму элементарной ячейки под consideration. It это кубик. Его размеры полностью определяются длиной одной стороны.
В качестве начала координат используются 3 координаты их центров(а, 6, С), а также угол ячейки, занимаемый 1 частицей. «ООО тфотд ООО©тдтдтд ООО» ООО тдтдтд ООО один Диаграмма XII-9.Схема ионных и молекулярных решеток. Схема построения кристаллов из элементарных ячеек. Число координат выражается в долях от соответствующего ребра единицы измерения cell. So, для частиц O и K (рис. XII-11) они будут соответственно (LLC) и (1/2 1/21/2).
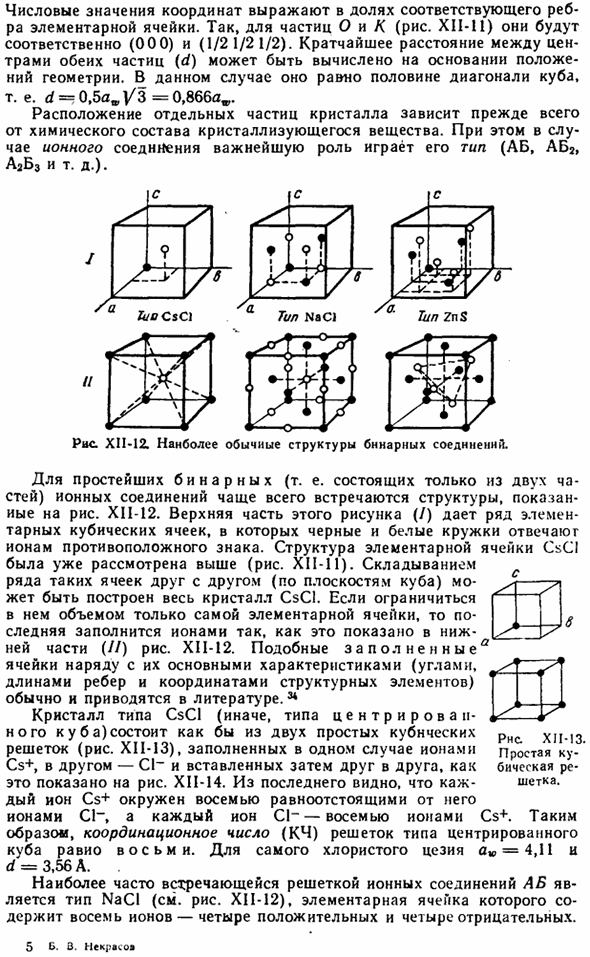
Кратчайшее расстояние (d) между центрами обеих частиц может быть вычислено на основе геометрии location. In в этом случае она будет равна половине диагонали куба, то есть d = 0.5 aw | / 3 = 0.866 aw. Расположение отдельных кристаллических зерен зависит в первую очередь от химического состава кристаллизующегося вещества material. In кроме того, в случае ионных соединений важную роль играет тип (AB, ABg, A2B3 и др.).
Рис хай-12.Наиболее распространена структура бинарных соединений. Для простейших бинарных (то есть состоящих всего из 2 частей) ионных соединений, рис. XI1-12.Верхняя часть этого рисунка ( / ) показывает ряд основных кубических ячеек, где черным и белым кругам соответствуют ионы противоположного знака. Структура элементарной ячейки CsCI уже была изучена выше (рисунок XI1-11). ^
Складывая ряд таких ячеек друг в друга (вдоль плоскости куба), можно построить весь Кристалл CSCI. Ограничившись только объемом самой элементарной ячейки, элементарная ячейка заполняется ионами, как показано в нижней части рисунка (//). XI1-12.Такая «заполненная» ячейка и ее основные характеристики (угол, длина ребер, координаты структурных элементов) обычно описываются в литературе.
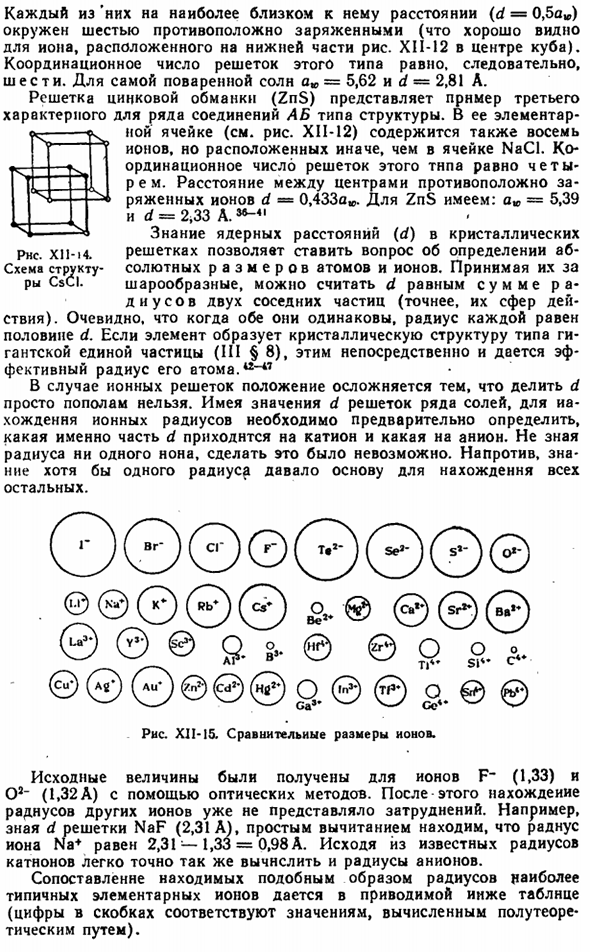
Тридцать четыре Тип кристалла CSCI(тип центрального Куба) состоит из 2 простых кубических решеток (рисунок XII-13), которые в одном случае заполнены другими ионами Cs ±CI-и вставлены друг в друга, как показано на рисунке XI1-14.Из последнего видно, что каждый ион Cs +равноудален от 8 C1-ионов, и каждый C1-Ион окружен 8 Cs +ions. So, координационное число (CN) центральной решетки кубического типа равно 8.
Для самого хлорида цезия a * = 4,11 и d = 3,56 А. Наиболее распространенной решеткой соединений ионов AB является тип NaCI (см. рис. XI1-12), а его элементарные ячейки содержат 8 ионов (4 положительных и 4 отрицательных). 5 Б-Б-Некрасов г / х? Цсци Рис X1I-I3.Простая кубическая решетка. Каждый из них на самом близком к нему расстоянии(d = 0,5 а*) заряжен 6 противоположно (это хорошо видно по ионам внизу рисунка XII-12 в середине Куба).
Таким образом, число регулировок для этого типа решетки равно 6.Наиболее жаркое солнце= 5.62 и d = 2.81 A Решетка цинковой обманки (ZnS) является примером 3-го структурного типа, который характерен для многих соединений AB. Элементарные ячейки (см. Рисунок XII-12) также содержат 8 Ионов, но они отличаются по расположению от ячеек NaCl. Этот тип решетки имеет номер регулировки 4.
Расстояние между центрами противоположно заряженных ионов составляет d = 0,433 ay. Для ZnS: a= 5.39 и d = = 2 * 33 A. 36-41 Зная расстояние зарождения (d) кристаллической решетки, можно поставить вопрос об определении абсолютных размеров атомов и ионов. Если рассматривать их как сферы, то можно предположить, что d равно сумме радиусов 2 соседних частиц (точнее, сфер их действия).
Очевидно, что если оба они одинаковы, то радиус каждого равен половине d. Если элемент образует кристаллическую структуру, такую как гигантская одиночная частица (III§ 8), это непосредственно дает ему эффективный радиус атома.42 ″ 47 Ситуация осложняется тем, что в случае ионных решеток просто невозможно разделить D в половину.
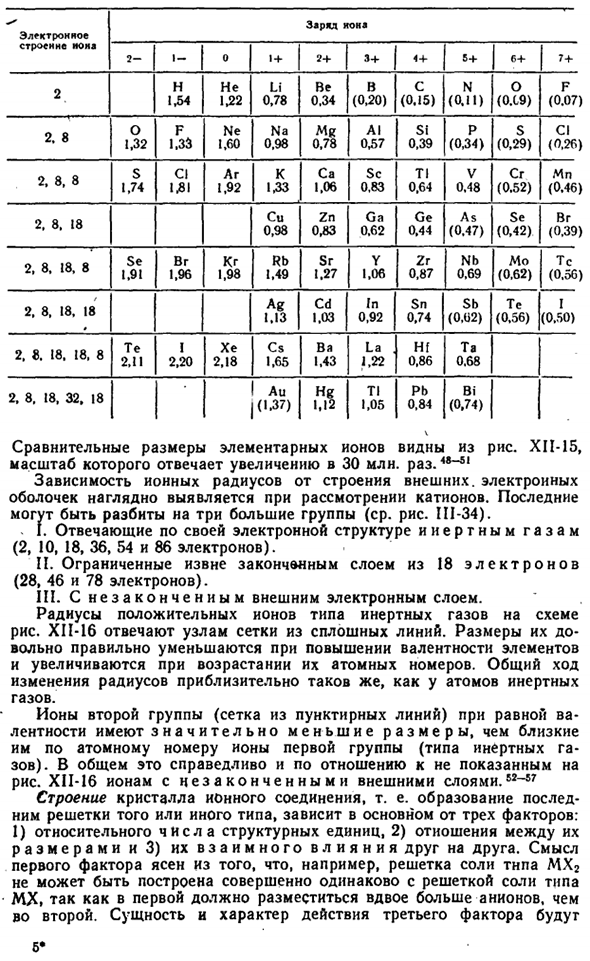
Для того, чтобы найти ионный радиус, есть значение D из соли решетку, поэтому сначала нужно определить, какая часть из D принадлежит катион и какая часть принадлежит анион. Это было невозможно сделать это, не зная радиусе одного номера. Напротив, знание хотя бы одного радиуса стало основой для нахождения всех остальных. © ® @ @ 0о.©©@@ О фирме О компании SI-S » о©© Gaa * ^ 4 — ’ Ce4 ′ рисунок XII-15.Размер сравнения ионов.
Начальные значения ионов F «(1,33) и O2 — (1,32 а) были получены с использованием оптических методов. Тогда уже нетрудно найти радиус других ионов. Например, NaF (2.31 A), простым вычитанием можно увидеть, что радиус ионов Na +равен 2.31-1.33 = 0.98 A. It легко вычислить радиус анионов точно таким же образом, исходя из известного радиуса катиона. Сравнение радиусов наиболее типичных элементарных ионов, найденных в этом методе, представлено в таблице ниже(цифры в скобках соответствуют значениям, рассчитанным полутеоретическим способом). РНС. XI1-14.
Схема структуры Цонги. [C’) A*’) * Mfcd или нет Электронная структура Нона Обязанности кока 3+ Мне.- 5+ 1 + 2+ 6+ С (0.15)) О компании(0.19) Ф(0.07) н 1.54 1.22 не Ли 0.78 Это 0.34 В (0.20) Н(0.11) Да. 1.32 Ф 1.33 Мистер 0.78 Аль. 0.57 СФ 0.39 П (0.34) С (0.29) ИЦ(0.26) Нэ 1.60 На 0.98 2.8 1.06 Калифорния С. Семьдесят четыре СК 0.83 Тл 0.64 СГ(0.52) Ки 1,92 в В 0.48 К 1.33 МН(0,46) 2.8, 8 КР 0.98 Га-0,62 Гэ 0.44 ЗН 0.83 (0.47) ЮВ(0.42) Br. (0.39) 2. 8. Восемнадцать Да 1.06 ЗР 0.87 НБ 0.69 ТС(0.56) 1.49 РБ СР 1.27 МО(0,62) ЮВ 1.91 Br. 1.96 КР 1.98 2, 8.18. Восемь С 1.03 В 0.92 СБ(0.U2) АГ 1.13 ЗП 0.74 Их(0,56) 2, 8 и 18.
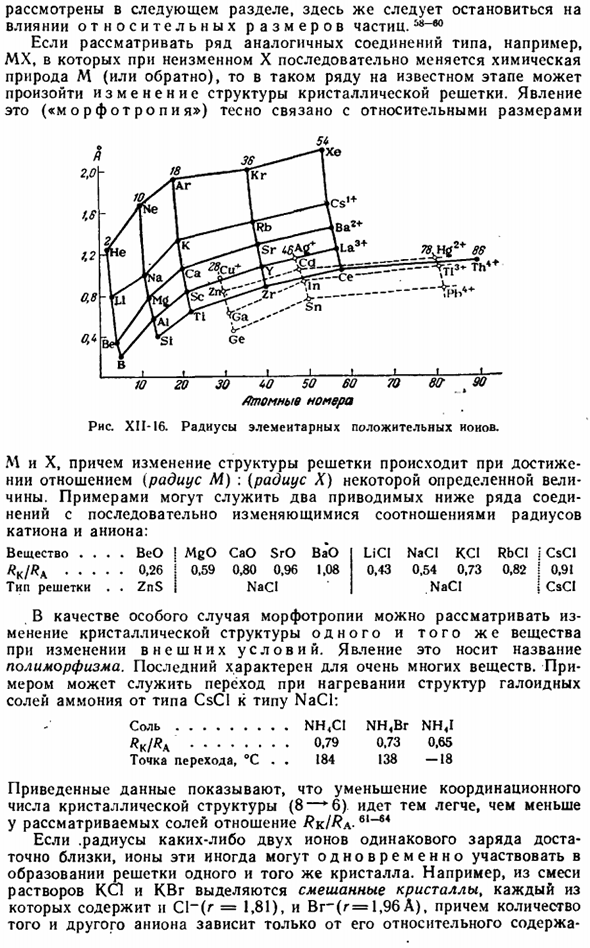
Восемнадцать (0.50) ВЧ-0.86 Тот… 0.68 Я 2.20 В CS 1.65 Ла 1.22 2.11 них Хе 2.18 Ба 1.43 2. 8. 18 и 18. Восемь Привести 0.84 АУ(1.37) Tl 1.05 По(0,74) Да! 2, 8, 18, 32.18 Сравнительный размер элементарных ионов можно увидеть из рисунка. XII-15, его масштаб соответствует увеличению в 3000 миллионов раз. Рассматривая катион, становится ясно, что ионный радиус зависит от структуры внешней электронной оболочки.
Последние можно разделить на 3 большие группы(см. Рисунок Sh-34). — I. электронная структура представляет собой инертный газ(2、10、18、36、54、86 электронный). II. снаружи ограничен готовым слоем из 18 электронов (28, 46, 78 электронов). III. имеется незаконченный внешний электронный слой. Радиус положительных ионов, таких как инертный газ, на рисунке XI1-16 соответствует узлам сплошной сетки.
Их размер уменьшается очень точно, когда валентность элемента увеличивается, и когда атомный номер увеличивается. Общий ход изменений радиуса примерно такой же, как и ход атомов инертного газа. Ионы 2-й группы, валентности которых равны(пунктирная сетка), значительно меньше ионов 1-й группы, где атомный номер находится рядом(например, инертный газ).в целом это относится к тем, которые не показаны на рисунке.
Неполный внешний слой XII-16 ионы 52-57 Кристаллическая структура ионных соединений, то есть образование ими того или иного типа решетки, зависит главным образом от 3 факторов: 1)относительного количества структурных единиц, 2)соотношения между размерами, 3)взаимного влияния друг на друга. Значение первого элемента очевидно, например, из того факта, что решетка соли MX2-типа не может быть построена точно так же, как решетка кулачка MX-типа.
Сущность и характер действия третьего фактора б * Мы рассмотрим его в следующем разделе, но здесь нам нужно узнать больше о влиянии относительного размера частиц. Например, если мы рассмотрим несколько аналогичных типов соединений, таких как MX, в которых химия M (или наоборот) непрерывно изменяется без изменения X, то в этом ряду может происходить изменение структуры кристаллической решетки на известной стадии.
Это явление («морфотроп») тесно связано с относительным размером. «Я» _1_I-1-л. 10 й 30 60 50 60 70 Вт Т 90 атомный номер Диаграмма XII-I6.Радиус положительных ионов элемента. Изменение структуры решетки происходит, когда отношение (радиус M): (радиус X) достигает определенного значения value. An примером могут служить следующие 2 серии соединений, в которых отношение радиуса катиона к аниону изменяется непрерывно.
Вещество…. Бео! MgO CaO SrO BaO LiCI Naci KCI RbCl J CsCI #К //?Один….. 0.26 Дж 0.59 0.80 0.96 1.08 0.43 0.54 0.73 0.82 0.91 Дж Виды грилей. 。 ЗНС Дж NaCl и NaCl и Дж Цсци В качестве частного случая морфофотропии можно рассматривать изменение кристаллической структуры одного и того же вещества и изменение внешних условий. Это явление называется полиморфным. Последнее характерно для очень многих substances. An примером может служить переход структуры галогенидов аммония от типа CsCI к типу NaCl. Соль…….. Як / ^ А…….
Точка перехода,°C НХ «Ди НХ» БЗ НХ » я 0.79 0.73 0.65 184138 −18 Представленные данные свидетельствуют о том, что уменьшение координационного числа кристаллических структур(8-6) происходит легче, так как отношение Rk / Ra меньше. Если радиус любых 2 ионов одного заряда достаточно близок, то эти ионы могут одновременно участвовать в образовании решетки из одних и тех же кристаллов. Например, смешанный Кристалл отделяют от смеси раствора KSL и раствора KBr, каждый из которых содержит как C1-(g = 1,81), так и Br — (g = 1,96 а), причем количество того и другого зависит только от его относительного количества.
Решение ния. За счет образования смешанных кристаллов K (C1, Br) состав C1xbalk (x + y), то есть состав KBr из состава KCI (y = 0), при любых значениях x и y (x = 0).Поэтому в таких случаях утверждение Бертоле (i§ 2) о непрерывном изменении состава соединения оправдано. Вещества с одинаковой молекулярной структурой, которые образуют смешанные кристаллы(kc1 и КВГ, КМНС> 4 и BaS04 и др.) называются изоморфными.
Из-за близкого подобия решетки один кристалл гомоморфного вещества вызывает кристаллизацию пересыщенного раствора другого, а в насыщенном растворе он продолжает расти по мере испарения воды, покрытой слоем 2-го вещества. Хорошим примером изоморфной группы солей являются квасцы различного состава (XI§ 2).Многие случаи изоморфизма известны также для веществ других классов.
Добавь 1) Если в ходе химической реакции в этой среде образуется плохо растворимое вещество, то, прежде всего, некоторые его молекулы группируются в мелкие первичные aggregates. In в некоторых случаях возникновение твердой фазы происходит особенно быстро, и эти агрегаты состоят из случайно светящихся частиц. Хорошим примером является»стеклянный лед» (IV§ 3 дополнение.42).
Однако такие аморфные состояния нестабильны и более или менее быстро переходят в кристаллические состояния. 2) как правило, основные агрегаты частиц, выделяющихся из раствора, уже естественным образом построены и являются незначительными кристаллическими nuclei. In будущее, 2 процесса происходят одновременно. а)растет существующий центр кристаллизации, на котором последовательно осаждается большое количество новых слоев молекул, и Б) появляются новые первичные агрегаты.
В зависимости от природы выделяемых веществ и окружающей среды, а также внешних условий, оба эти процесса протекают с разной скоростью. Если он будет значительно больше в первом процессе (о), то частиц, осажденных на дно сосуда, будет относительно меньше, но плотность частиц будет несколько («кристаллические» отложения).
Наоборот, если скорость 2-го процесса (Б) будет значительно выше, то количество образующихся частиц будет очень большим, а их размер будет равен small. As в результате осаждается разрозненная масса или хлопья, и многие неравномерно мелкие первичные агрегаты беспорядочно скользят друг в друга («аморфные» отложения).
Наконец, если значения обеих скоростей близки, то одновременно образуются частицы очень разных размеров. По теории кристаллизации из раствора существует монография 3) различная температурная зависимость образования и последующей скорости роста кристаллического ядра особенно используется при получении кристаллов и сплавов (X§ 4 add.65).XII-17,
Как видно из рисунка, первоначально при температуре а стеклянное изделие охлаждают сначала до оптимальной температуры зарождения (5), выдерживают его в течение достаточного количества времени, затем повторно нагревают до оптимальной температуры роста кристаллов (5) и, наконец, после полной кристаллизации охлаждают. Е. В. кристаллизация раствора. Л. » Наука.»1J67. 150 секунд. Время есть Диаграмма XII-I7. s и желчное стекло схема ho .да конверсия.
4) вообще говоря, если раствор вещества, реагирующего в холодных условиях, появляется быстро, появляется большое количество кристаллических ядер. Напротив того. Медленное перемешивание горячих растворов благоприятно для расширения кристаллов/по отношению к концентрации раствора зависимость уже более сложная: максимальный размер осажденных частиц обычно соответствует средней концентрации, причем как уменьшение, так и увеличение последней приводит к увеличению степени дисперсности осадка.
5) как и в случае со свободной поверхностью жидкости(рис. IV-19), внешняя поверхность кристалла подвергается поверхностному натяжению. Сумма поверхностной энергии, которая возникает, когда масса кристалла постоянна, тем меньше она, тем больше значение. Таким образом, переход от малых кристаллов к большим выгоден с точки зрения энергии, и при соответствующих условиях он может происходить самопроизвольно.
6) если в одном и том же контейнере под раствором одновременно находятся мелкие и крупные кристаллы вещества, то более мелкие кристаллы будут постепенно растворяться、 Он будет расти больше. Это связано с несколько большей растворимостью первого. Например, как видно из данных на рисунке 5. XII-18.So, раствор, насыщенный относительно крупными кристаллами, еще не насыщен относительно мелкими кристаллами.
Последний растворяется, концентрация раствора повышается, и часть растворенного вещества осаждается на поверхности крупных кристаллов. Теоретически это должно продолжаться до тех пор, пока в не образуется раствор 1 большой crystal. In на самом деле, эта ситуация обычно не достигается, потому что занимает много времени.
7) в холодном растворе рост одних кристаллов замедлится за счет других, но горячие кристаллы будут гораздо быстрее. Поскольку очень мелкие кристаллические осадки проходят через поры фильтра или быстро засоряются, они медленно удаляются фильтром, поэтому, если небольшая часть материала будет потеряна, все измерение будет нарушено, может потребоваться увеличить размер кристалла техническим и количественным способом. analysis.
In в большинстве случаев, чтобы расширить Кристалл, достаточно оставить его под раствором на несколько часов. Иногда для очень плохо растворимых веществ удобнее некоторое время кипятить раствор, потому что при нагревании (за счет повышенной растворимости и ускоренной диффузии) рост кристаллов АА другими кристаллами происходит гораздо быстрее.
8) уменьшает все кристаллические формы различных веществ до 32 классов и может быть объединен в 6 кристаллических систем. Если, согласно определенным правилам»регулярной установки», координатные оси помещаются в кристалл, то их грани разрезаются на отрезки известных length. In в этом случае принадлежность кристалла к той или иной системе определяется относительным расположением его координатных осей и соотношением отрезанной длины последнего отрезка.
Сравните пример простейших призматических и пирамидальных (точнее, диплоидных) различных систем на Рис.1. XII-7. а) кубическая (правильная) система. Все 3 оси (точнее, отрезанные кристаллами отрезки) перпендикулярны друг другу, одинаковы по размеру. Простейшая форма кубической системы-это куб и октаэдр(см. рис. XI-7.4).
Часто встречаются различные комбинации друг друга (рис. XII-I9).Важной формой кубической системы является тетраэдр (рис. XII-20).Из общего числа исследованных кристаллов доля кубических систем составляла около 8%.In его соответствующую форму кристаллизуют многие металлы, такие как алмаз, NaCl, KCI, ZnS, PbfNOj). b) в отличие от других, шестиугольная система характеризуется 4 осями, а ее главная ось, odia, перпендикулярна другим 3 осям.、
Максимальный размер кристалла (ммоль / л). Равный угол (60°).Эти 3 оси имеют одинаковую длину, а главная ось может быть длиннее или короче этой. Из кристаллических форм основными являются шестиугольные колонны и пирамиды(рис. XII-7.См. S).Иногда, из гексагональной системы, ее основной формой является r o m bo-hederon(rns. Подсистема trngoy с (X1I-21) изолирована. Около 7% всех известных кристаллов принадлежат к hexagons. In оно, много химических элементов, как Хджо, сиот, ХГС, нано, ЕТК., кристаллизоваться. а) квадратная (квадратная) система.
Все 3 основания взаимно перпендикулярны, 2 равны, а 3-е основное основание может быть короче или длиннее других 2.Основная форма-восьмигранник с квадратным прямоугольником и квадратным дном (см. Рисунки XII-6, Б).Около 5% изученных веществ, в частности Sn, SnO *и некоторые соли, кристаллизуются в тетрагональной системе. г) ромб системы. Все 3 оси взаимно перпендикулярны, но они отличаются по размеру. Основная форма показана на схеме. ХП-7, д.
В этой системе, KNOj, к * так», УПМ и т. д., и много минералов crystallize. In в целом, около 28%всех исследуемых кристаллов. д) моноклинная система. 2 оси взаимно перпендикулярны, 3-я ось наклонена относительно плоскости и остается перпендикулярной одной из первых 2 осей(rns. См. XII-7, D). KCIO * кристаллизуется в моноклинной системе. NajS04•10HfO, сахар и так далее. Большинство всех исследованных кристаллов составляют около 42%этой системы. е) триклиническая.
Все 3 оси расположены под разными углами друг к другу и различаются по размеру(рис. XII-7.(См. E). KjCraO? Она кристаллизуется в нем. Около 10% всех исследованных кристаллов в общей сложности, таких как CuS04-5Hj0. 9) Выбор конкретной кристаллической формы в основном определяется свойствами самого кристаллизующегося материала, но на относительную скорость роста поверхности несколько влияет природа растворителя и наличие примесей в растворе.
Поэтому иногда удается добиться искусственных, полных изменений в привычной кристаллической форме. Например, мочевиносодержащие растворы, содержащие хлорид натрия, обычно кристаллизованные в кубиках, выделяются в виде октаэдров. Напротив, квасцы в присутствии мочевины образуют кубический кристалл, который обычно характеризуется октаэдром shape. In дело в том, что такие антропогенные изменения кристаллической формы в химии встречаются крайне редко.
Существуют специальные монографии*о влиянии кристаллизации смешанных ионов и солей. 10) изучение кристаллической формы вещества часто позволяет установить его химический состав directly. In в прошлом веке подобный кристаллохимический электронный анализ был важным вспомогательным методом для химиков и основным направлением практического применения кристаллографии(это нашло отражение в известном высказывании Энгельса «Кристаллография-часть химии»).
В настоящее время основным содержанием кристаллографии является уже не описание формы кристаллов, а комплексное изучение свойств кристаллов и закономерностей их образования. Она * ?Али * — Это Ю. Йа. Кристилляция Золя » из раствора йода I trim■наличие различных ионов. Фрунзе. Кыргызстан Академия наук Киргизской ССР. 1957 год. 206 С. Она становится обширной самостоятельной наукой, у нее есть свои методы, имеющие значение для практики (целенаправленный синтез кристаллов для различных областей науки и техники).
Промежуточной областью между современной кристаллографией и химией является кристаллохимия, изучающая структуру веществ, находящихся в твердом агрегатном состоянии.Там есть монография. 11) в нормальных условиях правильно сформированные крупные кристаллы получаются очень редко.Это во многом зависит от их взаимного расположения growth.In кроме того, внешняя форма кристалла обычно более или менее сама по себе Он отличается от упомянутых выше простейших.
Например, оба они показаны на рисунке. J / h, XI1 — 22 Кристалл / \ \ идеальный образец правильный / Гр / С / _октаэдрические.1 несмотря на очень значительный видимый L ^ r I / Lf} / различие, общность всех 3 основных форм \ l I / > ^сталь может быть доказана путем измерения угла С этих ракурсов мы и ждем их с соответствующей гранью хп-22.Октаэдрические кристаллы*.Существует самая большая флуктуация в общей сложности Тип характера. — Вид строго неизменен, — сказал он.
Любой тип кристалла. 12) даже при внешней форме без искажения кристалла идеальная упаковка его структурных единиц всегда несколько нарушается различными внутренними дефектами.1 из них является так называемым.Мозаика structure.It долгое время предполагалось и экспериментально подтверждалось, что крупные кристаллы не являются полностью однородными и состоят из множества мелких кристаллов («блоков»), сросшихся между собой, а их взаимное расположение точно не совпадает со строго правильным.
В зависимости от свойств вещества и условий роста кристаллов размер блока может варьироваться (чаще всего около 10 * см). по мере их уменьшения прочность материала увеличивается.Смотрите мозаику Структура (под микроскопом), me- + «+» + +-+-+Тарик висмут. — □- +—О+— 13)+ + q + _ +появление мозаичной структуры кристалла связано с дислокацией. Нарушение правильной альтернативы от-«» ‘‘-«» «»-4 *-+-индивидуальный атомный самолет.Очень часто^ Структурное разрушение точечного типа-рисунок хм-23.Схема вычитания дефект м » 1 / » смещение (B) v Дефекты вычитания («по Шоттки») и дефекты смещения («по Френкелю»).
Первая определяется наличием в решетке отдельных пустот (вакансий), которые не заполнены соответствующими частицами(а, фиг. XII-23), последнее определяется смещением отдельных частиц (ионных кристаллов, обычно небольшого размера катиона) из нормального положения зазоров в решетке( Б, фиг. XII-23).Как правило, кристаллы содержат оба типа вакансий, одна из которых преобладает(например, вычитание в галогениде натрия, смещение в галогениде серебра).
Даже для идеальных кристаллов NaCl из-за теплового движения ионов(из-за частичной диффузии к поверхности) относительное число вакансий составляет I: 10, J-при комнатной температуре, I:10° — 500°С, 1: 10 * 800°C(точка плавления).Рейтгейострук идеально подходит для реальных мнкристаллов NaCl, оценивая количество вакансий в 3-10 «* см » путем сравнения концентрации фактической температуры и общей (суммы всех возможных дефектов).существует множество монографий на эту тему о микродефектамн решетках, связанных с UE только диффузионной обработкой твердых тел, и других физико-химических свойствах из UQ * Бокей и Г. Б. Кристаллохимия. М.»Наука» 1971.400 С. •* Х е N и YN.Твердая химия.С английского, Изд. В. В. Борди Лева. М. «Мир». 1971.22.
Потому что нет абсолютно никакой чистой субстанции (II§ 6).Кристаллы обязательно содержат примесные частицы, а иногда инородных тел и пустот больше pronounced. In в общем, реальные кристаллы почти идентичны идеальному газу, поэтому реальные кристаллы почти идентичны идеальному газу. 14) наиболее чистой и однородной кристаллической структурой является Монокристалл. Их свойства могут существенно отличаться от обычных для конкретного вещества. Например, оказалось, что удельная прочность и разрушение монокристаллов железа примерно в 35 раз выше, чем у обычных образцов.
Монокристаллы становятся все более важными для технологии каждый год year. In дополнение к показанному на фиг.78.Есть много других способов его приготовления. Время роста большинства монокристаллов исчисляется днями, а некоторых-месяцами. 15) необходимым условием образования определенной кристаллической формы является регулярное расположение частиц, составляющих Кристалл (кроме того, может существовать пространственная группа из 230, то есть вариант такого расположения).
- Поэтому в каждом кристалле параллельные грани должны быть расположены на равном расстоянии друг от друга и равномерно заполнены частицами(рис. XI1-24).Исследование внутренней структуры кристалла основано на интерференции рентгеновских лучей при отражении от такого большого количества параллельных плоскостей. Теория этого явления подробно изучается в оптике, но здесь она затрагивает лишь в той мере, в какой это необходимо для понимания основных принципов технологии рентгеновской кристаллографии.
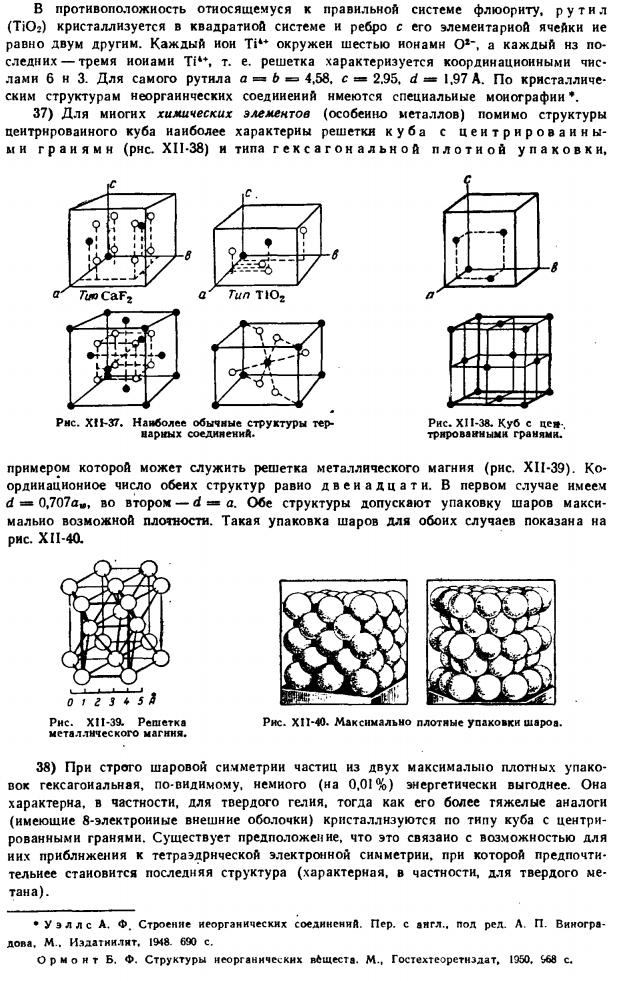
Для возникновения интерференции расстояние между соседними отражающими поверхностями должно составлять не менее половины длины волны падающего излучения beam. (Результатом интерференции солнечного света является характерный радужный вид 1 или другого оттенка). В некоторых из простейших кристаллов легко вычислить, что расстояние между их плоскостью и модами отражения намного меньше расстояния, с которого происходит интерференция J-Ram видимых световых C-лучей.
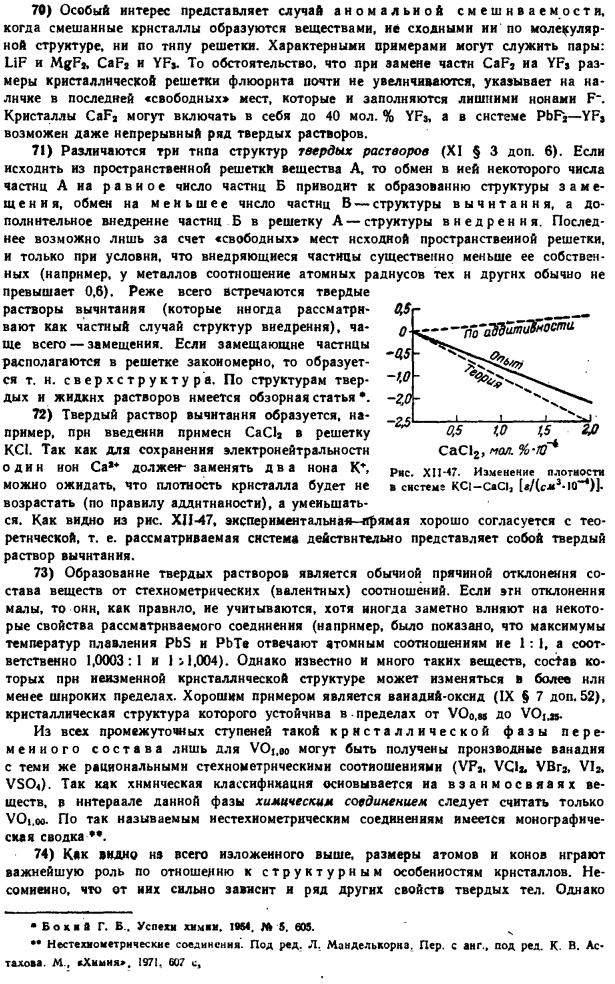
In связь с видимым светом (длина волны 4000-7000 а), это наблюдается в таких системах, как масляная пленка на воде, например. Людмила Фирмаль
Например, масса NaCl составляет 1 моль Рисунок XI1-25.Схема » интерференционные лучи.«S8-455 g содержит 6,02-10» индивидуальных молекул. Масса каждого из них составляет 58,455 г / Б, 02-10 «9,710» с — » Г. Но соль кристаллизуется в виде куба, плотность которого составляет 2,103 г / см *.Из этого кристалла NaCl размером 1 см *содержится 2. 173 G / 9.710-10 «„g = 2.239-10“ молекулы или 2 раза молекулы, то есть 4. 478-10 * индивидуальный ions. So, каждый из них занимает объем куба. 1 см / 4.478 равно 10 y = 2.23-10 » см.Ребро такого куба d = 1 ^ 2.23•10 «n cmgw „=2.814 “ 10 » * s * −2.814 A.
Эта длина соответствует расстоянию между двумя соседними отражающими поверхностями кристалла NaCl, и мы можем видеть, что она больше или меньше длины волны видимого света. Рентгеновские лучи можно обнаружить, потому что против них получается 10-минутная, 1-минутная волна далекого Ангстрема. То есть она полностью обеспечивает возможность помех. 16) используйте рисунок фигуры, чтобы рассмотреть природу самого явления. XII-25.
Предположим, что плоскость, параллельная плоскости a кристалла, разделенного расстоянием d, падает на 2 параллельных пучка (A {и A2) той же длины волны (X), что и угол A. At при этом каждый НЗ ннх частично отражается от каждой плоскости и даже частично проходит через нее. XII-25 в расположении, показанном на рисунке. / И падающие лучи J1 и Λ соответственно отражаются от 2 плоскостей Рисунок XI1-24.Тип плоскости — » Кристалл NaCl.» (В этом случае то, что нас интересует) заключается в слиянии в 1 общий луч отражения L. поскольку 2-й Луч[Л%] должен идти на большое расстояние (точка до), он отстает от AB-BV, чем первый луч.
Если на последней сложена целочисленная волна, то есть она может быть представлена как AB-BV = lX (n-целое число), и когда оба отраженных световых луча встречаются (в точке B), они из-за интерференции от n»и отражают друг друга, и общее отражение становится ярче*.В противном случае, то есть если запаздывание траекторий, отраженных заданными x, d и последовательными плоскостями лучей, не соответствует волнам целых чисел в результате их интерференции, то происходит и полное затухание.
Там нет общего отражающего луча. Из рисунка можно оценить взаимосвязь между фигурами XII-25, X, d, a. возможно только наличие ее прямых общих отраженных световых лучей. северный.) — АВ-ЛВ-ЛВ-АГ-АЭ-АГ-Гэ-BEsin® — 2Д Сина Это основное уравнение рентгеновской рентгеноскопии Х= 2d sin os было получено в 1912-1913 годах. Брэгг и Г. В. независимы друг от друга по Wolfe. It часто упоминается как состояние волка Брэгга. Угол падения, удовлетворяющий этому условию, определяется sin a-n \ / 2d relationship.
So например, излучение длины волны 0,440 л совпадает с излучением sin a = n-0.440 / 2 −2.814 = l * только под углом 0,0782, заметно отраженным от плоскости Куба хлорида натрия. n I 2 3 4 и др. И 4e 2U 8e 58 * 13e 34 ’18°14′ etc. при увеличении n»яркость» пучка полного отражения быстро уменьшается. Принимая это во внимание, использование отражения 1-го Порядка (n «=» I) дает самые четкие результаты.
Поскольку a и n могут быть определены непосредственно из экспериментальных данных, только 2 величины остаются неизвестными в Формуле nX = 2dsina-X n d. используя кристаллы NaCl (d рассчитывается непосредственно из плотности), можно определить длину волны рентгеновских лучей, полученных из того или иного источника. Напротив, используя лучи с известным рентгеном, можно найти расстояние между отражающими поверхностями исследуемых кристаллов, знание которого позволяет установить их внутреннюю структуру (по определенным правилам рентгеновского геноскопа).
17) экспериментально исследование внутренней структуры кристалла обычно не проводится по исходному методу TG-T (см. Рисунок UI-56).И затем Тг к любому из следующего. Таким образом — Узкий луч Мио «Хроматический» (т. е. ноги с равномерной длиной)) Рисунок XI1-26.Схема способа вращения_ Кристалл. Волна) рентгеновские лучи падают Сталь к установлена на поворотной стойке с(рисунок хп-26).Проходящий Кристалл без отражения отдает часть лучей на острие Φ5 фотографии, до тех пор пока пятно не появится на другой части пленки. Брэгг-Вульф до тех пор, пока условие не будет выполнено.
Если вы медленно вращаете стойку C, наступает момент, когда выполняются следующие условия: в проигрывателе появляется 5 B, а если вы поворачиваете C дальше, Луч затухает, а затем появляется снова. На рис. XII-27 показана рентгеновская дифракционная картина, полученная методом вращающегося Кристалла (центральное пятно черное). 18)для работы с методом вращающихся кристаллов нужен относительно крупный кристалл, который не всегда available. In напротив, исследование порошка может опустить очень мелкокристаллический порошок.
Схема установки показана на рисунке. XI1-28.Твердый круглый пучок, проходящий через отверстие свинцовой диафрагмы, попадает в колонну К. сжатый кристаллический порошок вещества под study. TV как последний другой Диаграмма XII-27.Рентгеновский снимок сделан методом вращающегося Кристалла. Кристаллы очень хаотично ориентированы, и некоторые из них всегда имеют расположение отражающих поверхностей, удовлетворяющее волку Брэгга condition.
In в связи с этим нет необходимости поворачивать колонку, и на фотопленке вы получите множество полосок непосредственно вместе с центральным пятном а (рис. XI1-29).С позиции, где можно очистить постоянную характеристику конкретного кристаллического вещества. Что касается подготовки исходного материала и осуществления самого эксперимента, то порошковый метод характеризуется несколько меньшей точностью структурных расчетов и большей сложностью, так как он значительно проще ротационного кристаллического метода.
При значительном уменьшении размеров отдельных кристаллов при исследовании постепенно увеличивается размытость линий рентгеновской дифракционной картины, но последняя тем не менее позволяет сделать определенные выводы(даже в общем виде) даже для частиц диаметром в несколько микрон. Это очень ценное преимущество порошкового метода, в частности, он смог решить проблему внутренней структуры коллоидных частиц и многих «аморфных» веществ. 19) порошковый метод часто используется для идентификации веществ.
Это сделано путем сравнивать рентгеновский снимок порошка образца испытания («degram») с веществом degram. Совпадение набора линий определяет характер выборки. Наличие или отсутствие химических изменений в системе можно подтвердить путем сравнения продуктов их взаимодействия с исходным материалом. Па-пример. Было показано, что при слиянии Наноа с Na * 0 Орто-нитрат натрия не образуется(IX§ 3 add.51).
20) отражение рентгеновских лучей от плоскости кристалла происходит за счет рассеяния электронами, составляющими частицы, заполняющие эту плоскость. Очевидно, что когда сами частицы заполняют плоскость одними и теми же частицами, рассеяние(и, как следствие, отражение) должно стать сильнее, и в каждой из них содержится больше электронов. 、
Изучив Кристалл Naf с этой точки зрения и зная, что число отдельных частиц в нем в 2 раза больше числа молекул, можно сделать 2 крайних предположения о свойствах этих частиц: а) Кристалл состоит из нейтральных атомов Na и F, б)Кристалл состоит из ионов Na * и F «.Согласно первому из них, от плоскости, занятой атомом Na (II электрон), следует ожидать, что атом X сильнее отражается от плоскости, занятой атомом F (9 электронов). Диаграмма XII-28.Схема порошкового метода.
Диаграмма XII-29. Картина порошка рентгеновского снимка. Согласно 2-му, каждый наносекундный Ион содержит 10 электронов, поэтому отражение должно быть same. In на самом деле интенсивность лучей, отраженных от определенной плоскости, примерно одинакова. Это указывает на то, что Кристалл NaF состоит из ионов, а не атомов. Однако не следует думать, что кристаллы соли являются полностью ионными, то есть электронное облако валентных связей целиком принадлежит Anon.
In дело в том, что эти облака также частично распределены между ионами, и фактический заряд последних несколько ближе к соответствующему значению(например, в Кристалле NaF+1 0.9 n −0.9 −1). 21) тот факт, что отражение рентгеновских лучей обусловлено наличием электронов и зависит от их количества, накладывает определенные ограничения на применимость рентгеновских методов к исследованию кристалла structures.
In в частности, невозможно непосредственно определить местоположение в решетке Протона. Если атомные числа (C и N, N и O, P и S и т.) фиксируют взаимные положения близких атомов, то большие трудности arise. In кроме того, мы обнаружили, что очень трудно объяснить структуру соединений, которые содержат атомы с очень маленькими атомными номерами и очень большими атомными номерами одновременно.
Например, в случае Lil лучи, отраженные не «Li»(всего 2 электрона), очень слабы по сравнению с отражающими ионами на I»(54 электрона), поэтому невозможно непосредственно определить положение лития в решетке на оси рентгеновской дифракционной картины Lii(это не может быть установлено косвенно)-по размещению лития в решетке.
С другой стороны, такая же зависимость рассеяния от числа электронов объясняет, почему, например, пластины из Be (4 электрона) легко проходят через рентгеновский фильтр, и наоборот, пластина Pb(82 электрона) очень сильно задерживает их. В связи с этим относительная светопропускаемость рентгеновских лучей в организме человека почти исключительно состоит из элементов с малым атомным номером. 22) как было указано ранее (III§ 4, дополнение 12).
Что касается дифракции, то электронные пучки ведут себя аналогично рентгеновским лучам(рис. XI1-30).Эта аналогия позволила разработать электронно-дифракционный метод структурных исследований. Это в основном похоже на рентгенографическое, но воздействие и ряд важных особенностей рассмотрены выше.
При электронно-дифракционном определении структуры пучок электронов, который рассеивается путем приложения электрического поля до 1 или другой заданной скорости, направляется на исследуемый объект. если v-разность потенциалов ускоряющего поля (в вольтах), то длина волны, соответствующая электронному пучку (в ангстремах), определяется соотношением X = 1 ^ 150 /о. Например, электронный пучок с х = 0,1 а создается с разностью потенциалов 15 000 Э. С другой стороны, рентгеновские лучи проникают на значительную глубину Кристалла.
Электронный луч прекрасно отражается в нескольких его внешних плоскостях. Поэтому для изучения внутренней структуры кристалла желательно использовать рентгеновские лучи. Напротив, дифракция электронов открывает возможность изучения поверхностных слоев твердых тел. Это самое главное. Особенно для гетерогенных катализаторов.
23) оба метода могут быть использованы для установления структуры кристалла (или жидкости), а также газообразного состояния вещества. Для этого пучок рентгеновских лучей или электронов направляется в паровой поток исследуемого вещества. Молекулы в этих струях не расположены случайным образом、 Rn. ХП-у » рентгеновская дифракция ИАИ И.1byr / junor (£>при прохождении через оксидную пленку пленки.
Тот факт, что все они имеют одинаковое пространственное распределение атомов, определяет регулярность линий рисунка, что дает возможность расшифровать последние и установить внутреннюю структуру исследуемой молекулы. В основном аспекте рассматриваемые методы не являются полностью эквивалентными, поскольку дифракция рентгеновских лучей в основном вызвана электронами, а катодные лучи — атомными nuclei.
In другими словами, рентгеновские исследования устанавливают местоположение в пространстве центра масс электронного облака атома и устанавливают дифракционное исследование электронов атомного ядра. Однако, как правило, одно практически совпадает с другим, и оба метода дают достаточно сходящийся результат. 24) в связи с изучением структуры отдельных молекул (пар) метод дифракции электронов имеет 2 больших преимущества перед рентгенографическим методом.
Благодаря небольшой зависимости рассеяния элемента от атомного номера (рис. XII-3I) можно лучше установить расположение легких атомов в присутствии тяжелых atoms. At при этом время экспозиции, необходимое ему для получения четкой картины дифракционного пучка, несоизмеримо меньше short. So, подавляющее большинство молекулярных структур точно установлено методом электронной дифракции.
25) при использовании данных о молекулярной структуре необходимо учитывать их неоднозначность. Например, в рентгеновских дифракционных данных для кристаллов KBrF также сопоставляются тетраэдрические. [BrF4]Ион квадратной формы. Аналогично, добавление молекул NSF3 (IX§ I. 67)следующий набор из 2 структурных параметров одинаково хорошо соответствует экспериментальным результатам микроволновой спектроскопии. д \ Н). Д (СФ), а <ФФС в 1.416±0.003 1.552±0.003 94°2 ’±16′ Б 1.910±0.003(.488±0.003 120°0 ’±1c’)
Выбор чего-то более точного возможен только на основе сходства и общих соображений(а не результата самого определения структуры).Поэтому расстояние 1,91 A слишком велико для тройных связей, а плоская структура группы SFs очень высока unlikely. So, вариант А следует признать правильным, а число вариантов в указывает на то, что высокая точность определения конструкции не гарантирует ее надежности. 26) к сожалению, достоверность результатов структурных исследований часто отличается из-за их точности и пренебрежения чистотой исходного материала(II§ 6 add. См. 2).
Например, самые последние (1968) точные электронные радиологические тесты на структуре РОСЬ и PSCI3 были проведены с изощренной текстурой и IM и подготовкой. Параметры, определяемые при таких условиях, могут соответствовать не отдельным исследуемым соединениям, а смесям в неопределенном количестве, которые не удаляются перегонкой impurities. As в результате достоверность полученных данных остается под вопросом.
27) хорошим примером возможной неоднозначности в определении структур является уже количественная, они даются, как правило, Галогенидом иитрозилом(IX§ 3 add.12). Поскольку рассеяние электронов от атомов N и O примерно такое же (и меньше, чем атомы G), как и 2 возможных структуры этих соединений-TNO и TON, то они связаны с самими экспериментальными данными и нормальной валентностью элементов(T-N = 0), однако на такую интерпретацию могут быть выдвинуты серьезные возражения. Нормальная длина.
Двойной связи n = 0 в 1.20-1.22 A и Галоидных nitrosyl это 1.13-1.15 А. другими словами、 Атомный номер* Рисунок XI1-31.Свойства изменения относительной рассеивающей способности атома (H — (). Без молекул, наверное).Тройное соединение о нем (IX§ 3 add. 8). напротив, длина связи (1.52 A) фтора с группами N0 намного больше, чем NF «(1.37) или F30 (1.41), и n ближе к длине связи F — O (1.58 A) молекулы F20a. По-видимому, это четыре цены (добавить VII§ I. 10).Поэтому не исключена возможность того, что фактическая структура Галогенида нитросунола соответствует формуле.
То же самое можно сделать с FaCNO (x§i addition.166) и Лино (дополнительный IX§ 3.32)также применяется. 28) очевидно, что из-за нестабильности исследуемого соединения в условиях исследования могут возникнуть трудности в четком описании результатов структурного определения. Например, по данным электронной дифракции того же института структура молекулы Ляо пары сначала определяется как угол d (LiO) = 1,82 A и ZLiOLi = 110°(1958), затем (I960 g) D (LiO)= 1,60 a линейный. 29) аналогичная ситуация наблюдается и в некоторых других случаях. Например, атом Бора рассеивает рентгеновские лучи, а электрон очень слаб по сравнению с атомом хлора.
Таким образом, заключение о тетраэдрической структуре СК (XI§ I доп. 60) основано главным образом на пространственном расположении атомов хлора. Однако возможно, что атомы бора этого соединения образуют плоский (или слегка деформированный) квадрат, а атомы хлора, прикрепленные к их углам, станут тетраэдрами за счет взаимного отталкивания.
Если это так, то молекула перестает быть «электронным дефектом» и не нуждается в интерпретации с точки зрения молекулярно-орбитального метода. Этот вопрос достаточно принципиально важен и сводится к тому, что теоретические выводы, сделанные осями отдельных структурных определений, не принимаются безоговорочно. 30) декодирование молекулярной структуры обычно осуществляется путем сравнения экспериментальных данных с данными, рассчитанными для заранее определенной модели.
Сначала дайте обзор наиболее подходящих из них, а затем уточните. Если вы являетесь автором определения и уже имеете представление о том или ином типе структуры, основываясь на его теоретических воззрениях, то только оно задано. То есть, определение структуры сводится к уточнению параметров. Таков, например, случай первого электронного биографического исследования гиволана (1938).
Основываясь на модели этаноида H3BBH3, мы обнаружили, что параметры<Y (BB)= 1.86, d (BH)= 1 хорошо согласуются с экспериментальными данными, 27 A,^ GNVN = = 109.5°.Таким образом, структура молекулы диборана, по-видимому, была достоверно продемонстрирована(следовательно, исходная теоретическая концепция была подтверждена экспериментально). Однако сомнения в правильности этой модели возникли несколько позже (1940), а параметр Н (1948) <*(VN. mutr)= 1.37 A. внешний ZHBH; = 122.5°и внутренний ZHBH » = 98°.
Исследования других методов было доказано, что модель моста является правильным(добавлен в XI§ 1.83). Таким образом, выбор структурной модели может быть сделан под влиянием определенной теории, после чего та же модель, уточненная по параметрам, может выступать в качестве подтверждения или обоснования оригинала theory. In в этой связи следует отметить, что расшифровка структуры более сложных борогидридов обычно основывается только на моделях, полученных из октаэдров или икосаэдров (XI§ 1, add.84).
Согласно предыдущему описанию, это также дает уверенность в правильности полученных результатов obtained. It было бы крайне желательно попытаться использовать более обширную исходную модель для декодирования структуры Летучего водорода. 31) помимо дифракции электронов, волновые характеристики электрона (III§ 4 ext.12) с помощью электронного микроскопа.
Схема простейших устройств этого типа (электронных проекторов) показана на рисунке. XII-32: в стеклянной емкости под высоким вакуумом полусферическая часть покрыта флуоресцентным экраном (/1).Кольцевой анод (B) помещен、 Катод изготовлен из очень тонкого вольфрамового чипа (в) (рис. X1B3). при напряжении в несколько тысяч вольт пучок электронов разрушает кончик чипа, придавая экрану изображение частиц, которые «загрязняют» поверхность чипа.
Размеры последнего из новейших электронных микроскопов (работающих при напряжении в несколько миллионов вольт) могут быть увеличены до 100 тысяч раз(до 3000 в обычных микроскопах). фактически, мы можем различать частицы диаметром до 10 а (то есть отдельные достаточно крупные молекулы). Пример ХІІ-34 показана электронная микрофотография 3 миллиона раз мелкий порошок вольфрама.
На этой фотографии хорошо видно, что поверхность частиц покрыта уникальной кристаллической иглой. Наличие его игл ранее не было известно. Уже с этого момента Рисунок XII-32.Простая схема-рисунок НР-33.Вольфрам рисунок XI1-34.Электронный фохой электронный проектор. Наконечник копья по сравнению с вольфрамом цом пин. Порошок. Примеры показывают очень важное значение, которое электронный микроскоп может иметь для изучения поверхности structures.
In у многих других областей тоже есть открытая перспектива перед ней. Например, впервые можно было рассмотреть т с помощью электронного микроскопа. Вирус является самым маленьким возбудителем гриппа среди многих других заболеваний. Имеется обзорная статья*об использовании электронных микроскопов в физико-химических исследованиях. 32), естественно, потому что ядра протона и гелия короче электронной волны (III§ 4 add.12), как правило, структуры, использующие положительно заряженные частицы, а также электронные проекторы, позволяют создавать еще большие увеличения.
Используя такой протонный или ионный проектор с полем ускорения в десятки миллионов вольт, можно различить даже отдельные атомы. 33) Как уже упоминалось (111§ 8, 1 дополнительно), каждая молекулярная решетка может быть разделена на составную решетку отдельных атомов. Это позволяет установить пространственное расположение ядер и определить расстояние между ними.
Если эти внутримолекулярные расстояния d и вытекающий из них общий атомный радиус (III§ 6) наиболее важны для структурных свойств самой молекулы, то с точки зрения кристаллической структуры более важны расстояния между молекулами, которые можно разделить на характерные радиусы межмолекулярных контактов.
Сравните последнее значение некоторых элементов (Ангстрем) со следующим: Т е н ц ы О П Р С ки в»СЭ ШБ Бр я 1.17 1.72 1.57 1.35 1.35 1.9 1.85 1.8 е, 2.0 е 2.2.20 1.95 2.15 На основе приведенных Эйкей, Рис. 1 и 2 модели XI1-35 молекулярной формы (увеличение в 3000 тысяч раз).Эти модели представляют собой попытку выявить внешние формы молекул, то есть пространственные ограничения сфер действия образующих их атомов. В. М. Услехи химии, 1958.НЗ.
Шестьсот девяносто 34) внешняя форма молекулы, очевидно, очень важна для запаха вещества. Согласно стереохимической теории запахов, существует 7 основных запахов-Лагерный мозг, му ладан, цветы, мята, эфирный, раздражающий, порча. Первые 5 из них связаны со специфической формой и размером молекул летучих веществ, а последние 2 обусловлены характерными свойствами электрофильных или нуклеофильных функций этих молекул.
Обонятельный аппарат человека включает в себя 5 участков (рецепторов) определенного размера и формы Еее® ОНВ привет Н2О ci2 * с » НВ Рисунок XH-35.Модель молекулярной формы. Молекулы летучих веществ вызывают соответствующую нервную стимуляцию. Например, приемное место запаха камфары, вероятно, представляет собой полусферу диаметром около 7 А.
Этот запах особенно выражен в гексахлорэтиле (CiCIe), адамантане(x§ 2 add.15) и Буррена(XI§ 1 доп. 128), сходных с лагерным мозгом, только молекулы, близкие друг к другу по сфере и своим размерам, сходны между собой. Комбинация стимулов, полученных одновременно от различных рецепторных участков, создает ощущение 1 или другого smell.
It интересно, что в стихотворении»о природе вещей», написанном древнеримским философом и поэтом Лукрецием каллусом (99-55 до н. э.), подобная трактовка обоняния уже дана. По другим представлениям, их не 7, а около 25 основных odors. It известно, что значительную роль в их проявлении играет не только форма, ион и структура молекул, но и то, что общие законы об этом были открыты до сих пор.
С другой стороны, » есть основания предполагать, что запахи могут быть вызваны молекулярными колебаниями в диапазоне длин волн 200-20 мкм. Эта вибрационная интерпретация запахов (наряду с анализом и критикой других идей) отражена в специальной монографии.Следует отметить, что из всех предложенных теорий запаха нет ничего, что можно было бы считать полностью удовлетворительным.
Однако, похоже, что единственный способ решить эту проблему-это стереоскопический подход. 35) из рассмотрения заполненных ячеек (II и рис. XII-12) становится как бы неравенство числа ноннонов противоположных, то есть неравенство положительных и отрицательных зарядов, followed. In на самом деле это не так. При построении кристалла каждая заполненная ячейка объединяется с другими ячейками на одной вершине во всех 6 плоскостях куба, так что окружающие ее ионы одновременно принадлежат 2, 4 или 8 ячейкам.
Таким образом, при единице заряда частиц внутри куба заряд частиц на его плоскости должен считаться равным ’/ A. ia rib-D’d. In угол -’ / » ■хорошим примером является то, что показано на рисунке. XI1-36 базовая ячейка Кристалла Батуэ (x§ 7 add.31). Sv) соединения типа ABA (3 компонента) с наиболее характерной структурой, показанной на рисунке. XII-37.In кристаллы флюорита (CaF), каждый ион Ca2 * окружен 8 ионами F, а последний окружен 4 ионами Ca2, соответственно.
Таким образом, координационное число решетки равно 8 и 4. Один. РНС. XI1-36.Кристаллические решетки блока P. s. P. X. наука о запахе. С английского, Изд. Н. П. Наумова, М. Мир » 1966. 224р. В отличие от флюорита, который относится к обычной системе, рутил (TiO3) кристаллизуется в квадратной системе, и края от его единичных ячеек равны 2 другим. Каждый ион Tik * окружен 6 o * » ионами, а последний окружен 3 Ti4 * ions. In короче говоря, сетка характеризуется координационными числами 6 и 3. d = 1.97 A. существуют специальные монографии*по кристаллической структуре неорганических соединений.
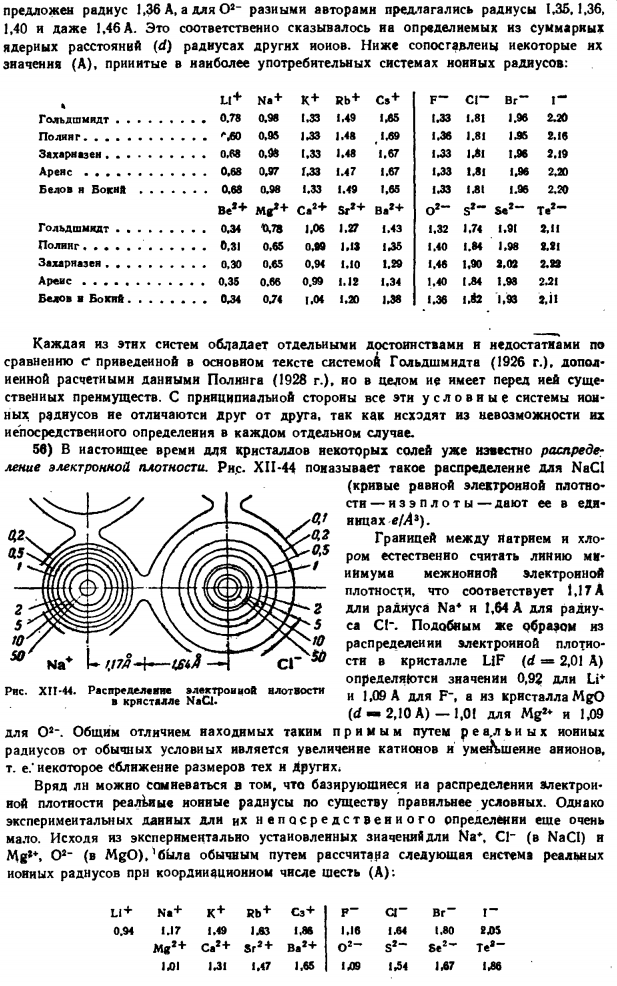
37) для многих химических элементов (особенно металлов), помимо структуры Куба в центре, наиболее характерными являются кубическая решетка с гранью центра (рис. XII-38) и тип гексагональной плотной упаковки. / т в 1 Мистер У. ТУ2 < < −1 1 1 ? Л 4 I » 9 тонн! Что ж… Тио КАФ. /// / ч / Г Л * Рисунок XfJ-37.Наиболее распространена структура тройных соединений. Пример металлической решетки магния (рисунок XI-39).Количество корректировок для обеих структур составляет 12.In в первом случае имеется d «0.707 a», во втором случае-d = «a».Обе структуры позволяют упаковать мяч с максимально возможной плотностью.
Упаковка такого шара в обоих случаях показана на рисунке. ХІІ-4КВ. Рисунок XI1-40.Самая плотная упаковка шариков. 38) из-за строгой сферической симметрии частиц из упаковки 2 максимальных плотностей, шестиугольник явно энергетически немного больше (0,01%).Более тяжелые аналоги (с внешней оболочкой из 8 электронов) кристаллизуются как кубики с гранью посередине, в то время как они особенно характерны для твердого гелия.
Есть предположение, что это связано с возможностью приближения к тетраэдрической электронной симметрии, и структура последней (особенно свойства твердого метана) становится предпочтительнее. Рисунок XI1-38.Токийская фондовая биржа и куб.- Граненый край. РНС. XII-39.Сетка из металлических магнитов. Уэллс А. К. А. Ф. строение неорганических соединений. Пер с английского, пол рел. Д. П. Виноградова. М.. Выпуск, IW8. 690 секунд. Генерал рмонт Б. Ф. О строении неорганических веществ. М. Гостехтеоретнедат, 1950.968 сек 3D) упаковка шара с тем же радиусом для 1 или другого типа структуры заполнит следующее пространство.
Тип упаковки номер регулировки заполняющая часть, * незаполненная часть, ч Это 74-96 8 68 32 62 на 48 Тетраэдрит ее км (Алмаз)…. 4 34 66 Как видно из этих данных, даже в случае упаковки максимальной плотности, более 4-1 от общего объема выпадет, и между шариками останется пространство. 40) в самом плотном пакете свободное пространство состоит из 2 пустот: тетраэдра (он окружен 4 шарами) и октаэдра(он окружен 6 шарами).Каждый шар в упаковке имеет октаэдр odpa и 2 тетраэдрических пустоты.
Если радиус шарика в самой упаковке унифицирован, не нарушая основной структуры, то в октаэдрическую пустоту можно поместить шарики с радиусом до 0,41, а в тетраэдрическую пустоту-до 0,22.Такое заполнение пустот кристаллической решетки играет важную роль в некоторых химических взаимодействиях (например, во многих металлах и водороде). 41) о шарах, но если говорить о выпуклых многогранниках (капов I-кристалл), то основных типов таких многогранников всего 4.
В сочетании с одной и той же поверхностью вы можете заполнить пробелы без пробелов. Эти. Параллелепипед обозначается РНС. XI1-41 (L-куб, 5-шестиугольная призма, B-ромб-додекаэдр, G-равносторонний кубический октаэдр). РНС. Хп-41. Пардлдеохедра. 42) строго говоря, представления об атомах Подобно сферам, Ионы Маха и элементарные ионы полезны для свободных частиц с полными электронными оболочками.
Радиус такой частицы по представлению частиц определяется границами внешнего электронного слоя, и согласно концепции волновой механики он не может быть строго определен, так как нет четких границ электронного облака(рис. XI1-42). на практике радиусы атомов и ионов устанавливаются в отдельных частицах и являются истинными и эффективными, то есть основанными на рассмотрении различных групп (обычно кристаллов), соответствующих заданному множеству. 43) условно положение максимальной плотности внешнего электронного слоя (относительно ядра) можно считать истинным радиусом атома или иона.
Сравните такой «истинный» радиус некоторых атомов и ионов, найденный в теоретических расчетах ниже(A): L1 Na К Rb St-F CI Br I 1.59 1.71 2.16 2.29 2.52 0.40 0.73 035 1.04 Ли + на + К + и RB + С. + Ф-С!- Бром.〜 0.19 0.28 0.59 0.73 0.92 0.40 0.74 0.87 1.07 Как видно из приведенных выше данных, удаление внешней электронной оболочки (такой как Li — * — U * n) значительно уменьшит»истинный» радиус, а существующая оболочка будет содержать избыточные электроны(такие как F — + — F*).)
Почти неизменный. Сравнение значения радиуса максимальной электронной плотности внешней оболочки F «(0.40 а) с данными на рисунке XII-42 (это максимальное значение составляет около 0.20 а) показывает, как расходятся результаты теоретических расчетов, выполненных различными способами. Соотношение между «истинным» ионным радиусом и обычным эффективным ионным радиусом четко показано на рисунке 5. XII-43.
С точки зрения концепции микрочастиц приближение ионов на расстояния менее 2,31 а затруднено взаимным отталкиванием их внешних электронных оболочек (см. рис.111-52). 44) величина эффективного радиуса зависит в первую очередь от типа связи кристалла, которая изменяется очень резко при его изменении. В пределах одного и того же типа связи число смежностей, которые непосредственно окружают конкретную частицу, оказывает на них значительное влияние.
То есть координационное число является характеристической длиной структуры. Наконец, используя тот же вид связи и количество радикалов, эффективный радиус также изменяется незначительно в зависимости от химической природы частиц вокруг него. Однако изменение эффективного радиуса из-за этого фактора относительно невелико. F-нет. Аргумент состоит в том, что эффективный радиус почти постоянен в пределах одного и того же типа соединения и одного и того же числа конфигураций. Это позволяет предположить, что расстояние d в кристаллической решетке любой структуры получается из соответствующего радиуса сложением, то есть простым суммированием.
45) значение эффективного атомного радиуса металлоподобной структуры Сравните со следующими символами (A) Ли ИНН 1.55 1.13 N A Mg A1 1.89 1.60 1.43 К с * ка ти В кг МН Фе совместно Н1 со ЗН г * QE как 2.36 1.97 1.64 1.46 1.34 1.27 1.30 1.26 1.25 1.24 1.26 1.39 1.39 1.39 1.48 Rb Sr (Y Zr Nb Mo Tc » Ru Rh Pd Ag Cd In Sn Sb 2.48 2.15 1.81 1.60 1.45 1.39 1.36 1.34 1.34 1.37 1.44 1.56 1.66 1.58 1.61 Cs B a La Hf Ta W Rt Os lr Pt Au Hg TI Pb Bl 2.68 2.21 1.87 I. K) 1.46 1.40 1D7 1.35 1.85 1.38 1.44 1.60 1.7! 1.75 1.82 Фр р * ас 2.80 2.32 2.03 Ce Rg Nd Rp1 Sm Eu Gd Tb Dy Ho Er Tu Yb Lu 1.83 1.82 1.82 1.81 2.02 1.79 1.77 1.77 1.76 1.75 1.74 1.93 1.74 Ра и NP Пу Ам и CN ^ 1.80 1.63 1.64 1.50 1.60 1.82 1.74
Величина указанного атомного радиуса соответствует решетке наиболее распространенного координационного числа 12 для металлов, а при переходе к координационным числам 8,6 и 4 она должна быть уменьшена путем умножения на 0,97 соответственно. 0,96 и 0,88. 46)если вы рассмотрите данные в таблице выше, некоторые интересные моменты будут revealed. As как правило, с увеличением числа электронных слоев атомов однотипных элементов(то есть сверху вниз группы) радиус этих атомов увеличивается.
Однако промежуточные элементы в фазе (Hf-Au) фактически не имеют разницы в атомном размере от соответствующего атома в 5-м периоде (Zr-Ag), а атом актинида даже меньше, чем соответствующий атом лантаноида. Если причиной первой аномалии считается сжатие лантаноида, то второй причиной не является clear. It также неизвестно, почему ход изменения радиуса актинидов(минимальное значение в НП) отличается от хода изменения радиуса лантаноидов. Следует отметить атомные радиусы Ey и Yb (см. Рисунок X1-47) и «восходящий скачок» Am.
47) при использовании атомного радиуса элемента необходимо учитывать возможные различия в его происхождении. Например, в случае хлора таким радиусом является половина ядерного расстояния двухатомной молекулы, а в случае аргона-половина ядерного расстояния кристаллической решетки (атомы лишь слабо взаимодействуют с другими), а в случае калия-половина ядерного расстояния структуры металла(когда межатомное взаимодействие очень сильно).
Таким образом, из — за внешней «правильности», изменения атомного радиуса вдоль ряда CI (0.99)-Ag (1.92) — K(2.36 A), эти радиусы не считаются строго сопоставимыми. 48) значение дальнейшего эффективного ионного радиуса, приведенного в этом разделе, было определено на основе структуры типа NaCl, которая характеризуется координационным числом 6, и были приняты соединения, в которых взаимное влияние химических свойств ионов должно быть сведено к минимуму.
С переходом на координационное число 4 величина ионного радиуса уменьшается примерно на 6%, а с переходом на координационное число 8 увеличивается на 4%. 40) эффективный радиус аниона элемента, определяемый из кристаллической решетки, обычно меньше радиуса соответствующего инертного газа, а величина двухвалентного Иона даже меньше величины одновалентного Иона. При переходе от атома инертного газа к соответствующим одновалентным и двухвалентным анионам число электронов и их расположение не изменяется, а заряд ядра уменьшается, поэтому радиус ряда частиц должен быть увеличен.
Последнее, если определение эффективного радиуса можно проводить со свободным анионом, будет, несомненно, соответствовать результатам эксперимента. Но условия в Кристалле различны по своей природе. Это неудивительно, ведь анион подвергается действию ионов противоположного знака и очень большой силы притяжения. Действие этих сил не может повлиять на уменьшение эффективного радиуса, и уменьшение происходит с увеличением заряда ионов.
Таким образом, результаты экспериментального определения эффективного радиуса аниона элемента не противоречат основным представлениям теории атомных структур. 50) сравните эффективные радиусы (по разным авторам) некоторых Ионов, не включенных в нижеприведенную таблицу тела (а): О » 1.53 1П + Рв2 1.32 + 1.32 Pd2 + 0.88 ый rh3 + 0.68 В4 + 0,6 г Pd4 * 0.64 Ш » 1.99 Т1 * 1.49 Tl2 * 0.78 Рт2 + 0.93 АС3 * 0.69 Mn4 + 0.52 Os4 * 0.67 ЦН «[.92 1 + 130 v2 + 0.72 Tl3 * 0.69 Sb3 + 0.90 Mo4 * 0.68 lr4 * 0.66 NHJ 1.67 РА2 * 1.53 файлов CR2 * 0.83 В3 + 0.55 кислородных соединениях bi3 * юфи В4 * 0.68 Пл4 * 0.69 сы-1.85 см2 + 1.26 mn2 + с 0.91 Кк3 * 0.64 Се4 * 1.02 Ке4 + 0.69 cr5 не * 0.46 Нет » 2.19 ЕС2 + 1.23 ионов Fe2 + 0.83 мл * * ТР4 0.70 * 1.00 Т <4 * 0.89 mn5 комплект * 0.45 доб; 2.05 Yb2 * 1.13 СО2 * 0.82 Fе3 * 0.67 Tb4 + 0.89 По4 * 1.02 и5 * 0.98 О + 1.35 Се2 + 0.93 нл2 + 0.78 Со3 * 0.64 Тн4 * УО Ре4 * У6 0.71 * 0.80 Отель NH * СН2 1.43 + 1.12 Си2 + 0.80 Au3 * 0.85 У4 * 1.06 Ru4 * 0.65 Ре6> 0.52
51) для элементов семейства актиний и актинид приведены следующие значения ионного радиуса(а). Ac3 + Th3 + Us + Np3 + Pu3 + Am3 + CmS + Bk3 + I Th4 + Pa4 + U4 + Np4 + Pu4 + Am4 + Cm4 + Bk4 + I. I 1.08 1.04 1.02 1.01 1.00 0.99 0.98 | 0.99 0.96 0.93 0.92 0.90 0.89 0.88 0.87 как видно из этих данных, ряд изменений ионного радиуса наблюдается в ряду актинидов, как и в случае лантаноидов (XI§ 6).Обратите внимание, что абсолютные значения этих радиусов рассчитываются по-разному, поэтому их нельзя сравнивать непосредственно с приведенными выше абсолютными значениями (см. Данные Th4 и U4).
52) причина резкого уменьшения размера ионов при переходе от структуры инертного газа к 18-электронной оболочке наиболее ясно объясняется рассмотрением радиусов ионов E3*, показанных ниже для элементов лантаноидов. Здесь создается особенно благоприятное условие, поскольку изменение заряда ядра на целых 14 единиц влечет за собой изменение числа электронных слоев, но не изменение валентности ионов. * Элементы…….. La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Атомный номер. … 57 58 59 60 61 62 63 64 65 66 67 66 69 70 71 нет.. . 1.22 1.18 1.16 1.15 1.13 1.13!и!! 1.09 1.07 1.05 1.04 1.04 1.00 0.90
Как видно из этих данных, условия, в которых атомный номер элемента, при прочих равных условиях (число электронных слоев и число валентных) равна, сопровождается постепенным уменьшением радиуса Иона. Иными словами, притяжение электронов к ядру с ростом платы на последнюю единицу больше, чем взаимное отталкивание электронов, поскольку 1 из них вводится в существующий электронный слой.
В результате, когда 1 Протона (ядра) и 1 электрон (в существующих электронных слоя), одновременно вводят в Ион, эффективный заряд ядра несколько возрастет. Было высказано предположение, что эффективный заряд ядра (в единицах г) может быть приблизительно выражена простой функцией его стоимости, то есть, атомный номер соответствующего zremites^ эфф,-З / С 53) ясно, что подобное увеличение эффективного заряда ядра должно происходить непосредственно от Cap к Zn\, от Sc * +к Gau и т.
Количество электронных слоев не изменяется, поэтому размеры ионов уменьшаются. Структура » йовладнус * * 1 раднус ионная структура К * 1.33 0.98 0.35 КР + 8 Caa+ 1.06 * 23 0.83 Zn1 * 18 8 Sc3 * 0.83 0.21 0.62 Ga3 * 8 2 2 Т14 + 0.64 0.20 0.44 Се4 * 8 Кб * 1.49 036 1.13 А * * 18 18 сру 1D7 0.24 1.03 плееры * 18 8 yjt urn 0.14 0.92 In3 * 6 2 Zr4 * 0.87 0.13 0.74 Sn4 * 2 54) некоторые из более сложных ионов имеют определенный эффективный радиус. Примеры: (SnCle) 1 «-2.98, [NI (NHs)e]» *-2.58, [Co (NH9) 6] 3 *-2.5, [A1 (OH) b1 * + — 3.3 A. In в некоторых случаях сложные ионы могут сильно отклоняться от сферической симметрии.
Например, пероксидный Ион OJ — это сфероид с длинной осью 4,19 и поперечным радиусом 1,23 А. 55) радиус F задан в тексте на основе оптических данных (Вазашерна, 1923). первоначальная оценка»и О3″ была сомнительной. о ф Был предложен радиус 1,36 а, а для О8 разные авторы предложили радиус 1,35.1.36, 1,40 и даже 1,46 А. Это повлияло на радиус других ионов, определенный из общего ядерного расстояния (d).
Ниже приведены некоторые из их значений, используемых в наиболее популярных системах ионных радиусов(A):%Ли + Н + К + и RB + и CS + ф-ки-Бр-я- Голдшмидт….. 0.98 133 1.49 135 1.33 1.81 1.96 2.20 0.95 133 135 139 1.48 1.36 1.81 2.16 0.98 1.33 1.48 1.67 133 131136 2.19 0.97 запасы газа 1.47 1.67 133 131 1.96 2.20 Белофф я бок. 。 。 0.98 1.33 1.49 1.65 133 131 1.96 2.20 Быть * + МГ * + С. 2 + КР2 + Ба * + ы * «〜 ^ 78 1.06 1.27 1.43 1.32 1.74 1.91 2.11 0.65 0.99 ЛИС 135 1.40 1.84 1.98 МИ 0.65 0.94 1.10 1.29 1.48 1.90 2.02 2.22 0.66 0.99 1.12 1.34 1.40(34 1.98 231 074 1.04 1.20 138 1.36 1.93 2.
Разъема j1 Каждая из этих систем имеет свои преимущества и недостатки по сравнению с теми, которые показаны в основном тексте системы Гольдшмундта(1926), дополненной вычислительными данными polnng (1928), и на самом деле она не имеет более существенных преимуществ. С основной стороны, все эти условные системы ионных радиусов отличаются друг от друга, так как исходят из невозможности прямого определения в отдельных случаях.
56) В настоящее время распределение электронной плотности кристаллов некоторых солей уже известно. Рисунок XII-44 показывает такое распределение NaCI (Дает в единицах кривой электронной плотности-iseplots-e / A1). Границу между натрием и хлором естественно рассматривать как минимальную линию межканальной электронной плотности.
Это радиус Na4 на 1.17 A, радиус C! Она эквивалентна 1,64 А. аналогично распределению электрической плотности кристаллов UF (d = «2,01 а), длины Li4 0,92 и F 1,09 а», а кристаллов MgO (rf-2,10 а) — от 1, 0!Для Mg2 и для O2-1.09.Общее различие между фактическим ионным радиусом, видимым таким примитивным способом, и обычным обычным радиусом-это увеличение катиона и малых анионов.
Примерные значения для них и других размеров. Нет сомнения, что действительный ионный радиус, основанный на распределении электрической плотности, более точен по своей сути, чем условный. Но экспериментальных данных для их непосредственного определения пока очень мало. На, С1 «(нацмен) и мне**.О2 — (МГО).На основе экспериментально установленных значений в течение 6Lwa, реальные ионный радиус система была рассчитана в обычном порядке с исправленным числом 6(а): Литий + Н + К + и RB + С3 + П-ci_ Бр-я™ 0.94 1.17 1.49 1.83 1.86 1.16 134 1.80 23 S МД2 + С. 2 + КР2 + Б. 2 + О2-С2-Ѕе2 ′ 131131 1.47 1.65 139 134137137136 50 НС * у ТПС ^ Р-VSii- Ряса. Хит-44.
Распределение электронной флотации в кристаллах NiCi. Приведенные значения отличаются от предыдущих в среднем на±0,16 а для одновалентных ионов и±0,23 а для двухвалентных ions. As для аддитивности эта система хуже, чем обычно, но значения, принятые в F, значительно отличаются от 1.16 A(из данных кристаллов LJP).
С другой стороны, значение 1 определялось примерно одинаково по данным Кристалла CaFj. 10 А (и 1.26 для Ca1). вычисленный радиус F на основе экспериментальных данных решетки D и приведенных выше значений катионов изменяется в серии CsF-RbF-KF-NaF-LiF.、1.14—1.19—1.18—1.14—1.07 это будет А. Его уменьшение при переходе RbK-NaLt (и Rb—Cs), вероятно, связано со сжатием за счет поляризационного взаимодействия, в которое входит связь Co-stn, то есть ионная электронная плотность (LiF и экспериментально указанная.
Возможность непосредственного установления сходных особенностей взаимодействия ионов с отдельным корпусом дома, является главным преимуществом метода электронной плотности. Следует отметить, что получение и интерпретация данных об электронной плотности отнюдь не просты. Из-за этого результаты разных авторов часто бывают разными.
Например, рентгеновские исследования дифракции примесями КС1 доходность радиусе 1,45 а при K и с1т в 1.70, В то время как аналогичные исследования RbCl урожайность РБ на уровне 1,71 A и C! В 1.58 а был получен. Если мы сравним эти значения с приведенными выше, то увидим, что до сих пор нет единообразия в оценке фактического ионного радиуса.
Помимо установления такой однородности, переход к фактическому ионному радиусу потребует более чем менее радикальной модификации некоторых существующих теоретических концепций. ОИ может свидетельствовать о новом этапе в развитии кристаллохимии, который связан с некоторым отрывом от жесткой модели и повышенным вниманием к поляризации Ионов.
Но пока этого не произошло, она должна быть основана на условном условном радиусе (в основном, наиболее распространенная система gold Schmidt). 57) в том смысле, что ионный радиус не является строго ионным, необходимо отметить известную условность ионных радиусов. Поэтому расчеты, основанные на данных электронной плотности, показывают, что эффективный заряд кристаллов NaCI равен ) Составляет приблизительно±0,85.То есть они уже заметно отличаются (±1).по мере роста последнего такие разногласия нарастают.
Например, в кристаллах MgO эффективные ядра частиц гораздо ближе к±2, чем к ± 1, то есть если рассматривать их с точки зрения радиуса, то на самом деле это не 2 разреженных Иона Mg и О. 58) сложите 2 различные окружности разных радиусов так, чтобы 1 окружность радиуса K соприкасалась с максимально возможным числом окружностей радиуса A. Из модели рясы. XII-45 Ббттекает, что расположение по схеме/возможно только относительно значения радиуса K. Радиус А равен 0,15 и более, а 0,41 и более, согласно схеме I.
При переходе от окружности к твердому шару можно рассчитать минимальное отношение радиуса от той же модели и поглотить ту или иную конфигурацию с этим значением. Результатом этого расчета является Возможно с уважением Шарик номер а (регулировка Размещение мяч * К1 ″ В Число K) Ни меньше. Треугольник » напротив друг друга в вершинах тетраэдра 」
Кубический октаэдр Два Три 4 Б Линейный плоский ZnS NaCI CsCl 0.00 0.15 из 22 0.41 0.73 59) полученное соотношение можно подтвердить большим количеством однотипных соединений(исключая первый фактор, упомянутый в тексте), необходимо выделить вещества с относительно небольшими эффектами между собой (чтобы 3-й фактор можно было проигнорировать). Подходит соединение типа MX. Куда? М-Мг. СА, старший ВД Х О, С, СЕ. Те.
Соотношение РК / Ра рассчитано для них В таблице ниже: Мисс Су-ва О 0.59 0.80 0.96 1.08 С 0.49 0.61 0.73 0.82 ЮВ 0.41 0.56 0.86 0.75 Они 0,37 0,50 0,60 0,68 Как неудобны ее данные, почти все Диаграмма XII-45.Номер корректировки круглый D_______» __ Радиус отличается. Соединение Rk / Ra> 0,41 и, таким образом, mu можно кристаллизовать с решеткой типа NaCl. 1 исключение составляет MgTe. In в этом случае Rk / Ra будет меньше допустимого значения в типе NaCl grid.
As опыт показывает, что из всей рассматриваемой серии кристаллизуется только MgTe n с решеткой типа ZnS, а не NaCl. Хорошее согласие между теоретическими и экспериментальными результатами получено для следующих тройных соединений: Структура флюорита (К. Х. 8 и 4)’! Рутил(c. in l 3) Фторид 3F2…….. Ba Pb Sr Hg Ci Cd j Mn Zn Fe Co Nl Mg RkJR \ ………… 1.08 0.99 0.84 0.80 0.77 Дж 0.68 0.62 0.62 0.82 0.59 Оксид ЭОА……… Че У Се Пр ЗР \ ЗП Ш Т Е РЬ МО Тл В МН РК / РА………… b80 o «77 o * 76° — 66′ in * 67°-64 o-52°-52 0-39
Отклонение от теоретического соотношения Rk / Ra (0,73) показывает здесь только ZrOf. Такие единичные исключения вполне закономерны из-за шероховатости самой расчетной схемы. Для солей щелочных галогенидов согласие между теорией и экспериментом/ i не очень хорошо. Как видно из приведенного резюме значения РК / Ра LI M K Rb Cs Ф 0.58 0.74 1.00 1.12 1.24 КЛ 0.43 0.54 0.74 0.82 0.91 БР 0.40 0.50 0.68 0.78 0.84 1 0.36 0.45 0.60 0.68 0.75 LiBr и Lil должны кристаллизоваться только в соответствии с типом ZnS, и более половины оставшихся желез могут иметь структуру типа CSCI.
С другой стороны, все золи, кроме CsCI, CsBr и Csl, как полагают, кристаллизуются в типе NaCl. Это не противоречит приведенной выше схеме расчета (потому что значения LiBr и Lil Rk / Ra очень близки к граничному значению), но я тоже не уверен в этом. 60) по сравнению с другими кристаллическими структурами бинарных соединений тетраэдрическая решетка типа ZnS обладает некоторыми характерными особенностями.
Это наблюдается только в C, Si. Гэ, ЗП. Некоторые бинарные соединения, состоящие из продуктов взаимодействия (например, SiC) и элементов, равноудаленных в периодической системе от 4-го group. So, необходимым (но всегда достаточным) условием образования тетраэдрической структуры является наличие в общей сложности 8 электронов во внешнем слое обоих соединительных atoms. It также очень интересно, если суммы равны
Порядковый номер обоих атомов, расстояние между их ядрами, остается почти постоянным, как это обычно следует из следующих данных, например: Соединение……… НИЦ Аин АЛП ЗНС CuCl SnSn основе теллурида кадмия АГ Количество электронов во внешнем слое……….. 。 4 + 4 3 + 5 4 + 4 3 + 5 2 + 8 1 + 7 4 + 4 3 + 5 2 + 6 1 + 7 Атомный номер……. I4+ −6 13 + 7 14 + 14 13 + 15 30 + 16 29 + 17 50 + 50 49 + 51 48 + 52 47 + 5J д. А…….. 1.89 1.87 2.35 2.36 2.35 2.34 2.79 2.79 2.80 2.81
Таким образом, по данным того же типа и почти идентичные конструкционные особенности, вещества, которые существенно отличаются от химических стороне, например, зп и AGL, может кристаллизоваться. Из сравнения в случае SiSi и ZnS можно отметить, что в одной и той же D-решетке находятся вещества с суммой различных чисел атомов.
61) вследствие изменения внешних условий переход от одной кристаллической формы к другой является обратимым (энантио-тропическим) и необратимым (монотропным). примером первого является переход от ромбической серы к моноклинной (VIII§ 1 add.8), 2-й переход от кубического льда к нормальному льду (VI§ 3 add.42) и others.
In дело в том, что выполнять поляризованное дневное дыхание приходится гораздо чаще, чем монокулезное. 62) В некоторых веществах при изменении температуры происходит некоторая полиморфная метаморфоза observed. So при нормальном давлении NH4NO3 известен для 5 различных кристаллических форм, и точки перехода между ними являются PR −18,+ 32, 82 n 125 ° С.
Последний cc Lhx (кристаллизуется в кубической системе) характеризуется наличием свободного вращения обоих ионов. При давлении выше 9000 АТМ может существовать другая кристаллическая форма. Полная диаграмма состояния NH4NO3 отображается в RNS. XI1-46. 63) в принципе, RNS. XII-46, полиморфные превращения могут быть вызваны не только изменением температуры, но и давления.
Характер воздействия обонятельного фактора напрямую связан с различием в степени пространственного наполнения различных типов структур(39 дополнительных).Снижение температуры и повышение давления способствуют максимальному сжатию (серия ZnS NaCl CsCI), а повышение температуры и снижение давления, наоборот, приводят к более рыхлой упаковке (серия CsCINaCl ZnS). 64) полиморфизм чаще всего наблюдается, но не является единственным проявлением тех же самых особенностей химических элементов(II§ 4).
Например, аллотропия кислорода обусловлена не только его полиморфизмом (II§ 3 additional 3), но и различной атомарностью молекулы (Og n 03).Аллотропия зерна (XI§ 6 постскриптум 9) — обусловлена изменением электронной структуры атома. Аналогично, железо типа А и Р, магнитные свойства которого существенно различаются, является аллотропной модификацией этого элемента, несмотря на отсутствие изменений в кристаллической структуре в точке перехода (XI-23).
Поэтому неверно, что иногда наблюдается тенденция сводить изоморфизм к полиморфизму. 65) kc1-KBr система смешанного кристаллообразования тепла является слабым и отрицательным. Максимальный тепловой эффект(-0,2 ккал! Моль) соответствует 50 моль.%От каждого компонента ЧПУ. Интересно, что минимальная температура плавления системы составляет pr 63-65 моль. Кристаллы с содержанием% KBr и 25-65 моль.
Твердость% KBG составляет примерно в 2 раза больше, чем у каждого компонента. Образование смешанных кристаллов в системах KC1-RbCl(-0.2), KCl — NaCl(-1.0) и NaCl — NaBr (-0.4) является слабым эндотермическим процессом. RbCl-RbBr (-0,2 ккал / моль). Тысяча часов NH4NO3. Согласно м) Гримму(1925), изоморфизм возникает при соблюдении следующих основных условий: 1) однородность молекулярного состава компонентов(например, КБФ *.КМпО «и басо»);
2) Структура элементарных ячеек подобна друг другу. 3)размер элементарной ячейки довольно close. In в частности, для солей с ионами, такими как инертные газы, разница не должна превышать 6% в нормальном состоянии, а при температурах, близких к температуре плавления-13%. Значение размера элементарной ячейки четко показано на примере ряда LiCI(a = 5.13) — NaCI(5.62)-KSI (6.28 A).
Температура смешивания NaCl равна LiCI и K. образуются как CI, так и смешанные кристаллы, но последние 2 соли не образуют кристаллов друг с другом. Например, Nal (a * = 6.46) и Rb! В этом случае характерно, что смешиваемость ограничена. (7.31 A)> конечные решетки могут содержать только до 10% Rbl, а конечные решетки могут содержать только до 20% nals.
Есть несколько исключений из вышеуказанных правил. Например. LiF и UH проявляют полную смешиваемость, несмотря на то, что решетчатые формы этих соединений одинаковы, а их расстояния отличаются всего на 1,5%.Отклонения от общих правил в данном случае, вероятно, обусловлены различной электронной структурой обоих отрицательных ионов.
67) тот же тип был открыт в 1819 году. Тогда считалось, что изоморфны только те вещества, которые тесно связаны между собой химическими свойствами образующих их элементов. С другой стороны, из вышесказанного следует, что это условие ни в коем случае не является обязательным и fundamental. In факт, такие соединения, как Kbfa и BaS04, с признаками изоморфизма, показывают, что состав LICI и KCI ближе друг к другу, чем они очень похожи.
Поэтому предыдущая точка зрения в целом не верна. Однако это не мешает ей оставаться верной в определенных пределах, поскольку химически подобные аналоги очень хорошо реагируют на указанные выше изоморфные условия. Во внешней химии изоморфизм играл большую роль. Это связано с валентностью элемента, и с его помощью часто используется для установления его атомной массы.
Например, исходя из того, что соли Ho и Tm гомологичны соответствующим солям некоторых трехвалентных элементов, были установлены 3 валентности самих Ho и Tt, что позволило определить базовую энергию атома(зная его эквиваленты). 68) очевидно, что 2 типа изоморфизма должны быть distinguished. In 1 из них смешанные кристаллы образуются путем взаимного замещения отдельных компонентов молекулы (например, системы KCI-KBr-C1-и Bg-ions.
As еще 1, целые молекулы или только их агрегаты могут быть заменены друг на друга в кристаллической решетке(например, в системе KMn04-BaS04.) Практическим следствием этого является отсутствие образования смешанного кристалла подобных солей при 1 очень низкой концентрации компонента (так как возможность образования недоэкспонированных молекул в сильно разбавленных растворах ничтожна), но мала. Благодаря изоморфизму BaSO <и KMn04 кристаллы первого вещества легко содержат большие или меньшие количества второго вещества.
Таким образом, при осаждении BaSO <ns в растворе, содержащем KMP04, осадок становится красным или розовым. Частицы KMnO распределяются по всему кристаллу, так что во время промывки этот осадок не обесцвечивается. Химический анализ должен всегда учитывать возможность соосаждения такового (или на основе адсорбции-VII§ 3, дополнительно 10). * 9) в некоторых случаях смешанный Кристалл образуется с веществом, имеющим сходную молекулярную структуру, но тип кристаллической структуры отличается.
Такими изоморфными веществами являются, например, RbCI и CsCI. Однако в каждой решетке SC только 1 катоной может быть заменен другим Катоном до известного процента. 。 70) особый интерес представляет случай аномальной смешиваемости, когда смешанный Кристалл образован веществом, не имеющим ни молекулярной структуры, ни решетчатого типа.
Типичный пример: тот факт, что даже замена частей UF и MgFj, CaF *и YF * и YF *и YFj вряд ли увеличит размеры кристаллической решетки флюорита, указывает на наличие»свободного»места, заполненного дополнительным не-F. максимум 40 моль для Кристалла CaFj.%YF может быть включен«.Систему PbPj-YF можно также использовать в непрерывных твердых растворах. 71) различают 3 типа структур твердого раствора(XI§ 3 add.6).
Начиная с пространственной решетки вещества A, замена постоянного числа частиц A равным числом частиц B приводит к структуре замещения, в то время как замена небольшого числа частиц B приводит к структуре вычитания, а дальнейшее включение частицы B в решетку a приводит к структуре инжекции.
Последнее возможно благодаря «свободному» расположению исходной пространственной решетки и только в том случае, если промежуточные частицы существенно меньше ее (например, в металлах отношение радиусов обоих атомов обычно не превышает 0,6).Фракционные твердые растворы (иногда рассматриваемые как частный случай интерстициальных структур) встречаются редко. Так называемая надстройка, когда замещающие частицы естественным образом располагаются в решетке. Имеется обзорная статья о структуре твердых и жидких растворов.
72) например, при введении смеси CaClj в решетку kc1 получается твердое вычитающее решение. formed. To поддерживая электрическую нейтральность, 1 Ион Ca * +должен заменить 2 K * non, поэтому плотность Кристалла не увеличивается (по аддитивному закону), но, как ожидается, уменьшится. Рисунок XII-47, эксперимент* — » файмая хорошо согласуется с теоретической. То есть рассматриваемая система, безусловно, является верным решением вычитания.
73) образование твердого раствора является частой причиной отклонений состава вещества от стехиометрического (валентного) соотношения. Если эти отклонения невелики, то они обычно учитываются, но иногда влияют на некоторые свойства рассматриваемых соединений (например, было показано, что максимальные температуры плавления PbS и PbTe не соответствуют атомным соотношениям 1: 1.0003: 1 и J 1.004).Однако существует множество таких веществ, в которых кактус с постоянной кристаллической структурой может изменяться в большей или меньшей степени.
Хорошим примером является оксид ванадия (IX§ 7 ext.52), кристаллическая структура которого является ВОО. она стабильна в диапазоне от W до VOjj. Из всех промежуточных стадий такого переменного состава кристаллическая фаза VOj. Только для M производные ванадия получены в той же рациональной стехиометрической зависимости (VFa, VCI * VBr2, VI2, VSO -). в период этой фазы VOj. только ОО следует рассматривать как соединение. Для так называемых нестехиометрических соединений имеется монографическое изложение И.
74) как видно из вышеизложенного, размер атома и Кока играют важную роль с точки зрения структурных особенностей Кристалла. Несомненно, многие другие свойства твердых тел также сильно зависят от них. Но CaC12, MOL.%- Ю ’ 4 Рисунок HP-47. Изменение плотности системы KS| — СяС1, [«/(с*3-10^)]. * Бохай Г. Б. успехи в химии. 1954.М5. 60-е годы. * * Нестехиометрические соединения. Эд. Л, Mandelkorn. In Английский, Изд. К. В. Астахова. М «химия». 1971, 607 секунд、 Закономерности, которые здесь делаются, еще не очень изучены.
Имеется обзорная статья*о составе и свойствах ионных кристаллов. 75) лучше других стоит проблема твердости кристаллов. Последний обычно оценивается по условной дробной твердости scale. It в основе лежит следующий набор природных минералов, расположенных в порядке возрастания твердости. 1. Т » лысый (I) 3.Кальцит (9) 5.Апатит (41) 7.Кварц| / 300)9.Корандум (33 000) 2. GNPS (1.3) 4.Флюорит(25) б. Освейлер (830) 8.
Топаз (5100) 10.Алмаз (5 000 000). Цифры в скобках почти характеризуют истинное соотношение твердости отдельных минералов в рассматриваемой шкале (тальк считается единицей измерения). как видно из этих цифр, условная шкала на самом деле очень неравномерна(кроме того, Алмаз тверже талька, а не в 10 раз).Но это 500 миллионов раз). При использовании фракционной шкалы твердость вещества определяется его устойчивостью к парапану.
Например, стекло царапает минерал I-4, а затем минерал 6-10.Поэтому, своя твердость около 5.By устанавливая отношение стекла к Апатиту, оценку можно сузить до 10-минутной шкалы, равной 1.Материал с твердостью менее 2-это гвоздь, с твердостью менее 5-обычный нож, с твердостью менее 7-рашпиль. Из-за анизотропии свойств кристалла измерение твердости методом царапин дает разные результаты для одного и того же материала в зависимости от выбранной поверхности кристалла и направления хода. Из вышесказанного видно, что рассматриваемый метод очень прост и в то же время очень груб.
76) для однотипной решетки и постоянной валентности ее структурных элементов твердость кристаллов возрастает по мере уменьшения расстояния между ними (</).Таким образом, увеличение радиуса решетки атомов ионов nln приводит к уменьшению твердости кристаллов.
Решетка NaCl Вещество.©……… MgS CaS SrS BaS 2 CaO CAS CaSe CaTe Раднус переменный Ион. А 0.78 1.06 1.27 1.43:1.32 1.74 1.91 2、| т. Твердость………. 4,5-5 4.0 3.3 3! 4.5 4.0 3.2 2.9 ЗНС гриль Вещество………. Бес ЗНС компакт-дисков иго Дж ЗНО ЦНС и ZnSe znte на Перемежающийся шум Раднуса. В 0.34 0.83 1.03 л./ 2 Дж 1.32 1.74 1.91 2.11 Твердость………. 7.5 4 3.2 3 I 5 4 3-4 3 。С другой стороны, при инвариантном типе решетки и расстоянии между частицами, чем выше валентность, тем выше твердость! Тип решетки NaCl тип решетки ZnS Вещество……………….. Наф МГО ТВН ТИЦ д. А…………………….. 2.31 2.10 2.23 2.23 Валентный……… I 2 3 4 Твердость……………….. 3.5 6.5 7.5 8.5
Необычайная твердость алмаза обусловлена особенно благоприятным сочетанием обоих факторов: коротким ядерным расстоянием (</»1,54 А) и высокой валентностью углерода (4). 77) как и в случае твердости, существенная зависимость ионного радиуса наблюдается также от степени сжатия salts. As например, данные, показанные ниже, показывают тот же тип сжимаемости решетки(т. е.、 Селенида Цинка Бромида Гаас Геге 2.43 2.44 2.45 2.46 12, 3, 4. 2.5 3.5 4.5 8.5 * Воробьев А. А. и успехи химии. 1967, привет 6.1065、
Увеличение объема ПРН давлении) возрастает с увеличением радиуса ионов переменной: Вещество………. Нацмен нацмен ККИ RbCl NaBr нал Радиус не является переменным. А 0.98 1.33 1.49 1.81 1.96 2.20 Относительная степень сжатия 1 1.35 1.77 1 1.2! 1.68 Изменение типа решетки сильно влияет на сжатие ratio. So, несмотря на большой радиус цезия (1,49 а) по сравнению с рубидием (1,65 а), это степень сжатия хлорида.
Бромид цезия и nod (тип CsCl) не больше или немного меньше, чем соответствующая рубидиевая соль (тип NaCl). 78) относительное тепловое расширение соли отличается от сжимаемости: Нацмен ККИ RbCt я нацмен NaBr нал я 0.95 0.90 я 1.08 1.20 Как видно из приведенных выше данных, роль увеличения размера катиона Анона здесь различна.
Переход к структуре типа CSCL приводит к резкому увеличению относительного теплового расширения (например, в случае самого CsCl оно составит 1,25). 79) энергия кристаллической решетки также напрямую зависит от ионного радиуса(III§ 8 add.2).Для соединения ярко выраженного ионного типа его можно приблизительно рассчитать по формуле капстонского. УКУАЬп (0.345 \ U = » 287,2 * 11—; -) ккал / моль РК + ра \ ’ к + ГА / Здесь валентность катиона VK n Va-N анионов; r k и rA — их радиусы (по Гольдшмундту), а 2 l-число ионов в химической молекуле соединения.
При сравнении различных соединений между собой удобнее выражать энергию кристаллической решетки по расчетам с грамм-эквивалентом вещества, а не с грамм-молекулой(AB. AB2.It возможно прямое сравнение ионных взаимодействий таких соединений, как A2B3.)) Для такого грубого сравнения можно использовать более простое уравнение V-4-V 260 — — — ккал / г-экв К + ГА’ Имейте в виду, что погрешность вычисления обоих выражений может быть значительной.
Это особенно верно, когда поляризационное взаимодействие ионов играет важную роль. 80) используя приведенную выше формулу, можно рассчитать энергию кристаллической решетки ионного соединения, если среднее значение соответствующего неионного радиуса заранее определено обратным расчетом экспериментальных данных.
Такой «термохимический» радиус многих анионов сравнивается с меньшим<e (A). Он «СГ-СП-НК〜N07 nhj «hcoo» сн3соо «ной * ГСИ «входит в сотню самых крупных» Ио〜 1.40 1.95 1.82 1.95 1.55 1.30 1.58 1.59 1.89 2.00 л. 9л 1.82 БФ ^ ГСИ ^ «мно-Ио-Высшим советом найти „Seoj“ CroJ „со * — poJ — AsoJ“ бя〜 2.28 2.36 2.40 2.49 1.63 2.30 2.43 2.40 1.85 2.38 2.48 1.91 Исходя из радиуса катиона (по Гольдшминду) и приведенного радиуса аниона, можно получить приближенные значения энергии решетки, такие как нитрат, сульфат, что определяет целесообразность термической химии.
Сравнение радиуса и hx определяется кристаллической структурой cs (дополнительно 50).Близкое сходство в некоторых случаях(пример: SH») и сильное В системе термохимических радиусов существует несколько внутренних противоречий(например, не увеличение! Но уменьшение объема серий CIO) — BrOJ » — IOJ), исключает возможность понимания их как реальных пространственных units. It выполняет только чисто расчетливую роль.
81) большинство неорганических соединений находятся в нормальном твердом состоянии при нормальных условиях, но они не являются самыми важными и интересными для химии. Эта, казалось бы, противоречивая ситуация обусловлена тем, что химические процессы происходят не между агрегатами частиц, а между отдельными молекулами или их частями (ионами, радикалами), причем, как правило, не в твердой, а в жидкой или газовой фазе.
Излишне говорить, что многие структурные данные, полученные из твердотельной статики, могут быть успешно использованы для изучения динамики химических превращений. Однако следует помнить, что структура веществ, находящихся в разных агрегатных состояниях, не всегда остается одинаковой. Самым простым примером является NaCl, который имеет ионную и молекулярную структуру в Кристалле.
82) с 1912 года предметом бурно развивающегося анализа структуры реагентов является в основном твердое вещество (III§ 8).Технически более сложные структурные исследования неорганических соединений в шпале в последнее время стали широко развиваться, а в расплаве и растворе они еще не проводились. Таким образом, структурная неорганическая химия получила ярко выраженное «одностороннее * развитие» к твердому состоянию вещества, и оно вышло на первый план.
Это привело к попыткам «видоизменить» существующую химическую концепцию в духе кристаллографии путем смещения акцента с молекулы вещества на кристалл, с состава вещества на кристаллическую структуру, с валентности атома и его комбинации на его координацию в кристалле. С этой точки зрения недопустимо оперировать, например, молекулярным представлением вещества с кристаллической структурой noi.
Нормальная шпинель (XI§ 2 add.36) не считается таким простым силикатом, как алюминат магния и силикат. Если есть вариации в атомном соотношении (например, см. Дополнительные 73), его можно интерпретировать как «химические соединения с переменным составом» (поэтому обратите внимание на критерий валентности).Формула соединения может изменяться в зависимости от структуры твердого вещества.
Поэтому» очищенная «Формула NaeCle была предложена для» хлорида натрия » (отражающего 6-кратную координацию каждого нанокристалла в Кристалле), а SiO2 / 2 для диоксигена (отражающего 4-кратную координацию кремния и двойного кислорода) были забыты. Химическая формула должна отражать вещество (например, NaCl), но не другие состояния вещества (например, Na «Cle).1. одна вещь субстанции-обычно-такой подход абсолютизации агрегатного состояния является типичным примером формальной логики.
Предполагаемая тенденция односторонней ориентации неорганической химии и кристаллографической обработки веществ в корне неверна (поскольку каждая наука имеет право иметь свои критерии) и по существу (поскольку она не отвечает задаче изучения химических процессов).
С его дальнейшим развитием такая (отнюдь не прогрессивная) тенденция приведет к отделению»ионного»неорганического hmnnn от»молекулярного»органического. С другой стороны, химия-это 1, главным назначением которого всегда является молекула. Именно поэтому описание химической формулы веществ, принятой в химии, является по существу молекулой, обеспечивающей единство химических реакций, их четкость и легкость регистрации.
Смотрите также:
| Вторая группа периодической системы | Щелочноземельные металлы |
| Бериллий и магний | Подгруппа цинка |

