Оглавление:






Кристаллическое строение элементов
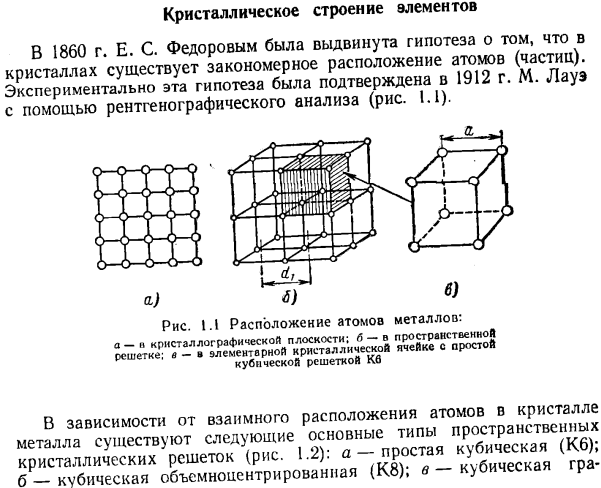
- Кристаллическая структура элемента 1860 г. Е. С. Федоров выдвинул гипотезу о том, что в Кристалле существует регулярное расположение атомов (частиц).Эта гипотеза была установлена в 1912 году с использованием рентгеновского анализа M. It было экспериментально подтверждено Лауэ (рисунок 1.1).
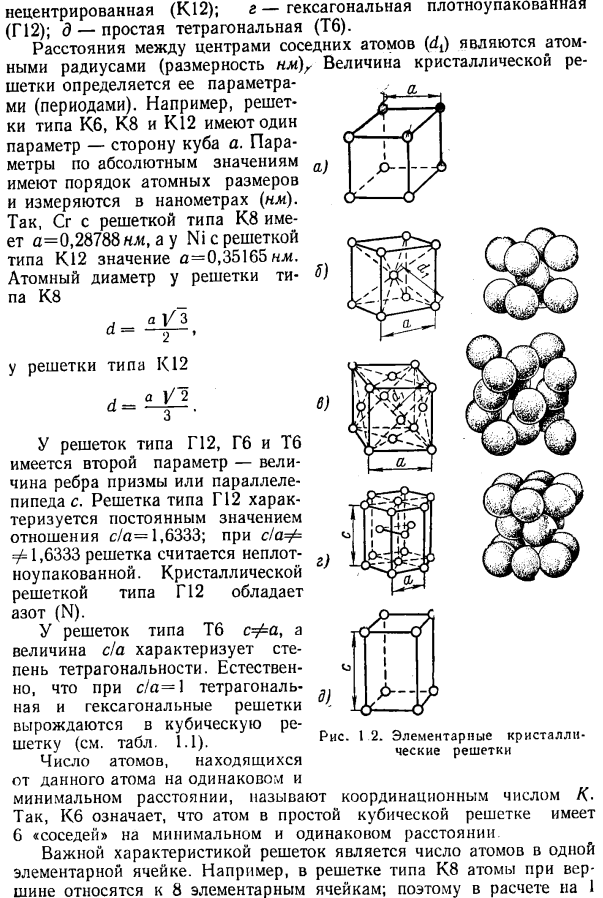
Рисунок 1.1 расположение атомов металла: а-n граней кристалла; б-в пространственной решетке; в-в основной кристаллической ячейке с простой кубической решеткой Kb В зависимости от взаимного расположения атомов в металлическом кристалле существуют следующие основные типы пространственной кристаллической решетки(рис.1.2): а-простая кубическая (КБ). б-кубический центр (К. 8); в-кубическая Гура Non-центризовать(к 12); г-гексагональная (г12); д-простой тетрагональной (ТБ).
Расстояние между центрами соседних атомов/ Радиус кисти (размер Нм) определяется ее параметрами (периодом). Людмила Фирмаль
Например, в решетках типов KB, K8 и K12 имеется 1 параметр-сторона a Куба. Абсолютное значение параметра имеет порядок атомного размера и измеряется в нанометрах (Нм).Поэтому, для CR, используя К8-тип решетки, а 0.28788 к, ч, а для Ni используя К12-тип решетки, а = 0.35165 Нм.
Атомный диаметр решетки К8 В обтяжку. в обтяжку. (dt) — это атом-количество перекристаллизации Кристалла К12 гриль Решетки типа G12, GB и Tb имеют размер ребра призмы или 2-й параметр, параллельный c. решетки типа G12 имеют отношение c! Он характеризуется постоянным значением A = 1,6333. с! для a =£1.6333 решетка рассматривается dense. In в кристаллической решетке типа G12 присутствует азот (N).
- Для решетки типа Tb c =£a, а величина c / a характеризует степень тетрадности. Естественно, если c / a = 1, то квадратная решетка и гексагональная решетка вырождаются в кубическую решетку (см. таблицу 1.1). Количество атомов в одном положении от данного атома Рис 2.Элементарная кристаллическая решетка Минимальное расстояние, называемое номером регулировки/<.
Таким образом, Kb означает, что атомы в простой кубической решетке имеют 6 «соседей» на минимальном и равном расстоянии Важной характеристикой решетки является количество атомов в 1 единичной ячейке. Например, в решетке K8 атомы в вершинах принадлежат 8 единичным ячейкам. Поэтому на 1 клетку приходится 1/8 атомного объема. Это означает, что каждая базовая ячейка имеет 8-H = 2 атома и так далее.
С другой стороны, Центральный атом полностью связан с элементарной ячейкой. Людмила Фирмаль
Все элементы имеют внешнюю валентную оболочку, число электронов которой равно числу групп (1 для щелочных металлов, до 8 для инертных газов) и 1 или 2 для щелочноземельных металлов (I и II основные группы).Для всех элементов, начиная с III группы, p-оболочка состоит из 6 электронов, вращающихся в овале Орбитальное и «Электронное облако» * 3 вертикально расположенных эллипсоида с большими осями в виде» гантелей » или взаимно прямоугольных. Для всех элементов, начиная с группы III, внутри<1-и/-электронная оболочка завершена.
Таблица 1.1 Кристаллическая решетка металлических элементов Тип металла решетки в-Ти 1.5873 а-так 1,623 Мг 1,6235 0-СА 1,638 Г12 А-Н 1.64 ЗН 1.8563 Компакт-диск 1,8859 K12 Cu, Ag, Au, A-Ca. Т-Фе, п-ко, П-Н 1.0 КБ 7-ка, ба, п-ти、 Мегабайт. Та, Ш, п-Фе, СГ, МО 1.0 Поскольку структура электронной оболочки вне атома также определяет кристаллическую структуру элемента, атом щелочного металла теряет единственный слабо связанный валентный электрон из-за малого размера первого потенциала ионизации и образует положительный однозарядный Ион с острием p1.
Взаимодействие между этими катионами и»электронным газом», образованным из отделенных s-электронов, создает металлическую связь, которая притягивает ионы. Из-за прямоугольности Р-оболочки вдоль 3-х осей декартовых координат, в случае орбитального взаимодействия с соседними ионами Р-подоболочки, ионы перестраиваются в решетку Kb type. In в пространстве внутри этого куба образуется решетка типа К8 (распространенная в большинстве металлов), которая составляет не более 1 и состоит из 2 простых кубических решеток, как бы вписанных одна в другую.
Большинство металлов обычно характеризуются полиморфизмом, так как при низкотемпературной модификации используется плотный пакет (K 12, G 12), а при максимальной температурной модификации-K8. Наиболее плотные решетки быть, мг, а-и FL-ка, А-и FL-Ср, Аль,-T1 и ПБ. Остальная часть металла имеет решетку типа К8. Слабо заостренные внутренние электронные d-и/ — многие элементы с оболочкой имеют типичную металлическую структуру типа KZ, K12 или G12.
Наличие кв-решетки в этих элементах объясняется тем, что после отделения всех валентных электронов извне они имеют pb-суб-оболочку с 6 электронами, которая образует овальное»электронное облако», с которым взаимодействуют ионы. Тип решетки К12 является наиболее плотным package. In в случае этой решетки 2-кратное расстояние между наиболее плотно упакованными октаэдрическими плоскостями, деленное на кратчайшее расстояние между соседними атомами в той же плоскости d, совпадает с отношением идеальных параметров решетки типа c / a — 1,6333 G12.
Мульти-этап преобразования Оптимально устойчивой (практически существующей) структурой элемента является кристаллическая решетка, обладающая наименьшим запасом свободной энергии силы F. поэтому в твердом состоянии Li, Na, K, Cs, Mo, W и другие элементы имеют решетку K8,а Al, Ca, Cu, Ag, Au, Pt и др.- Тип решетки ГБ. Однако, если температура и изобарные условия изменяются, другие структуры могут стать более стабильными в некоторых металлах. Например, известны Fe с решетками K8 и K12.
С Co-типом решетками K12 и GB. xMn, Sn, Ti и другие элементы с различными типами кристаллических структур. Полиморфизм (анизотропия) металлов заключается в их способности образовывать различные кристаллические структуры при изменении температуры. Процесс перехода от одного типа кристаллической структуры к другому называется полиморфизмом (аллотропным) превращением (или перекристаллизацией).
Полиморфные превращения сопровождаются экзотермическими или эндотермическими эффектами и происходят при определенных температурах. Различные кристаллические формы 1 элемента составляют ряд изменений(см. таблицу 1.2). Вариант модификации элемента обозначается буквами a, p, y, b и др., а а соответствует варианту присутствия при самой низкой температуре. Полиморфизм по существу является технически важным металлом-Fe, Sn, Co, Mn, T1 и др. На рисунке 1.3 показаны кривые полиморфных превращений при охлаждении и нагревании.
Полиморфизм может проявляться по принципу Паули. Однако накопление свободной энергии F зависит от температуры T. As в результате при определенной температуре производятся оптимальные и стабильные модификации: a, 0, y и др. Таблица 1. 2 Форма полиморфизма (аллотропизма) элементов Элемент 11 полиморфные формы, установившийся температурный диапазон, СС, кристаллическая решетка гипса.
Фе < 911 И 1392-1539 К8 т911-1392 К12 450 г12. 0 450-1480 К12 SN A < 18 КБ комплекс 0 18-232 Т8 < 700 КБ комплекс Мп 0 700-1079> 7 1079-1143 г12 Б 1143-1244 К8 Ти в <882 г12 0 882-1660 К8 Температура превращений полиморфизма (аллотропизма) характеризует интервал, на котором происходит переход элементов от одного изменения к другому. Вот почему у нее есть 2 температуры полиморфного преобразования: 911 и 1392°С. Однако, полиморфизм железа является специфическим.
Новообразованная полиморфная модификация представляет собой следующий сложный Кристалл structure. In кроме того, полиморфизм различных элементов имеет определенные характеристики. Рисунок 1.3.Кривые полиморфных (аллотропных) превращений при охлаждении и нагревании. Появление центров кристаллизации и роста кристаллов, сходных с кристаллизацией из жидкого состояния. При полиморфном превращении в твердом состоянии элементы склонны к переохлаждению.
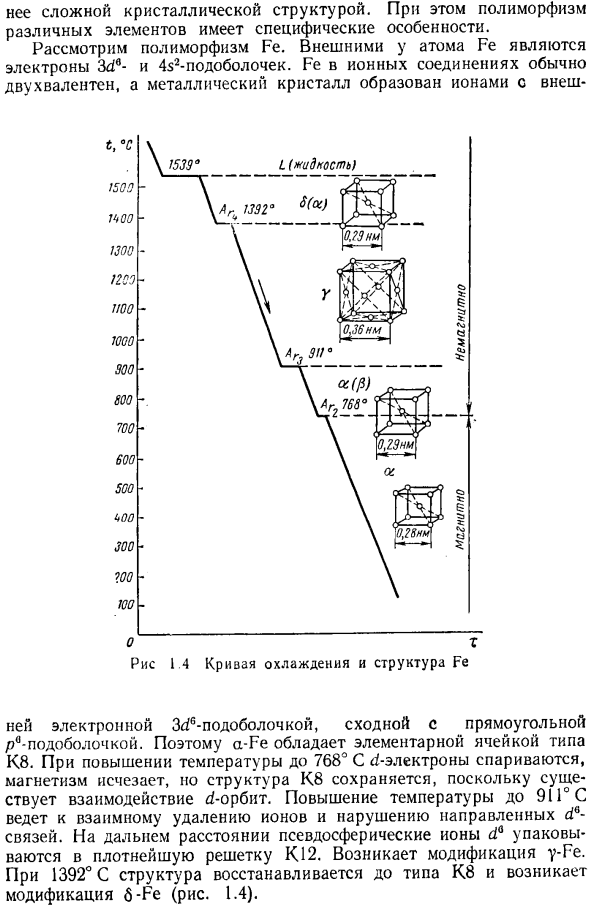
Зависимость свойств от переохлажденности полиморфной модификации такая же, как и в случае кристаллизации из жидкого состояния. Как правило, высокотемпературный риформинг обладает большой пластичностью、 Рассмотрим полиморфизм железа. В конфигурацию 4s2 3d6 и подуровне электроны вне атома железа. Fe в ионном соединении обычно является двухвалентным, а металлический Кристалл образуется Ионом с внешней стороны Электронные 3C / 6 подоболочки похожи на прямоугольные subshells. So, a-Fe имеет решетку блока типа K8.
Когда температура повышается до 768°С, что является электронной парой ci°, магнетизм исчезает, но из-за d-орбитального взаимодействия структура K8 сохраняется. При повышении температуры до 91°с ионы удаляются друг от друга, что приводит к нарушению указанного d°bond. At на больших расстояниях псевдосферы ионы dQ упаковываются в наиболее плотную решетку K12. изменения y-Fe происходят. При температуре 1392°C структура восстанавливается до типа K8 и происходит модификация b-Fe(рис. 1.4).
Согласно принципу Паули, переход к другой модификации структуры происходит при температуре T и разности свободных энергий AF = 0. При малейшем изменении объема тепловой эффект полиморфизма L можно рассматривать как результат изменения внутренней энергии\ E. тогда тепловой эффект энтропии 5 =полиморфизм Изменение D / 7 в зависимости от T обусловлено изменением теплоемкости C. следовательно, при нагревании элемента до dT с удельной теплоемкостью、Поглощенное тепло согласно первому закону термодинамики йд = де = С / Т、.
Однако, энтропия увеличивается, в то же время: cpdt аппликации Когда температура изменяется от T до T + dT, свободная энергия изменяется dF = dE-TdS-SdT、 Иначе говоря (ИЦ Т \ — ^- и J-СДТ — одр. При температуре T, свободная энергия т. F = FO-F СДТ. И затем… Однако при 0°к 1. Таким образом, G уменьшается с увеличением T, и чем меньше Cp, тем F уменьшается с увеличением T. Из модификаций воздух a-модификация более стабильна при£0, а Cp меньше и относительно ниже T.
Однако при нагревании до высокого T в результате значительного падения F и увеличения C Р-модификация становится стабильной. Магнитное преобразование Металлы, такие как Fe, Co и Ni, обладают хорошими ферромагнитными свойствами, но эти ферромагнитные свойства снижаются при нагревании. П. А. Согласно Кюри, полная потеря ферромагнитных свойств происходит при определенной температуре(точка Кюри/ к- В отличие от Полиморфа, магнитное превращение не связано с изменениями кристаллического превращения с термической историей.
Структура (рекристаллизация) и Рисунок 1.5. Зависимость ферромагнитных свойств Fe. Нью-Йорк. Низкотемпературный Магнитное преобразование является результатом изменения структуры электронной оболочки вне атома ферромагнитного элемента. При охлаждении ниже ферромагнетика магнитное преобразование является обратимым, поскольку силы отталкивания Fe, Co и Ni уменьшаются и увеличиваются (см. кривую на рис.1.5). Для чистых металлов температура магнитных и полиморфных превращений не является same.
So, в Fe магнитное преобразование a — > / 3 происходит при 768°C, но полиморфное преобразование a (p) -> y-911°C (в Полиморфном преобразовании структура K8 преобразуется в K12, и Магнето-удержание этой структуры-происходит). В Co точка Кюри составляет 6 < > 1000°С, а полиморфизм осуществляется при 420°С (с переходом от структуры Г12 к структуре К12). Анизотропия свойств кристаллов Анизотропия — это разность свойств монокристалла (элемента) в зависимости от направления нагрузки.
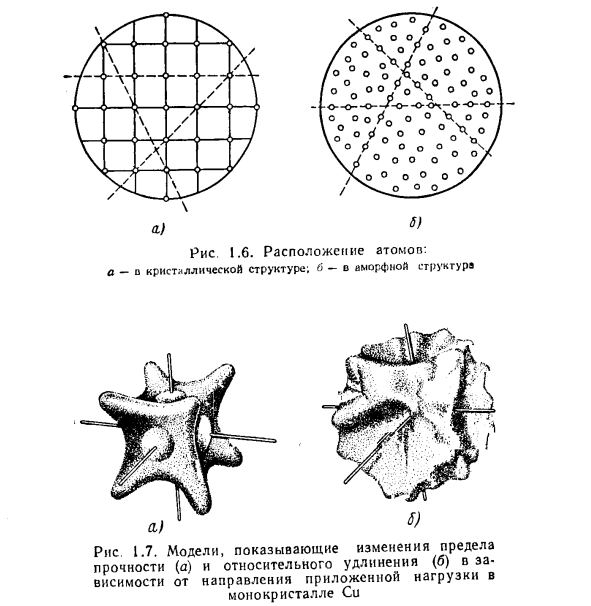
Анизотропия обусловлена неравномерным расположением и плотностью атомов в зависимости от плоскости и направления (рис.1.6, а). В отличие от аморфного вещества, которое является изотропным (рис.1.6.6) (то есть обладает идентичными свойствами в результате плотности упаковки одних и тех же атомов во всех плоскостях и направлениях), кристаллические вещества (в том числе металлы) и монокристаллы различной ориентации являются анизотропными (квазиизотропными) веществами (рис. 1.7).
Используя правильную обработку, можно устранить анизотропию, если придать всем монокристаллам конкретного элемента равномерную ориентацию. Кристаллы имеют плоскость скольжения (расщепления), по которой атомы (ионы) кристаллической решетки движутся под механическим воздействием. Пластическая деформация наиболее эффективно осуществляется на плоскости с наибольшей плотностью атомов. один.) 6.) Рисунок 1.6.Атомное устройство: а-о кристаллической структуре; б-о аморфной структуре Рисунок 1.7. Модель, показывающая изменение предела прочности (а) и относительного удлинения (б) в зависимости от направления нагрузки, приложенной к монокристаллу Cu
Смотрите также:
| Строение атомов, межатомная связь и периодическая система элементов Д. И. Менделеева | Строение и свойства реальных кристаллов |
| Газонаполненные пластмассы | Плавления и кипения металлов |

