Оглавление:




Краткая характеристика элементов главной подгруппы III группы
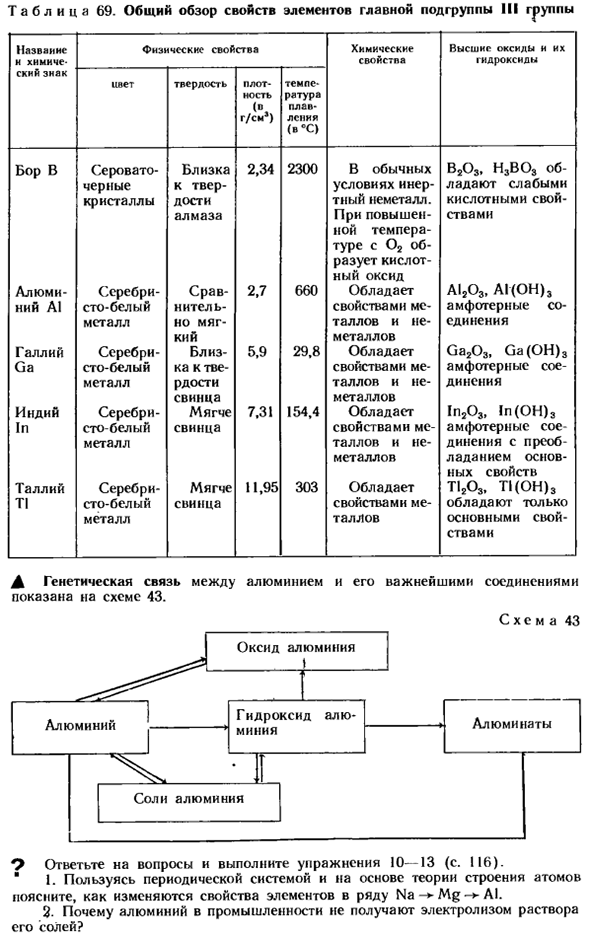
- Краткое описание элементов основной подгруппы III группы Основными подгруппами III группы являются элементы бор B, алюминий A1, галлий Ga, Индий In и таллий T1.Шаблон, изменяющий свойства элементов в группе. (I, с. 116) позволяет точно предсказать, что неметаллы являются бором, а металлы преобладают в таллии.
- Можно также ожидать, что галлий и индий обладают обоими свойствами (таблица 69). Таблица 69. Название и химический символ физические свойства химические свойства высокие оксиды и их гидроксиды Цвет твердость плотность г / см) температура плавления (°°°С) Боуэн в сероватом-закрыть 2.34 2300 b203, h3bo3 rev- Инертный слабо от черного до твердого состояния
Общий обзор свойств основных элементов подгруппы III группы Людмила Фирмаль
Кристаллы-это неметаллы, которые являются приемлемыми. Кислый Бриллиант Температура Тур 02 от оборотов Генерация кислоты Окись Алюминий-серебро-Срав-2.7 660, a1203, A1 (oh) 3 Нью-Йорк А1 бисексуалов сто белый характеристики neritels Мягкие металлы и неметаллы Металлическая очередь Галлий серебряный-5,9 около 29,8 обладает Ga203, Ga (OH) 3 Состав от га сто белый ка до ТВ свойства Высокая и нерушимая радость металла
Свинец металлический Индий серебряный-мягкий 7.31 154.4, 1p203, 1p (OH)3 Сто белых свинцовых свойств амфотерных соевых бобов Высокий металл, который преобладает и не деформируется Основные металлы Физические характеристики Таллий серебряный-тендер 11.95 303, t1203, T1 (OH) 3 Характеристики Ti 100 белый свинец Металлический Тор Государство Генетическая связь между алюминием Jt и его основными соединениями показана на рисунке 43. Рисунок 43 Ответьте на вопросы и выполните упражнения 10-13(стр. 116).
1.Используя периодическую систему, мы объясняем, как изменяются свойства элементов ряда Na-* Mg Mg, основываясь на теории атомных структур. 2.Почему алюминий в промышленности не получают электролизом раствора его солей? 3.To для получения алюминия в качестве восстановителя можно использовать металл calcium. It описывает этот процесс, создает формулу реакции и указывает на переход электронов.
Почему эта реакция не может быть в водном растворе? 4.Алюминий создает уравнение убывающей реакции. а) галоген; б) железо; в) ионы водорода; г) сера; д) кислород; указывает на электронный переход. 5.Алюминий создает формулу реакции, которая уменьшает содержание ионов меди в воде solutions. It показывает электронный переход и показывает окислитель.
6.Is там окислитель: а) атомы алюминия. б)ионов алюминия? Подтвердите ответ формулой реакции. 7.To для получения хлорида алюминия можно использовать обмен, замещение и реакцию соединения. Создайте уравнения для этих реакций. 8.Раствор щелочи постепенно (в избытке) добавляли к раствору сульфата алюминия. Что же наблюдалось? Создайте уравнение для соответствующей реакции.
- 9.Синюю лакмусовую бумажку опускали в водный раствор хлорида натрия и хлорида алюминия. Как изменился их цвет? 10.Нарисуйте конфигурацию электронов вдоль орбит атомов скандия и галлия. Почему эти элементы расположены в группе II, но в разных подгруппах? 11.Опишите физико-химические свойства бора и таллия. Как объяснить разницу между ними?
12. Al, Al203, A1 (OH)3, AI2 (S04) 3(I, стр. 43) напишите резюме ответов, характеризующих свойства вещества, в котором приведена химическая формула. 13.Составьте уравнение реакции по схеме 43. #I. какое количество алюминия необходимо получить в ходе реакции с соляной кислотой в количестве, равном количеству водорода, которое выделяется при взаимодействии 1 моля натрия с водой?
2.Сплав алюминия и меди подвергался воздействию чрезмерно холодного раствора концентрированной азотной кислоты. Людмила Фирмаль
Выделилось 2,24 литра газа(ни одного).Если общая масса составляет 10 г, рассчитайте долю сплава. 3. Дают 0,05 массовой доли Ил-5%, раствор, содержащий хлорид алюминия 40 г. сколько миллилитров необходимо раствора, содержащего 0,2 массовой доли или 20% гидроксида натрия (Р » 1,2 г / см3)для полного превращения хлорида алюминия в алюминат натрия?
Лабораторная работа Окисление расплавленной алюминиевой пластине. Используя нож или напильник, соскоблите поверхностный слой с алюминиевой проволоки или пластины, передайте его лаборанту и обработайте ртутными солями. Затем следуйте изменениям, сделанным с использованием плавленого алюминия. Алюминий скоро покроется слоем, похожим на рыхлое насекомое. Восстановление из оксида железа алюминием.
Поместите смесь оксида железа (III) и порошкообразного алюминия (1: 3) на керамическую плитку. Поместите 5-8 спичечных головок в середину кучи и зажгите их. Происходит реакция, при которой выделяется очень большое количество тепла. Образуется металлическое железо. Задача. I. Что происходит с расплавленным алюминием в воздухе?
2.It объясняет, почему алюминий может восстанавливать железо из его оксида. Напишите уравнение реакции и укажите переход электронов. Соотношение алюминия и концентрированной азотной кислоты. В пробирку наливают 0,5〜0,6 мл холодного раствора с массовой долей 50-60% или 1 мл. Положите несколько кусочков алюминия в азотную кислоту, и в нее.
Никаких изменений нет. Взаимодействие алюминия с соляной и серной кислотами. Налейте в 1 пробирку раствор соляной кислоты с массовой долей 0,2 или 20% хлористого водорода 1-2 мл, а в другую пробирку 1-2 мл серной кислоты той же концентрации. Положите немного алюминия в обе трубки.
Газ, выделяющийся при воспламенении, медленно сгорает в whi или в почти незаметном пламени. Взаимодействие алюминия и щелочи. I. В пробирку, положить несколько кусочков алюминия и добавляют 0,1 масса, или 10 мл раствора, содержащего 5% гидроксида натрия. Закройте трубку вентиляционной пробкой. Слегка нагрейте содержимое трубки. Пузыри заметны. 2.Открытым концом вниз закрепите пустую пробирку в стойке, соберите полученный газ и поставьте ее на огонь.
Газ медленно горит в whi, или в почти незаметном пламени. Задача. Почему алюминий вступает в реакцию с кислотами и щелочами? Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов. Получение гидроксида алюминия. I. В пробирку наливают раствор хлорида алюминия 5-6 мл и добавляют к нему раствор гидроксида натрия.
Образуется светло-серый осадок. 2.Полученный осадок отделяют фильтрованием и промывают. Разделите его на 2 части и оставьте до следующего эксперимента. Взаимодействие гидроксида алюминия с кислотой. Налейте небольшое количество соляной кислоты в 1 пробирку и положите полученный осадок гидроксида алюминия. Осадок растворяется.
Взаимодействие гидроксида алюминия и щелочи. Налейте небольшое количество раствора гидроксида натрия, в другую пробирку, содержащую осадок гидроксида алюминия. Осадок растворяется. Назначение. 1. Какие вещества образуются при взаимодействии соли алюминия и щелочи? 2.Вещества, образующиеся при выпадении осадка: а) соляная кислота. б)раствор гидроксида натрия? 3.Какие вещества вступают в реакцию с кислотами и щелочами?
Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов. Испытайте раствор солей алюминия с помощью индикатора. Замочите синюю лакмусовую бумагу в растворе хлоридных и сульфатных солей алюминия. Индикаторная бумага становится красной. Задача. Почему Синяя лакмусовая бумажка становится красной? Это явление объясняется в уравнении реакции.
Смотрите также:

