Оглавление:
Комплексные соединения
Задача 72.
Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в каждом из соединениях
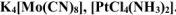
Написать уравнения диссоциации этих соединений в водных растворах.

Решение:
Диссоциация комплексных соединений протекает с отщеплением ионов внешней сферы по типу диссоциации сильных электролитов:
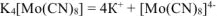
Заряд комплексного иона 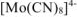 равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку.
равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку.
Вторичная диссоциация комплексного иона обратима и протекает по типу диссоциации слабого электролита:
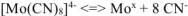
Степень окисления комплексообразователя (х) определяется по заряду комплексного иона:
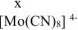
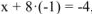 , откуда
, откуда 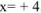 , т.е. заряд комплексообразователя
, т.е. заряд комплексообразователя 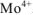 .
.
Координационное число комплексообразователя (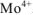 ) равно суммарному числу лигандов
) равно суммарному числу лигандов 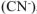 , окружающих комплексообразова-тель, т.е. кч
, окружающих комплексообразова-тель, т.е. кч 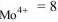 .
.
Так как соединение 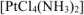 не содержит внешней сферы, то его заряд равен нулю (неэлектролит) и для него наблюдается только вторичная диссоциация:
не содержит внешней сферы, то его заряд равен нулю (неэлектролит) и для него наблюдается только вторичная диссоциация:
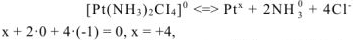
т.е. заряд комплексообразователя 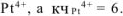
Ответ: 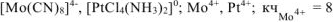 ;
;
Задача 73.
Константа нестойкости комплексных ионов 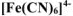 и
и 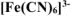 соответственно равны
соответственно равны 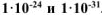 . Написать выражения констант нестойкости этих ионов и рассчитать константы их устойчивости. Какой из комплексных ионов является более прочным.
. Написать выражения констант нестойкости этих ионов и рассчитать константы их устойчивости. Какой из комплексных ионов является более прочным.

Решение:
Диссоциация комплексных ионов процесс обратимый и количественно описываются константами нестойкости.
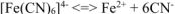
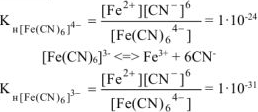
Константы устойчивости — константы равновесия обратных процессов (образования комплексных ионов).
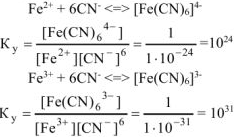
Значение константы устойчивости комплексного иона 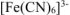 больше константы устойчивости комплексного иона
больше константы устойчивости комплексного иона 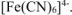 . Значит комплексный ион
. Значит комплексный ион 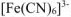 более прочный.
более прочный.
Ответ: Комплексный ион 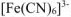 более прочный.
более прочный.
Задача 74.
Составить формулы следующих комплексных соединений с координационным числом платины (IV) равном шести 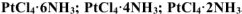 . Написать уравнения диссоциации этих солей в водном растворе и назвать их.
. Написать уравнения диссоциации этих солей в водном растворе и назвать их.

Решение:
В состав внутренней сферы включается шесть лигандов. В первую очередь — молекулы аммиака и затем до координационного числа шесть — ионы хлора. Остальные ионы хлора образуют внешнюю сферу.
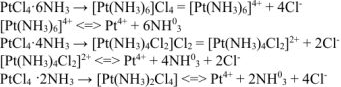
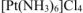 — хлорид гексаамминплатины (IV)
— хлорид гексаамминплатины (IV)
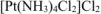 — хлорид дихлоротетраамминплатииы (IV)
— хлорид дихлоротетраамминплатииы (IV)
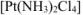 — тетрахлородиаммииплатина.
— тетрахлородиаммииплатина.
Задача 75.
Определить концентрацию ионов 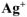 в 0,01М растворе
в 0,01М растворе 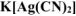 , содержащем кроме того 0,05 моль/л
, содержащем кроме того 0,05 моль/л 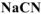 . Константа устойчивости комплексного иона
. Константа устойчивости комплексного иона 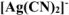 равна
равна 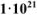 .
.

Решение:
Равновесную концентрацию ионов 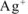 можно определить из выражения константы устойчивости комплексного иона:
можно определить из выражения константы устойчивости комплексного иона:
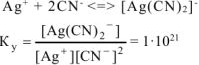
Введение в раствор комплексной соли сильного электролита  , который диссоциирует по уравнению:
, который диссоциирует по уравнению:
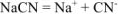
приводит, согласно принципа Ле-Шателье, к смещению равновесия (13.1) в сторону образования комплексного иона и устанавливается новое равновесие. Значение 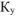 при этом не изменяется.
при этом не изменяется.
Обозначим равновесную концентрацию ионов серебра в новых условиях через х:
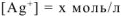
Общая равновесная концентрация 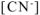 равна сумме концентраций
равна сумме концентраций 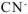 , образовавшихся при диссоциации
, образовавшихся при диссоциации 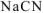 и
и 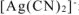 :
:
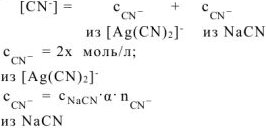
так как 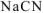 сильный электролит,
сильный электролит, 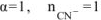 , то
, то 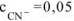 моль/л. Тогда:
моль/л. Тогда:
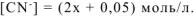
Концентрацию иона 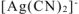 определяем из уравнения первичной диссоциации:
определяем из уравнения первичной диссоциации:
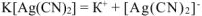
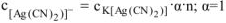 так как первичная диссоциация протекает по типу диссоциации сильных электролитов,
так как первичная диссоциация протекает по типу диссоциации сильных электролитов,
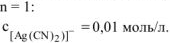
Тогда равновесная концентрация иона 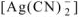 равна:
равна:
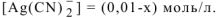
Подставляем полученные данные в выражение (13.2)
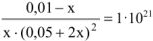
Так как 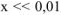 , то значением х ввиду его малости в выражении
, то значением х ввиду его малости в выражении 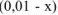 и значением
и значением 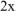 в выражении
в выражении 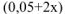 можно пренебречь и данное выражение записать в виде:
можно пренебречь и данное выражение записать в виде:
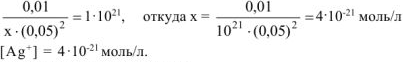
Ответ: 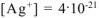 моль/л.
моль/л.
Задача 76.
Выпадает ли осадок 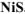 , если к 1М раствору
, если к 1М раствору 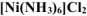 прилить равный объем 0,005М раствора
прилить равный объем 0,005М раствора 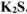 .
.
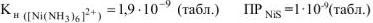

Решение:
Осадок 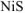 образуется, если
образуется, если
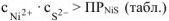
Концентрацию иона 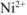 определяем по концентрации раствора
определяем по концентрации раствора 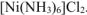 .
.
Комплексная соль 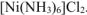 диссоциирует по уравнению:
диссоциирует по уравнению:
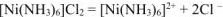 (первичная диссоциация) (13.5) Из уравнения (13.5) определяем концентрацию комплексного иона:
(первичная диссоциация) (13.5) Из уравнения (13.5) определяем концентрацию комплексного иона:
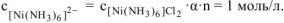
где 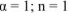
Комплексный ион в свою очередь диссоциирует равновесно: 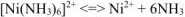 (вторичная диссоциация) (13.6) Обозначим равновесную концентрацию ионов никеля через х:
(вторичная диссоциация) (13.6) Обозначим равновесную концентрацию ионов никеля через х: 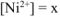 моль/л.
моль/л.
Тогда, согласно уравнения (13.6):
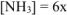 моль/л;
моль/л;
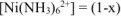 моль/л. Константа нестойкости комплексного иона из уравнения (13.6) равна:
моль/л. Константа нестойкости комплексного иона из уравнения (13.6) равна:
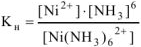
Подставим полученные данные в выражение (13.7):
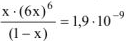
Так как 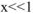 , то значением х ввиду его малости в выражении (1-х) можно пренебречь и данное выражение записать в виде:
, то значением х ввиду его малости в выражении (1-х) можно пренебречь и данное выражение записать в виде:
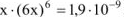 , откуда
, откуда 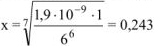 моль/л.
моль/л.
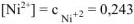 моль/л.
моль/л.
Из уравнения диссоциации:
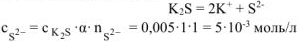
где 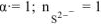 .
.
При сливании равных объемов растворов солей 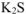 и
и 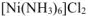 концентрация всех ионов уменьшается в 2 раза и составит:
концентрация всех ионов уменьшается в 2 раза и составит:
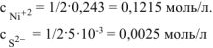
Произведение 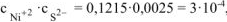 , т.к.
, т.к.
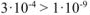 (табл, величина
(табл, величина 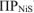 ) то осадок
) то осадок 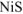 выпадает. Ответ: осадок
выпадает. Ответ: осадок 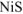 выпадает.
выпадает.
Задача 77.
К раствору, содержащему 0,2675 г комплексной соли 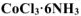 добавили в избытке раствор
добавили в избытке раствор 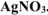 . Масса осажденного
. Масса осажденного 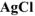 составила 0,4305 г. Определить координационную формулу соли, назвать её и написать уравнения диссоциации в водном растворе.
составила 0,4305 г. Определить координационную формулу соли, назвать её и написать уравнения диссоциации в водном растворе.


Решение:
Для написания координационных формул необходимо знать состав внутренней и внешней сферы этой соли.
Из раствора комплексной соли можно осадить в виде 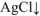 , только ионы
, только ионы 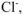 , входящие во внешнюю сферу.
, входящие во внешнюю сферу.
Таким образом, в состав осадка 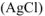 входят
входят 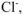 находящиеся только во внешней сфере комплексной соли.
находящиеся только во внешней сфере комплексной соли.
Обозначим число ионов 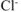 во внешней сфере комплексной соли — n.
во внешней сфере комплексной соли — n.
Тогда число ионов 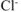 во внутренней сфере комплексной соли —
во внутренней сфере комплексной соли — 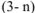
При добавлении к раствору комплексной соли раствора 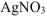 протекает реакция:
протекает реакция:
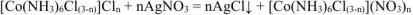
Поскольку в молекуле 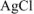 на 1 ион
на 1 ион 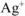 приходится 1 ион
приходится 1 ион 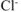 , то из одной молекулы комплексной соли образуется n молекул
, то из одной молекулы комплексной соли образуется n молекул 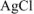 .
.
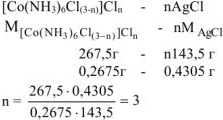
Следовательно все три иона 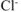 находятся во внешней сфере. Формула комплексной соли
находятся во внешней сфере. Формула комплексной соли 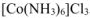 .
.
Первичная диссоциация соли:
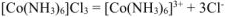
Вторичная диссоциация:
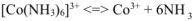
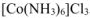 — хлорид гексаамминкобальта (III)
— хлорид гексаамминкобальта (III)
Ответ: 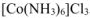 .
.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Электролиз растворов задачи с решением |
| Получение и химические свойства металлов задачи с решением |
| Жесткость воды задачи с решением |
| Высокомолекулярные соединения задачи с решением |

