Оглавление:
Теория строения комплексных соединений была предложена в 1893 году Вернером и получила название координационной теории.
Многие положительно заряженные ионы обладают способностью присоединять к себе ионы противоположного знака или полярные молекулы (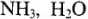 и др.), образуя так называемые комплексные ионы.
и др.), образуя так называемые комплексные ионы.
Соединения, в состав которых входят комплексные ионы, называются комплексными, или координационными соединениями.
В настоящее время комплексных соединений известно больше, чем простых. Отсутствие четкой границы между простыми и комплексными соединениями затрудняет определение понятия «комплексные соединения». Поэтому существуют различные подходы к рассмотрению этого понятия. В одних определениях учитывается характер химической связи, а в других — наличие координации в твердом состоянии.
Итак, комплексными соединениями называются вещества, содержащие центральный атом — комплексообразователь, с которым в тесной связи находится определенное количество атомов или молекул, составляющих внутреннюю сферу.
Комплексный ион. Простые соединения первого ряда, соединяясь друг с другом, образуют комплексные соединения:
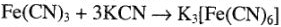
а при диссоциации — положительно и отрицательно заряженные комплексные ионы:
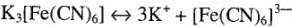
Комплексные ионы заключены в квадратные скобки. Эти ионы составляют внутреннюю сферу комплексных соединений. Комплексный ион состоит из центрального атома в определенном валентном состоянии, вокруг которого скоординировано определенное число частиц — атомов ионов или молекул. Центральный атом комплексного иона называется комплексообразователем, а частицы, координирующиеся вокруг комплексообразователя — лигандами. Комплексообразование -свойство, присущее всем элементам. Однако для одних оно характерно, для других — выражено меньше.
Типичными комплексообразователями, являются d-элементы больших периодов периодической системы Д.И.Менделеева: 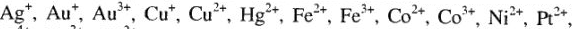
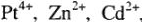 т.е. те ионы, которые имеют незавершенную электронную оболочку и обладают сильным электрическим полем.
т.е. те ионы, которые имеют незавершенную электронную оболочку и обладают сильным электрическим полем.
Лигандами могут быть:
а) нейтральные молекулы (полярные): 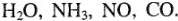 Молекулы-диполи тем легче становятся лигандами, чем меньше их размер и чем легче они поляризуются.
Молекулы-диполи тем легче становятся лигандами, чем меньше их размер и чем легче они поляризуются.
б) ионы: 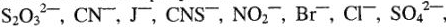 ,
,  .
.
Комплексообразующие вещества (лиганды) должны удовлетворять следующим требованиям:
- образовывать с ионами металла достаточно устойчивые комплексные соединения;
- обладать поверхностно-активными свойствами и большей поверхностной энергией;
- не должны оказывать вредного влияния при комплексообразовании.
Этим требованиям хорошо удовлетворяют алифатические амины.
Заряд комплексного иона определяется как алгебраическая сумма зарядов комплексообразователя и лигандов.
Так, соединение 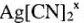 имеет заряд
имеет заряд 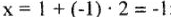 ; а
; а 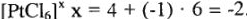 . Зная заряд комплексного иона и заряд лигандов, легко вычислить заряд комплексообразователя. Например:
. Зная заряд комплексного иона и заряд лигандов, легко вычислить заряд комплексообразователя. Например: 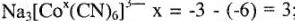 ; если
; если 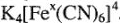 , то
, то 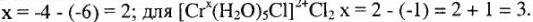
Примечание. Нейтральные атомы не имеют заряда, поэтому при подсчете зарядов их не учитывают.
Координационное число. Каждый комплексообразователь может присоединять лишь определенное число лигандов. Число координационных мест, которое занимают лиганды, называют его координационной емкостью. Число, показывающее, сколько лигандов координируется вокруг данного комплексообразователя, называется его координационным числом (к.ч.). Значение к.ч. определяется размерами, зарядом, строением электронной оболочки как комплексообразователя, так и лиганда. Хотя к.ч. для того или иного комплексообразователя — величина постоянная, тем не менее она зависит от ряда факторов: природы комплексообразователя и лигандов, их объемов и зарядов, температуры и концентрации.

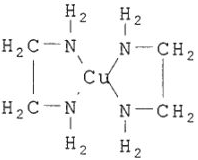
Некоторые молекулы имеют в своем составе два атома, способных соединятся с ионом металла-комплексообразователя. Такие молекулы (лиганды) называются бидентантными, они могут образовывать клешневидные и хелатные комплексы. Например, этилендиамин и др. имеют два координационных места и образуют хелатный комплекс с медью:
В растворах комплексные соединения диссоциируют на комплексный ион и противоположно заряженные ионы внешней сферы:
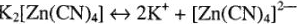
В водных растворах диссоциация протекает практически полностью. Однако кроме первой реакции диссоциации всегда происходит, хотя и в гораздо меньшей степени, распад комплексного иона:
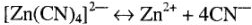
При этом степень диссоциации зависит от прочности внутренней сферы комплексного соединения. Для характеристики прочности комплекса введено понятие константы нестойкости (Киес1), которая представляет собой константу равновесия диссоциации комплексного иона:
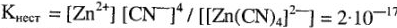
Чем меньше константа нестойкости, тем прочнее данный комплексный ион.
Следует отметить, что диссоциация комплекса всегда протекает ступенчато, т.е. отщепляется один лиганд за другим. Каждому процессу соответствует своя константа нестойкости.
Усилить диссоциацию или даже полностью разрушить комплексный ион можно:
а) разбавлением или нагреванием раствора;
б) добавлением реагентов, дающих с одним из компонентов комплексного иона малорастворимые или еще менее диссоциируемые молекулы или ионы;
Константа нестойкости имеет большое практическое значение. Она позволяет определить:
1) возможность растворения различных осадков за счет образования комплексных соединений;
2) устойчивость комплексных соединений по отношению к тому или иному реактиву, а следовательно, возможность распада комплекса на простые соединения или образования из него нового, более устойчивого комплекса.
Строение комплексных соединений
Существует ряд теорий, объясняющих строение комплексных соединений:
1. Теория кристаллического поля. Эта теория аналогична теории ионной связи в атомных соединениях, утверждает электростатический подход к строению комплексных ионов. Согласно этой теории образование комплекса есть итог электростатического взаимодействия между комплексообразователем и лигандами, а комплексообразователь и лиганды — твердые несжимаемые заряженные шарики определенных размеров.
Теория кристаллического поля рассматривает структуру (s, р, d, f) электронов комплексообразователя и те изменения, которые они претерпевают в поле лигандов как точечные заряды. Однако теория кристаллического поля не объясняет свойств комплексов и не учитывает электронную структуру лигандов.
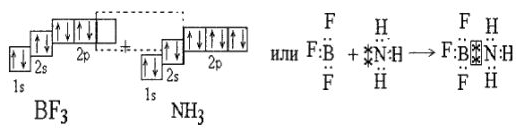
2. Теория донорно-акцепторной связи. Эта связь рассматривается как частный случай ковалентной связи. Теория рассматривает и волновые функции s, р, d, f -электронов. Как видим, из названия теории вытекает сущность процессов между акцептором и донором. Так, комплексообразователь, обладая свободными квантовыми ячейками, может быть акцептором электронов. Лиганды, имеющие неподеленные пары электронов, являются донорами электронов. К примеру, взаимодействие  и
и 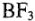 следует объяснять наличием у бора свободной 2р-ячейки, а у азота — неподеленной пары 2s-электронов. В этом соединении азот является донором, а бор — акцептором. Например:
следует объяснять наличием у бора свободной 2р-ячейки, а у азота — неподеленной пары 2s-электронов. В этом соединении азот является донором, а бор — акцептором. Например:
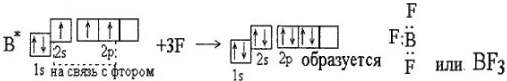
Но у азота есть неподеленная пара в 25-состоянии. В то же время у бора есть свободная ячейка. Указанное условие приводит к возникновению комплексного соединения по схеме:
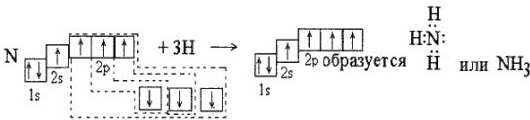
Таким образом, образование комплексных соединений по типу донорно-акцепторной связи можно рассматривать как разновидность ковалентной связи. Здесь образование комплексного соединения не связано с возникновением новых электронных пар.
3. Теория молекулярных орбиталей. Согласно этой теории комплексы представляют собой единое целое, отдельные атомы и молекулы которого теряют и индивидуальные качества. Теория основана на квантово-механических представлениях. Эта теория учитывает как влияние электронов комплексообразовате-ля на электронную структуру лигандов, так и влияние электронной структуры лигандов на электронную структуру комплексо-образователя. Сведения о свойствах комплекса устанавливают путем расщепления термов в сильном и слабом полях лигандов и находят данные на основе квантово-механических расчетов.
Для примера рассмотрим распределение электронов по молекулярным орбиталям (МО) низкоспинового комплекса  Из 18 валентных электронов Со (III) и лигандов 12 электронов находятся на 6 связывающих
Из 18 валентных электронов Со (III) и лигандов 12 электронов находятся на 6 связывающих  (рис. 6).
(рис. 6).
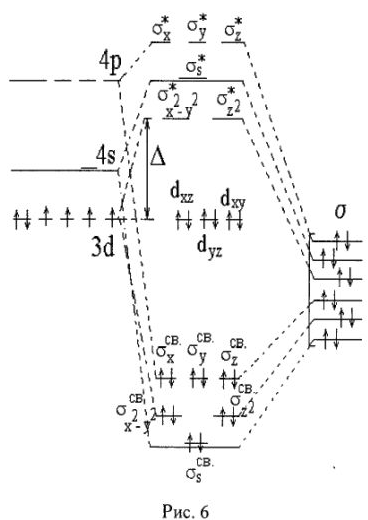
Это соответствует 6 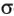 -связям комплексообразователь-лиганд. Остальные 6 электронов в ионе
-связям комплексообразователь-лиганд. Остальные 6 электронов в ионе 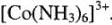 распределены только на несвязывающих
распределены только на несвязывающих 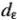 -орбиталях.
-орбиталях.
Различие в характере распределения электронов среди 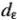 — и
— и 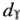 -орбиталей (АО) зависит от параметра расщепления (
-орбиталей (АО) зависит от параметра расщепления (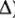 ). При этом замечено, что чем больше степень перекрывания исходных атомных орбиталей (АО), тем больше энергетическое различие между связывающей и разрыхляющей орбиталями. Поэтому чем сильнее перекрывание
). При этом замечено, что чем больше степень перекрывания исходных атомных орбиталей (АО), тем больше энергетическое различие между связывающей и разрыхляющей орбиталями. Поэтому чем сильнее перекрывание 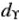 -комплексообразователя с орбиталями лигандов, тем выше уровень
-комплексообразователя с орбиталями лигандов, тем выше уровень 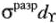 МО и тем больше параметр расщепления (
МО и тем больше параметр расщепления (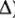 ).
).
Чтобы иметь четкое представление о методе молекулярных орбиталей, рассмотрим образование простой молекулы водорода 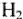 . Молекула
. Молекула 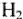 комбинируется из двух одноатомных орбиталей (АО). При этом получаются две МО: связывающая
комбинируется из двух одноатомных орбиталей (АО). При этом получаются две МО: связывающая 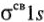 и разрыхляющая
и разрыхляющая 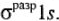 . Связывающие МО
. Связывающие МО 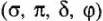 и разрыхляющие
и разрыхляющие 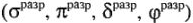 соответствуют атомным (s, р, d, f) орбиталям.
соответствуют атомным (s, р, d, f) орбиталям.
Реакция образования молекулы 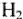 из АО в системе МО имеет вид
из АО в системе МО имеет вид 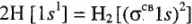 .
.
В случае попадания электрона на разрыхляющую МО электронная плотность будет концентрироваться за ядрами, а между ними она равна нулю, т. е. образование молекулы не происходит (рис. 6).
Шесть электронов в молекуле 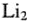 располагаются на трех орбиталях, электронная конфигурация имеет вид:
располагаются на трех орбиталях, электронная конфигурация имеет вид:
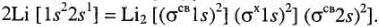
Реакция образования молекулы 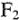 в системе обозначения МО может быть записана так:
в системе обозначения МО может быть записана так:
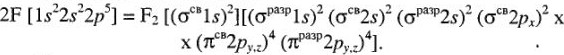
Для атома азота:
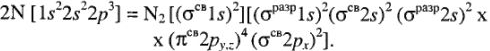
Для молекулы CO:
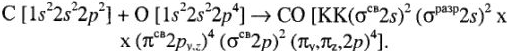
Кратность связи = (число электронов на  ) — (число электронов на
) — (число электронов на 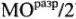 )
)
Для 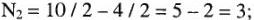
Для 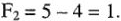
Классификация комплексных соединений
Комплексный ион может иметь различный заряд. В зависимости от того, какой электрический заряд несет комплексный ион, различают катионные, анионные и нейтральные комплексы:
1. Катионные комплексы:
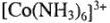 — гексааминкобапьта (3+);
— гексааминкобапьта (3+);
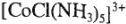 — пентааминхлорокобальта (3+);
— пентааминхлорокобальта (3+);
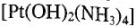 — тетрааминдигидроксиплатины (4+).
— тетрааминдигидроксиплатины (4+).
2. Анионные комплексы:
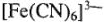 — гексацианоферриат (3+);
— гексацианоферриат (3+);
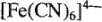 — гексацианоферроат (2+);
— гексацианоферроат (2+);
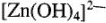 — тетрагидроксоцинкоат (2+).
— тетрагидроксоцинкоат (2+).
3. Нейтральные комплексы:
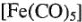
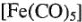 — пентакарбонилжелезо;
— пентакарбонилжелезо;
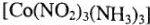 — триамминтринитрокобальт;
— триамминтринитрокобальт;
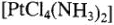 — диамминтетрахлороплатина.
— диамминтетрахлороплатина.
Изомерия комплексных соединений
Среди комплексных соединений есть такие, которые имеют одинаковый количественный и качественный состав, но различаются строением, физическими и химическими свойствами. Это изомеры.
1. Гидратная изомерия. В этом случае наблюдается различное распределение молекул воды. Например, комплексное соединение 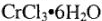 существует в виде трех изомеров:
существует в виде трех изомеров:
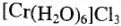 — (фиолетовый)
— (фиолетовый)
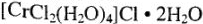 — (темно-зеленый)
— (темно-зеленый)
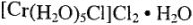
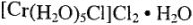 — (серо-зеленый)
— (серо-зеленый)
2. Ионизационная изомерия проявляется при различном расположении лигандов во внутренней и внешней сферах:
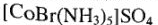 — (красно-фиолетовый)
— (красно-фиолетовый)
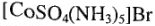 — (красный)
— (красный)
3. Координационная изомерия. Цис- и трансизомерия обусловлена пространственным расположением лигандов неоднородного комплекса. Например, у комплекса 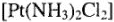 имеются два изомера:
имеются два изомера:
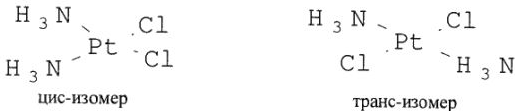
Цис- и транс-изомеры имеют различную реакционную способность. Реакционоспособность обусловлена также эффектом Яна-Теллера.
В комплексных соединениях взаимодействие с реагирующими частицами происходит по механизму 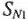 (механизм смещения и диссоциации) или по механизму
(механизм смещения и диссоциации) или по механизму 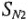 (механизм биомо-лекулярного смещения).
(механизм биомо-лекулярного смещения).
В первом случае координационное число на единицу меньше, во втором — на единицу больше. Эти особенности важны при реакциях, протекающих с участием комплексных ионов.
Значение комплексных соединений
Комплексные соединения имеют широкое применение в аналитической химии для качественного открытия элементов и количественного их определения (например, для открытия ионов меди используется этаноламин; для открытия ионов никеля — циклоглиоксим никеля).
Комплексные соединения используются для получения гальванических покрытий. Например, для получения мелкокристаллических осадков меди применяются этилендиаминовые и этаноламиновые электролиты, содержащие комплексные ионы 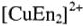 и
и 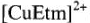 соответственно.
соответственно.
Широкое применение получили комплексные соединения в защите металлов от коррозии (гексобензоат железа, этаноламин, уротропин с иодистым калием).
Накопление и перемещение различных веществ и энергии, обмен и блокирование функциональных групп, участие в окислительно-восстановительных реакциях, образование и расщепление химических связей — вот неполный список разнообразных функций комплексных соединений, которые они выполняют в организме животных и растений. Гемоглобин, выполняющий важнейшую роль в живых организмах, тоже является комплексным соединением. Это и хлорофилл, придающий зеленую окраску растениям.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Коррозия металлов в химии |
| Защита металлов от коррозии в химии |
| Химия элементов |
| Полимеры: органические соединения |

