Оглавление:


















Кислородные соединения азота
- Кислородные соединения азота. Оксиды известны по АЗОТу, и их состав формально соответствует всем валентностям от 1 до 5.Сравните их выражения и имена со следующими. Н, 0 не Nj03 с помощью параметра n02 Н ОЖ Закись азота, Закись азота. Азот-азот безводный азодиазид Безводная азотная кислота является твердым веществом, а оставшийся оксид-газом в нормальных условиях.
- Закись азота получают разложением аммиачной селитры и протекает приблизительно 250 сс по формуле. NH4NOj = 211,0 + + 9 ккал Структура молекулы N20 соответствует формуле N = N = 0.Закись азота-это бесцветный газ со слабым приятным ароматом и сладким ароматом. taste. При температуре более 500°C закись азота разлагается по реакции 2N20 = 2NS + 02 + 39 ккал
It растворяется в воде, но не вступает в химическое взаимодействие. Людмила Фирмаль
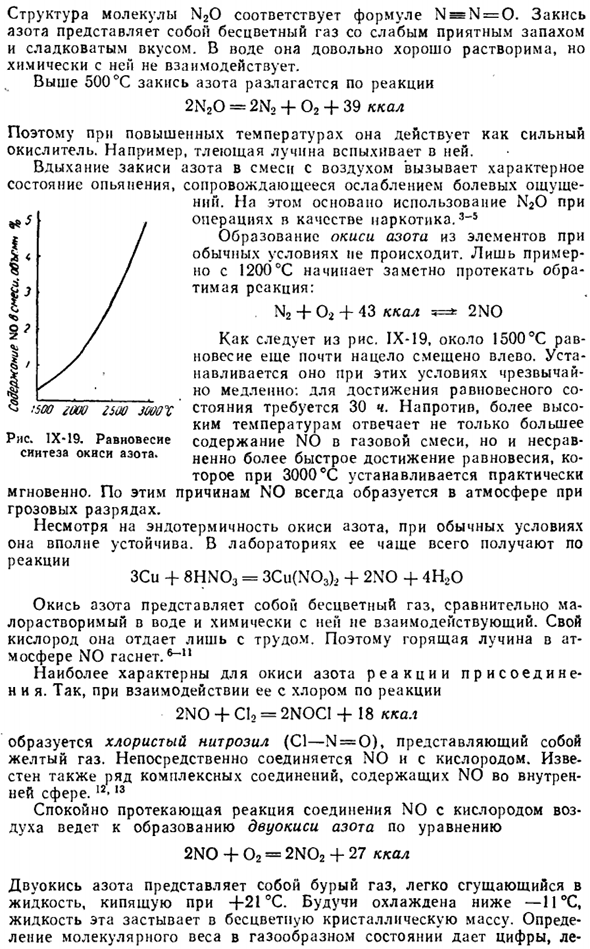
Поэтому при высоких температурах он действует как сильный окислитель. Например, вспыхнет тлеющий факел. Вдыхание закиси азота, смешанной с воздухом, вызывает характерное состояние интоксикации с ослаблением болевого синдрома. Это является основой для работы N20 в качестве фармацевтического продукта. В нормальных условиях образование оксида азота из элементов не происходит. Обратимая реакция / обратимая реакция начинает заметно проявляться только при температуре около 1200°С. N2 + 02 + 43 ккал 5=»: 2NO
Как следует из рисунка IX-19, около 1500°С равновесие все еще почти полностью смещено влево. В этих условиях будет очень сложно, но медленно: достичь равновесия * 30 часов JOOOX требует стоячего положения 500 часов, но наоборот, чем выше температура, тем выше температура не только высокая. IX-19.Равновесное содержание no в смешанном газе, но не синтезируется оксид азота. Столь же быстрое равновесие устанавливается почти мгновенно при 3000°C по этим причинам во время разрядов молнии в атмосфере всегда образуется NO.
Несмотря на эндотермическую природу оксида азота, в нормальных условиях он очень stable. In в лаборатории чаще всего его получают реакцией 3Cu + 8HNO3 = 3Cu (N03) 2 + 2NO + 4H> 0 Оксид азота-это бесцветный газ, который относительно нерастворим в воде и не взаимодействует химически. Она откажется от кислорода.
Поэтому факел, горящий в атмосфере NO, исчезнет. Реакция присоединения является наиболее характерной для азотной кислоты oxide. So, когда он взаимодействует с хлором по реакции 2NO-f Clo = 2NOCI + 18 ккал Образуется нитрозилхлорид (01-N = 0).Это желтый газ. Он связывает кислород непосредственно с NO. Многие комплексные соединения с no во Внутренней Сфере также известны 12> 13 Благодаря плавно прогрессирующей реакции соединения NO с кислородом воздуха образуется диоксид азота по формуле.
2NO + 02 = 2N02 + 27 ккал Диоксид азота представляет собой коричневый газ и легко конденсируется в жидкость, которая кипит при температуре+ 21 ° C. При охлаждении ниже −11°C эта жидкость затвердевает в бесцветную кристаллическую массу. Определение молекулярной массы в газообразном состоянии дает цифру Между простым значением (14 + 2-16 = 46) и 2-кратным значением(92) эти числа изменяются в зависимости от температуры эксперимента, уменьшаясь с увеличением, увеличиваясь с уменьшением.
Такие результаты обусловлены балансом молекул диоксида азота (N02) и оксида азота (N20<).Измерив молекулярную массу около 140°С, можно увидеть, что в этих условиях в Газе присутствуют только молекулы диоксида азота, а при низких температурах они образуют частично спаренные молекулы N2O4.Процесс, который образуется из нейтральных молекул того же вещества с более сложной частицей, молекулярная масса которой в 2 раза, в 3 раза и т. д., называется полимеризацией, поэтому при температуре менее 140°С NO2 t s i (точнее, это димер) N20;.
Это связано с тем, что чем ниже температура, тем больше и ближе к точке замерзания (-11°С) вещество состоит только из молекул N20.Напротив, при нагревании оксид азота диссоциирует молекулу. Каждая промежуточная температура от −11°С до+ 140°С соответствует определенному равновесному состоянию обратимой реакции. Размеры>— N20 <+ 14 ккал Лол% 80% 60 § «Я 70. ZU 60> U0 толстовка Диаграмма IX-20.Равновесие системы составляет M, 04-2ной. Простой МО- nо2 + с n02 Диссоциация Расположение этого равновесия при различных температурах показано на рисунке. IX-20.
Оксид азота бесцветен, а диоксид азота имеет красновато-коричневый цвет, поэтому при нагревании он меняет свое равновесное состояние Или охлаждение смешанного газа можно легко проследить, изменив его цвет. Склонность молекулы 0 = N = 0 к взаимодействию обусловлена наличием в молекуле 1 неспаренного электрона (содержащего атом азота).Такая комбинация из 2 электронов создает связь ty-N в молекуле n2o4.Нестабильность последнего является результатом уязвимости этой связи. Пространственная структура молекул NO2 и N2O.
Показано на фиг. IX-21.Диоксид азота является очень сильным окислителем. Уголь, сера, фосфор и другие легко burn. It образуется взрывоопасная смесь многих органических веществ с парами. Склонность к дополнительным реакциям, выраженная в диоксиде азота, значительно слабее, чем в оксидах. 14-20 Обратимая реакция N02 + NO n203 + 10 ккал взаимодействие NO2 и N0 Это приводит к частичному образованию безводной азотистой кислоты (N203), а при охлаждении она получается в виде синей liquid.
In нормальное состояние, оно неустойчиво, и равновесие сильно смещается влево. Рисунок IX-2I. пространственная структура молекулы N0?И N, 04. Растворение в форме N02 (или N3O4) сопровождается образованием азотной кислоты (HN03) и азотистой кислоты (HN02). N, 04 + H, 0 = 11X0, 4-HNQj Азотная кислота в растворе стабильна, но азотистая кислота разлагается с обратимой реакцией: 2Н.\ 20 + onн,, 0 4-нет.. + Ч0 Таким образом, взаимодействие NO2 с водой фактически протекает по следующему уравнению: 3N02 + H, 0 = 2HN03 4-N0 Если растворение диоксида азота осуществляется в присутствии избыточного кислорода (воздуха), то выделившийся N0 окисляется им до N02.
В этих условиях диоксид азота может быть полностью превращен в азотную кислоту по общей схеме 4N02 4-2H20 4-02 = 4HN03 Аналогичным образом (образование солей HN03) NO2 растворяется в щелочи в присутствии избытка кислорода. Наоборот, например, если нет реакции из-за последнего、 2N02 4-2NaOH = NaN03 4-NaN02 4-H20 Образуется смесь солей азотной и азотистой кислот(в отличие от самого I / m02, его соли стабильны). Соль азотистой кислоты называется азотистой кислотой. Как и сами анионы N07, большинство из них бесцветны.
Почти все нитриты очень хорошо растворимы в воде (хуже других-AgN02).На самом деле наиболее распространенным является NaN02, который обычно берется по схеме С n02 4-ч0 4-2NaOH = 2NaN02 4-Н20 Эта соль используется в производстве органических красителей 24 Сама азотистая кислота известна только в разбавленном водном растворе solutions. By сила, она только немножко более высока чем укусная кислота. Наиболее характерны наиболее выраженные окислительные свойства, и в большинстве случаев они восстанавливаются до N0.
Азотистая кислота, с другой стороны, окисляется до азотной кислоты под действием сильного окислителя. Ниже приведены типичные примеры окислительно-восстановительных процессов, характерных для HN02. 2HN0 ″ 4—2HI =Г> 4-2N04—2Н20 2NMP04 4-5HN02 = 2Mn(N03b 4-HNO3 4-3H20 Обе эти реакции протекают в кислой среде. Азотная кислота, основной продукт взаимодействия N02 с водой, является 1 из наиболее важных compounds.
It потребляется в производстве удобрений, органических красителей, пластмасс, взрывчатых веществ и многих других отраслях промышленности. Мировое годовое производство азотной кислоты составляет несколько миллионов тонн. Получение азотной кислоты в настоящее время осуществляется путем каталитического окисления аммиака.
Как было обнаружено в 1900 году, смесь NH3 и избыточного воздуха пропускали с высокой скоростью на платиновый катализатор, нагретый реакцией до 800 ° C.、 4NH3 4-50, — 6H., 0 4-4N0 + 216 ккал Образуется оксид азота, после чего он преобразуется в N02 и HN03 в соответствии с вышеуказанной реакцией. Безводная азотная кислота представляет собой бесцветную (быстро желтеющую при хранении) жидкость, которая кипит при 84°С.
кипение с частичным разложением по реакции 4HN03 + 6I ккал = 2H20 + 4N02 + 02 Диоксид азота, растворенный в дистиллированных кислотах, приобретает желтый или красный (в зависимости от количества М02) цвет. Поскольку N02 постепенно выделяется из раствора, такая азотная кислота называется дымящейся. Разложение 100% non-HNO3 будет светом медленно даже на нормальной температуре 45-43 HNO3 смешивается с водой в каждой пропорции.
Реактивная азотная кислота, используемая в лаборатории, содержит около 65%HN03, плотность составляет 1,40 г / cm3.In синтез, он соответствует почти формуле HN03•2Н20. 49-51. На химической стороне, сильная азотноводородная кислота главным образом охарактеризована сильный и произнесенный окислять properties. In в этом случае основным конечным продуктом восстановления не очень сильного HNO3 является NO и концентрированный-N02.
За исключением Au и Pt, все металлы, которые часто встречаются на практике, превращаются в оксиды сильной азотной кислотой. Если последний растворим в HNO3, то образуются нитраты. Согласно этой схеме, азотная кислота также растворяет металлы, такие как Cu, Hg и Ag. Cu, Hg, Ag расположены в серии напряжений на правой стороне водорода.
Некоторые металлы, которые бурно реагируют с разбавленной азотной кислотой, практически не взаимодействуют с концентрацией (особенно дым).Это связано с тем, что на его поверхности образуется очень тонкий, но плотный слой оксида, который нерастворим в концентрированных кислотах, что препятствует дальнейшему растворению металла. Эта «пассивность» особенно важна в случае Fe, поскольку она позволяет транспортировать обогащенный HN03 в Железном резервуаре.
Сильная (особенно дымящая) азотная кислота действует очень энергично на некоторые металлоиды. Так, сера окисляется при кипячении до H2SO4, уголь-до CO2 и др. и животные и растительные ткани разрушаются под действием HN03. Отношение между азотной кислотой и закисной кислотой важно. Закись азота быстро окисляет йодистый водород до свободного йода, но разбавленная азотная кислота не действует на HI.
И наоборот, концентрированный HN03 окисляет не только HI, но и HC1.Однако, в последнем случае, реакция обратима. HNO3 + 3HCI * = * 2H20 + NOCI-f C12 Смесь концентрированного HNO3 и концентрированного HCl обычно называют «царской водкой», она действует гораздо более энергично, чем каждая из этих кислот. Таким образом, даже Au и Pt легко растворяются в царской водке за счет образования соответствующих хлоридных соединений по схеме. Au +HN03+ 3HCI =AuC13+ N0 +2н20tt + 4hn03 + 12НС1 = 3PTCI4 + 4no-1-8Н20 Действующим веществом в царской водке является хлор на момент разделения 54 14 Б. В. Некрасов
Так же, как оксидация, кисловочная функция также очень видна в ХНО3.Реакция многих металлов с разбавленным HNO3 протекает обычным образом, то есть с замещением водорода, потому что при последующем разбавлении раствора первый быстро слабеет, а второй становится сильнее. Однако последний обычно не высвобождается и расходуется на возврат избытка HN03 в производное с низким содержанием азота до NH3.
As как правило, получается смесь различных коллекционных продуктов. Пятьдесят семь Как очень сильная одноосновная кислота, Н \0303 образует очень стабильную соль. N07, как и сам Ион, большинство нитратов бесцветны. Почти все нитраты очень хорошо растворимы в воде. Многие из них находят разнообразное практическое применение. 58-65 Когда нитрат нагревается достаточно, он разлагается, и характер разложения зависит от природы катиона.
Соли наиболее активных металлов (расположенных в ряду напряжений слева от мг) передает в соответствующие нитриты с удалением кислорода, при котором менее активных солей (мг — КР) разлагается и образует оксид, а кроме того, менее активными (на правой стороне КР) образуется свободный металл. Примером является реакция \ 2Na 03 = 2NaN02 + 2пб 02 (с бортовым номером 03) 2 = 2 Рю + 4N02 + 02 2AgN03 = 2а. г. + 2N02 + 02
Гетерогенный характер этих реакций обусловлен различной стабильностью соответствующих нитритов и оксидов при температуре разложения. В этих условиях нитрит также устойчив к Na. Pb, он уже нестабилен, но оксид все еще стабилен, и в случае Ag оба соединения нестабильны. Благодаря легкости переноса кислорода за счет нитратов при высоких температурах смесь их и горючих веществ сгорает очень быстро.
Это является основой для использования нитратов в пиротехнике и производстве черного пороха.6/70. То, что соответствует нитратному ангидриду, получается при взаимодействии NO2 с озоном. 2N02 + 03 = 02 + N205 4-60 ккал Безводная азотная кислота (N2O5) представляет собой бесцветный, очень летучий Кристалл. Последний образован ионами N0 ^и NOJ, в паре ангидрид состоит из отдельных молекул, структура которых соответствует формуле 02N-O-M02.
Бурно реагирует с окисляемыми веществами, образуя воду и азотную кислоту 7, −74 Добавь 1) при взаимодействии с горячими дросселями все оксиды азота разлагаются и образуется CuO NJ. Из-за количества оксида меди и количества выделяемого азота можно установить исходную формулу оксида. 2) все оксиды азота, кроме N3O («веселящего газа»), токсичны.
Опасность отравления ими усугубляется тем, что дыхательные пути при этом сравнительно слабо раздражаются, а также тяжелыми явлениями(боль в груди, сильная одышка и др.) обычно возникают только через несколько часов после вдыхания газа. Воздух Содержащ 0,5 мг / л оксида азота, 1 час пастбища может вызвать угрозу для жизни illness. As используется первая помощь при остром отравлении, обильном приеме молока, кислородном дыхании, инъекции в мозг.
Жертва должна быть полностью relieved. In наблюдаются хроническое отравление, динамический пал, катар дыхательных путей, гемо-кровь и кариес. Предельно допустимое содержание оксидов азота в воздухе производственных помещений составляет 0,005 мг / л. 3) Nh4ной нагрев происходит слишком быстро(Мп.170°C) и может произойти взрыв. По этой же причине его расплав не должен нагреваться выше 300°С.
Параллельно с основными процессами, приводящими к образованию НАО, реакция протекает частично по схеме «noj = NH» + HNOj и 5NH » NOj =9НаО + 4na + 2hno«, кроме того, разлагается азотная кислота. Поэтому пиролиз закиси азота NH ^ NOj (или 2NaNO} 4-(NHO5SO4I) всегда содержит no и NO impurities. By пройдя через раствор Фесо, он может освободиться от него. Удобным способом получения чистого закиси азота является использование сульфаминовой кислоты1)
44) предварительно прокипяченной (для удаления оксидов азота) 73% реакции в этих условиях с азотной кислотой проводят количественно по формуле: HNOj + NHaSOjOH = NjO-F-SOa(OH) a-fH * 0.Примерно на 1 л больше предупреждений, 4 г NHaSOaOH и 10 см3 hnoj получаются. 4) числитель N ’ aO линейный[ 0 в присутствии различных оксидов. CoO NjO MgO CaO L 1 * 0 $ ЗАО FejOj 200250400 ″ 0 590 600 700 Первые 2 окиси являются полупроводниковыми/ MgIPA, а последние 2-полупроводниками L-типа, а промежуточное звено-изолятором (III§ 8 add.9).
Параллельно с реакцией пиролиза закиси азота в тексте протекает и вторичная сторона: 2нао » Na + 2NO. НАО совмещает с кислородом, и нагретый, смесь водопода или амиака будет explode. In кислые водные растворы, HjSOj медленно восстанавливают N ^до свободного азота, Sn до гидроксиламина и Ti *до аммиака. в) приведенное в тексте уравнение взаимодействия Cu и HNOj отражает только основное направление process.
In дело в том, что одновременно протекают и побочные реакции, в результате которых другие газообразные продукты (NOa, NaO, Na) смешиваются с оксидом азота. Содержание этих примесей зависит от концентрации исходной кислоты и других условий эксперимента. При получении оксида азота по рассматриваемой реакции удобно использовать обычные устройства для получения газа. Поместите медную стружку в центральный шар, а затем заполните устройство азотной кислотой плотностью 1,2 г / см3.
Очень чистый оксид азота можно получить, пропуская диоксид серы через теплую азотную кислоту с плотностью 1,15 г / см3.Реакция FeCla+ NaNOa-f2HC1= fecb + NaCl + HtO + no дает равномерный поток no. Сильный раствор Наноа медленно заливают в колбу, содержащую раствор соляной кислоты FeCb (Или FeS04). Другой удобный способ получения N0 основан на реакции: 2HN02 + + 2H1-2N0 + 12 + 2HjO. To сделайте это, медленно добавьте 50% серной кислоты в раствор. 4 L1 против NaNOj, 1 против KI.
7) образование оксида азота из элементов, по-видимому, является цепной реакцией и разворачивается по схеме О + н—► н. о. + Н + О * — нет-Ф О, и т. д. Приведенные на рисунке IX-19 данные касаются синтеза оксида азота из воздуха (при соотношении эквивалентности исходного газа выход N0 несколько выше). При температуре более 3000 ° С содержание N0 в равновесной смеси начинает уменьшаться. Это происходит главным образом из-за диссоциации молекул ОА и атома.
8) молекула N0 характеризуется расстоянием d (NO)= 1,15 А. K = 15,5 и очень низкая полярность этого соединения (u = 0,10). Г. с потенциалом ионизации □□Составляет 9,3 дюйма, основной нет * в * 2r□Ном на относительно малых высотах m w w w□ □ □ высотная атмосфера (до примерно 200 км). К вопросу об электронном строительстве 0 и и 0 0 ED есть 3 основных пункта для оксида азота. L2p видение представлено в виде — 0 мурамин: & 2П и 0• -…«• В-пр п-пр 1 н-0 | G * 2s w и 0 первая формула (классическая) G2s 0 (Λ) 0 торчит на небольшом ядерном расстоянии、 Кроме того, если значение константы мощности велико Ч0 «ч0 нет * вы. Выбор 2-го и 3-го формата- Рисунок IX-.
22 * молекулярная орбиталь оксида азота. Лами » полностью способен производить Хотя и не обоснованные, они оба лучше соответствуют структурным особенностям молекулы N0, чем классические. По-видимому, 3-е выражение является наиболее точным. Электронное сродство молекулы N0 оценивается в 20 ккал / моль. 9) 2-й N0 из приведенного выше уравнения содержит 2 простых и. 1 3 электронная связь. Наличие последнего было также предложено опросом (1931) в некоторых других случаях, например, в случае молекул кислорода.
С этой точки зрения она выражается в формуле r O77; OS, содержащей 1 простое соединение и 2 3 электронных соединения. В основе этого предположения лежит спектроскопически установленная возможность присутствия в газовой фазе относительно стабильного молекулярного Иона HeJ (ci (HeHe)= 1,08 А. энергия диссоциации (в He и He) составляет 55 ккал / моль).Примерно половина энергии простой связи между теми же атомами, то есть Это примерно в 2 раза слабее, чем обычная 2-электронная связь.
Как и в случае с N0、 •• Более вероятной является структура молекулы кислорода типа iCfeOl с 2 неспаренными электронами (VIII§ 1 add.13). 10) типичная природа и энергия (ккал / моль) диссоциации монооксида азота на элемент сильно зависят от заряда частицы. N0 (в N и O) N0 (в N и O) NO4 (в N и O*) 137 151 251 Ход такого изменения энергии диссоциации четко интерпретируется с точки зрения молекулярно-орбитального метода (VI§ 3 add.14).
Как видно из рисунка IX-22.At уровень релаксации n * 2p, 2 иона имеют 2 электрона, молекула N0 имеет 1 электрон, и нет никакого Иона N0 *вообще. 11) критическая температура оксида азота составляет −5 * С при критическом давлении г-94 atm. In жидкое и твердое состояние, оксид азота (mp 164, mp. -151 ° C) синего цвета. 100 объемов воды растворяют при 0°C, около 7 объемов N0.Слабо горящий фосфор исчезнет с этим газом, но сильно горящий будет продолжать гореть.
При нагревании смесь N0 и H3 в равных количествах взорвется. Под высоким давлением азотоводородной окиси (500 На), оно окисляет двуокись серы согласно 2Н0 + 2соа = 2С03 + Ндж даже на нормальной температуре. NO также взаимодействует с гидроксидами щелочных металлов при комнатной температуре в следующих параллельных реакциях: 4NO-L 2EON = NjO + 23NO * + NaO и GNO + 4EO!1 = Na-f 43NO,+2HaO. In у многих Li C процент этих процессов увеличивается.
В растворе SOa восстанавливает оксид азота до NaO, non-Cr, гидроксиламина в кислой среде и аммиака в нейтральной среде. Точно так же он восстанавливается до аммиака NO и водорода в момент его возникновения. Напротив, сильные окислители (CrOj. Hphone » Озон окисляется до оксида азота. Озон легко преобразует оксид азота в N2Oj. С хлористым водородом NO образует красный аккреционный продукт состава N1•HC1, который устойчив только в твердом состоянии ниже −130 см3. Попадание комплексных соединений во внутреннюю область характерно для NO.
Примерами таких комплексов являются Cs ^ ReCUNO]и [Cr (NII3) bN01CI? Обычно связи с комплексообразующим агентом не образуются атомами азота, но иногда (например, с Kttftu (ON) CUl) образуются атомами кислорода. 12) молекула c1no полярна (c = r = 1.83) и имеет форму треугольника[c /(CIN)= 1.97, rf (NO)= 1.14 A. ZC1NO =113е), константа прочности связи k(N0)= 14.1 и k(NCI)= * 1.7.Нуклиды нитронитрохлорида (Мп.-60, ВР.- 6еС) в присутствии древесного угля (играют роль катализатора), no и 50°C от хлора рекомендуется. N0 взаимодействует с хлором с образованием брома, образуя черно-коричневый: нитрозобромид-Брно(cf(BrN’) = 2,14, d (NO)= » 1,15 a, Z BrNO = 114°,q = 1,80].
В отличие от C1NO, его замечательный пиролиз начинается с более чем 100 ВК. интромия бромида (т. илл.- 55, т.-2°С) разлагается уже частично при нормальных условиях. Соответствующее йодидное производное неизвестно, a FNO(c /(FN)= 1,51,d (NO)= 1,14 A. ZFNO = 110°.K(FN)s * 2.1,k (NO)= 15.1,c-1.81]может быть проникающим обменным разложением C1NO и AgF. Фторид-бесцветный газ(ТПЛ.-133, Т. Кий.-00°С). С химической стороны, все 3 нитрозилгалогенозида характеризуются тем, что они легко переносят галоген на другие substances.
In в частности, для фторированных интрозилов очень характерны взаимодействия с кремнием, бором и красным фосфором, которые воспламеняются парами ФНО. Продуктами реакции являются соответствующие фторид и оксид азота. Когда fno медленно смешивается с OFa, реакция протекает по схеме FNO + OFj = Oj + NF3,и высокоскоростное смешение обоих газов сопровождается взрывом.2 компонентное соединение FNO — FNO•3HF (bp.94)и ФНО-ПГ(ВР.68CC).
13) жидкий нитроцид ила имеет достаточно высокую диэлектрическую постоянную (е = 10 при 20°С) и несколько диссоциирует по схеме: no C1 ** NO * -CI-(ионный продукт[no ] [C1〜] = 10 ’1).Хлориды и комплексные соединения многих металлов (Pt, Sn, Sb и др.) может образовываться, легко гидролизуется водой до HCl и HNOj. Известно двойное соединение с безводной серной кислотой: NOCl SOj(mp.104 CC) и NOCl-2SOs (mp.68°с).
Фотохимическое разложение нитрозилхлорида по общей схеме 2NOCI 4-2 / tv = 2NO-f Cla было предложено как разделение продуктов разложения (за счет их различной растворимости в CC14) и последующее использование тепла в обратной реакции, при необходимости, но в принципе возможен 1 способ аккумулирования солнечной энергии. Нитрозилбромид характеризуется добавлением молекул брома с образованием NOBr3 (MP 40, mp 32°C разложение).Это вещество по своей природе подобно другим производным, в том числе ионам Т ^(VII§ 4 add.39).
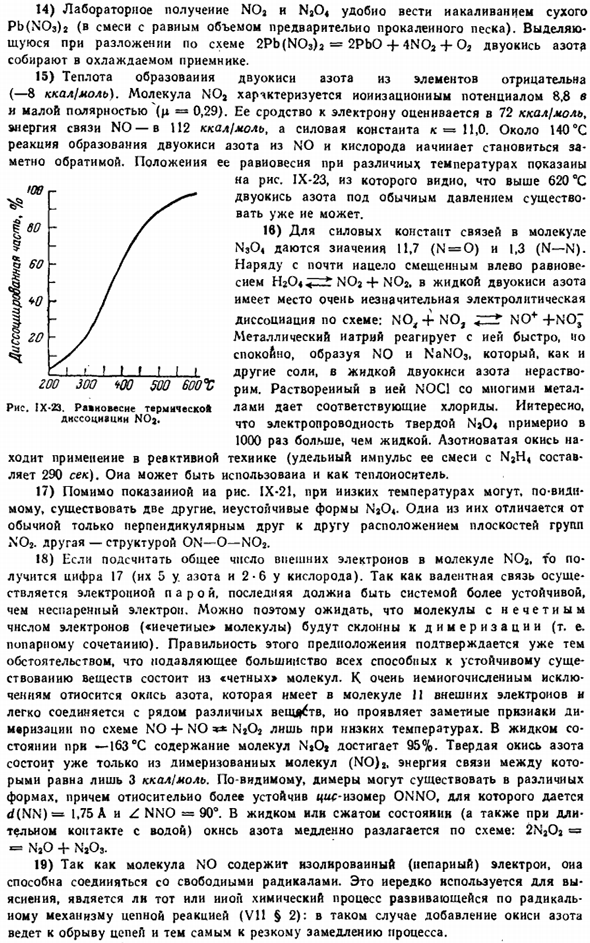
14) лабораторные препараты NOa и Na04 удобно проводить путем накаливания сухого Pb (в смеси N03h (в равных количествах прокаленного песка). 15) теплота образования диоксида азота из элементов отрицательная (-8 ккал! Моль.) Молекулы NOa характеризуются потенциалом ионизации 8,8 В и низкой полярностью (μ= » 0,29).Его сродство к электронам оценивается в 72 ккал! Моль, энергия связи N0 равна U2 ккал/ моль, постоянная силы f£= 11.0.At около 140°C, реакция образования двуокиси азота от NO и кислорода начинает быть замечательн reversible.
It показывает положение равновесия при различных температурах. Рисунок 1-23, из которого видно, что при нормальном давлении диоксид азота выше 620 ° С больше не присутствует. 16) константы прочности связей молекул N304 имеют значения 11,7(N = 0) и 1,3 (N — N).Почти полностью вдоль смещенного влево равновесия, HjOi ^ Ht NOj + NOa. С жидким диоксидом азота происходит очень незначительная электролитическая диссоциация по схеме: NO,+ NO, j «»» * 1 NO * + no-металлический натрий реагирует быстро и мягко, образуя N0 и NaN03. __
Другие соли в нерастворимой жидкой двуокиси азота Z00 300 * 00 500 SOO°C R. IX-23, в котором NOC1 растворяется со многими metals. By равновесие с термической рамой, соответствующие хлориды получены. Диссоциация Iiterecio, Ноа. проводимость этого твердого вещества Na04 приблизительно равна 1000 раз жидкости. Оксид азота используется в струйной технологии(удельный импульс смеси с NaH4 составляет 290 секунд).Oir можно использовать в качестве теплоносителя.
17) в дополнение к тому, что показано на рисунке IX-21, при низких температурах, по-видимому, Na04 имеет 2 неустойчивые формы.1 из них отличается от обычных только тем, что плоскости группы NOa расположены перпендикулярно друг другу. Еще 1 — это структура on-O-NOa. 18) вычислите общее количество внешних электронов молекулы NOA, вы получите 17 (5 С. есть азот и 2-6 кислорода).Поскольку валентные связи образуются электронными парами, электронная пара должна быть более устойчивой системой, чем неспаренный электрон.
Поэтому предполагается, что молекулы с нечетными электронами («нечетные»молекулы) легко димеризуются (т. е. парные связи).Правильность этого предположения уже подтверждается тем фактом, что большинство веществ, способных к стабильному существованию, состоят из счетных молекул. Очень немногие исключения включают оксид азота, который имеет внешний электрон в молекуле А и легко связывается со многими различными частицами, но проявляет признаки диморфизма, которые заметны только при низких температурах из-за схемы N’o-f NO * * \ ’ a02.
В жидком состоянии при температуре от −1°С до 3°С содержание молекул N-0 достигает 95%.Твердый оксид азота состоит только из уже димеризованной молекулы (NO), энергия связи которой составляет всего 3 ккал / моль. По-видимому, димеры могут существовать в различных формах, и изомер CDE ONNO является относительно стабильным, для которого</(NN) s 1.75 A и Z NNO = 90°являются given. In в жидком или сжатом состоянии (и при длительном контакте с водой) оксиды азота медленно разлагаются по схеме:2NaOa =α = NaO + Na03. 19) никакие молекулы не могут связать к свободным радикалам потому что они содержат изолированное (непарное) electrons.
It часто используется для выяснения, вызывает ли тот или иной химический процесс цепную реакцию в соответствии с радикальным механизмом (VII§ 2): в этом случае добавление оксида азота приводит к остановке цепи, что в свою очередь приводит к резкому замедлению процесса. 20) реакция добавления кислорода к N0 может быть использована для его открытия(в смеси с N * 0 и так далее).Она ими особенно интересуется. Это один из очень немногих известных случаев, когда при повышении температуры химический процесс не только ускоряется, но и несколько замедляется(средний температурный коэффициент скорости равен 0,9).
Объяснение этой аномалии скорости основано на том, что в реакцию вступают только димерные молекулы N202.Вероятность возникновения очень быстро падает с повышением температуры. 21) 50% как HNOj; путем капать в Os(или крахмал), безводный азот(mp. It наиболее удобно получить температуру −101°C).Эквивалент no n-NOa, образованный реакцией 2hn03 + + + AsjOj в 2hasos-f-NO + N02 в равном количестве, проходя через трубку, помещенную в охлаждающую смесь, легко соединяется.
Когда электрическая искра проходит через жидкий воздух, она также образует безводную азотную кислоту (в виде синего порошка). 22) термическая диссоциация нитритного ангидрида уже начала падать ниже 0 * С. При 25°С и нормальном давлении содержание N203 в равновесной системе N203 < * ^ rt N02 + NO составляет всего 10,5%. 50 ° С-на 5,8%, 100 ° С-на 1,2%. молекула днитротриоксида плоская, параметр< / (ON)= l.
L4 имеет асимметричную структуру ON-N02. РФ (НН) » 1.86. РФ (нет) » = » 1.21 а, з ОНН 105°. Z NN0 = 113 и 117°, q = 2,12 жидкость Nt03 тщательно перемешивают с водой только при температуре 55°C и выше (под давлением). 23) реакция 2NH3 + NjOj = * Na0-f при взаимодействии NaOa по 2NH * NO с сильно охлажденным жидким аммиаком образуется оранжево-красный нитрозамид formed. It является очень неустойчивым и разлагается при испарении избытка аммиака(по схеме 2NH2NO = «Nj + NH» N02), но продукты замещения водорода и некоторых органических радикалов в нем также известны в свободном State.
An пример — (CHj) iNNO. Определяется следующее ядерное расстояние: d (NS)» 1.09, d(CN) » 1.45. < Ф(НН)= 1.33. d (NO) = «1.20 A. при взаимодействии NjF с NO» (§ 1 add.92), производными фтор-Ф? ННО тоже был obtained. It представляет собой фиолетовое вещество (Мп.- 160, Мп.-112°C) — это оригинальный продукт, который был разобран. Энергия связи NN оценивается в 10 ккал / моль. 24) исследование внутренней структуры кристаллов NaN02 показало, что ионы NOJ имеют треугольную структуру с параметром 4.8.
In параллельно с основной реакцией (восстановлением Hnnoj до N0) могут быть частично продвинуты побочные реакции:2HNO»-f 4H1-21 * + NjO-f 3H20. В случае ионов Fe азотистая кислота восстанавливается до N0, а в случае ионов Sn азотистая кислота восстанавливается до NjO. Окисление HN02 с помощью H * 02 до азотной кислоты происходит только в кислой среде и протекает через промежуточное образование HOONO, назоитовой кислоты. Последняя неустойчива и неразличима, но K> 10 \ То есть природа кислоты гораздо более выражена, чем природа перекиси водорода(K = 210′, a).Соответствующий анион OONO7 в щелочной среде относительно стабилен.
27) диссоциация HNOa на основном олове очень мала и обнаруживается только в слиокислой среде. H * + HNO для равновесия реакции? «*Н * 0-f NO*, значение/С=2У „7 found. In среда с низкой кислотностью, равновесие N0 * NO,“ * N, 0, сильно смещена вправо. По-видимому, окислительное действие азотистой кислоты протекает именно через N0 * ions. In в частности, окисление Nj (§ I ext.95)показал, что nonj протекала с образованием промежуточных и NONj раскладывается в Нью-Джерси и Н20.
В качестве соединения, соответствующего основной функции hno2, рассматриваются нитрозильные производные общей формулы NOx, где X-одновалентный анион. Желтый NONj, который стабилен только под действием нитросунола галогена (X-F, CI или Br) и −50 ° С (mp 57°С), далек от типичной соли по своим свойствам, но другие известные вещества того же рода подходят them. So кристаллическая структура N0Cl04(.Легко получается под действием смеси N0»+ N0 и очень сильной хлорной кислоты)такая же, как и структура NH4C104.Эта соль была предложена в качестве окислителя для твердого реактивного топлива.
Среди многих других производных того же типа наиболее интересными являются твердые, но довольно летучие солеподобные производные ксенона-(NO) jxefa и NOXeOF5. NOBrF4 (mp 255°С), только стабильный при низких температурах, NOCIF4 и общая формула N03F <(где где-Re, Mo), MOEG7(где—Re, Mo, W), (N0) j3Fe(E Tc, Re, W). 29) В качестве нитрозильной соли(N0HS04) необходимо учитывать также нитрозилсульфат (VII§ 1, дополнительный 107). С02 и сильно охлажденном дымящей х. Это удобно, чтобы получить это бесцветное кристаллическое вещество, по действию Ной. При 73 ° С он плавится и медленно превращается в нитрозилпирросульфат.
Это также может быть получено прямым взаимодействием NOa с жидким диоксидом серы(по схеме: 3NOa + 2SOi = — ■=•(NOJjSjO; + N0).Бесцветные кристаллы (NOhSjOz) не только растворяются, но и кипятятся без разложения (mp 233, mp 360°C).Как и другие производные соли нитрозила содержат ионы N0 .Эти нитрозил-ионы (нитрозоний) имеют структуру. (: N » 0: 1 и N0 силлио [d (NO)= 1,06 а] укорочены по сравнению с ядерным расстоянием молекулы. По данным химии нитрозильных групп, обзорная статья etsya.*
30) раствор нитрозильной соли в растворителе, который не взаимодействует с N0 *(например, концентрированный H2S04 N0HS04), и некоторые его твердые соли(например, NOAlCl4) могут поглощать оксид азота в соответствии с равновесием No4 + N0 <NjOj. Образование ионов оксида азота при высоком давлении N, стабильном только при 0?Это обычно сопровождается появлением синего (не очень фиолетового) цвета, который становится красным при очень сильном охлаждении.
Структура этого Иона до сих пор не установлена. ON•может содержать одноэлектронную связь N0. 31) при насыщении азота сильным раствором K2SO3 образуются бесцветные кристаллы нитрозогида калия, соответствующие общему составу и структуре KjSO ^ — NjOj 0NN (0K) s03k. In водные растворы, эта соль (растворимость 1: 10) постепенно разрушается KaS04 и NjO. Известны и другие подобные производные катионов. 32) оксид азота участвует в образовании соединений и как минус м и Провериольный радикал с расчетной структурой (N = 01″, изоэлектрическая точка •* м Возбужденное состояние молекулы кислорода (VIII§ 1 Добавление.
13). таким образом, под действием NO был получен раствор Na или Ba в жидком аммиаке, NaNO и Ba (NO) a. Имеют солеподобную особенность (и идентичны нитрильной соли, чтобы рассмотреть ниже •А л и о н. Гл. Лиинс Д. успехи в химии. 1956 год. Привет 9. 1120. Кислота.)При взаимодействии оксида азота с амальгамой наиболее активного металла образуется солеподобное вещество с аналогичным составом. Другая интерпретация рассматриваемого соединения предполагает наличие ионов N0 и ЦИС-структуру Иона N2Oj.
At в то же время, согласно данным инфракрасной спектроскопии, структура Льва, которая имеет угол около 100°у атома кислорода, может быть производным нитропланет лития. 33) водородное соединение, соответствующее Иону N0 (H — N = 0), бледно-желтое вещество, полученное в результате взаимодействия N0 с атомарным водородом (при температуре жидкого воздуха и низком давлении), повышается при нагревании до −95°C по схеме:2HN0 =Н2+ 2NO.
- Инфракрасная спектроскопия (III§ 6 add.9) устанавливает кратковременное присутствие этого соединения в продукте фотохимического разложения смеси N0 и NHj, используя его структурные параметры (rf (HN) −1,06, . В дополнение к бесцветному и водорастворимому Na2N20j, некоторые двухвалентные металлы (Ca, Sr. BA, Pb) получены производные гипо-нитратов и некоторые другие катионы. Ли самостоятельно или в алкалической окружающей среде, некоторые из их очень стабилизированы. Разбавленная кислота разлагается по схеме (2НаМ » ое=Н20+N20-F 2hno), а концентрированная кислота разлагается по схеме h2n2oj-н204-2no.
Поскольку последняя реакция необратима, азотную кислоту можно официально считать гидратом оксида азота. Количественное определение нитратов может быть основано на реакции по выражению: 2Na2N205 +3nacioa α= 3NaCl-f 4NaNOj. Имеются указания на то, что можно получить значение соли THna, Na2N20 *(за счет взаимодействия N ^ 4 с Na2N20j или Na2Na03). 4, 5, 6.
Благодаря действию окислителя (содержащего кислород в воздухе) нитраты очень легко превращаются в нитриты. Людмила Фирмаль
36) взаимодействие металлического натрия, растворенного в жидком аммиаке, с избытком N’anoj сопровождается образованием желтого порошка. НАО-Н = 0 НАО-Н-на а + 2Na- » •1 НАО-Н-О, НАО-Н-Она! Полученный продукт представляет собой соль нитрита (H4N20″).Последним можно считать гндразн, в котором весь водород смешивается с гидроксильно-оксильной группой. Как и H2N20a, закись азота может официально считаться только гидратированной окисью азота (2NO + 2HjO). в свободном состоянии она не получена. Под воздействием небольшого количества воды(или при нагревании выше 100°с) Na » N204 разлагается со взрывом.
37) при окислении дисульфида гидроксиламида калия (Hon (SOjOK) j]в щелочной среде образуется фиолетовый раствор, из которого можно выделить желтый кристалл композиции ON (SQaOK). Как в свободном состоянии, так и в виде простых солей нитратов (H «NO»или I ^ NjOe) неизвестны. Официально его можно считать гидратированным диоксидом азота. Судя по данным магнитных исследований, двойная формула рассматриваемого соединения справедлива для Кристалла, и решение является простым. Это указывает на низкую прочность связи n-n в расчетной структуре гидро-азотной кислоты: (НО), on-no (oh).
38) принципиальная схема оборудования для каталитического окисления аммиака показана на рисунке. IX-24.At одновременно с реакцией, указанной в тексте, могут происходить различные вторичные процессы (в частности, 4NH,+ 302 = 6H20 + — f. 2N2).для их предотвращения время контакта газовой смеси с катализатором должно быть очень коротким(около 0,0001 секунды).Катализатор, изготовленный из сплава платины и 5-10% родия, образуется в виде тонкой сетки, из которой получают смесь исходных газов. blown. In факт, аммиак и 12 об-см. Используйте смесь воздуха, содержащую NHj ниже%.Максимальный выход оксида азота составляет около 08% от теоретического значения.
39) превращение NO в HNN $представляет значительные технические трудности, главным образом вызванные относительно медленной реакцией 2N0 + 0, α= 2NOj, а также некоторым снижением скорости растворения NO2 по мере увеличения концентрации UNO. Для максимального использования NO необходимо создать абсорбционную установку с большим объемом, высокоразвитой внутренней поверхностью, а прочность HNO, полученного в нормальных условиях, составляет всего около 50%.
Увеличение давления ускоряет как окисление NO, так и поглощение NO, поэтому объем абсорбционной установки, необходимый для работы под высоким давлением, резко уменьшится, а результирующая концентрация HNOj возрастет(до 10% при 65%).Высококонцентрированный (98%) HNO «получают взаимодействием жидкости N * 04 и кислорода с водой или разбавленной кислотой при давлении 50 атм. Этот «первичный синтез» обычно осуществляется при температуре 70 ° C.
Полученную кислоту можно хранить в алюминиевом резервуаре. Применяется в струйной технике (в качестве окислителя). 40) с химической точки зрения интересно, как азотная кислота образуется при «сжигании воздуха», которое осуществляется»методом дугового горения», впервые осуществленным в 1901.As фото. IX-19.Более или менее благоприятное равновесие синтеза NO из элемента достигается только при очень высоких температурах.
С другой стороны, в этих условиях он устанавливается практически instantly. In в связи с этим задача технической реализации синтеза no была сформулирована следующим образом: необходимо было найти способ нагрева воздуха до достаточно высокой температуры. ’т т ч ч ч — «Г1 г-п Десять & д? дцт Kawx-jantfjp Ох. № Диаграмма IX-24.Схематическое изображение оборудования для контактного окисления аммиака. После этого газовая смесь очень быстро охлаждается до температуры менее 1200°С, чтобы предотвратить разложение оксидов азота и азота и кислорода.
Для решения этой задачи в качестве нагревателя использовалась электрическая дуга, дающая температуру около 4000°С. Если такую дугу поместить между полюсами сильного электромагнита, то ее пламя образует горящий диск. Если воздушная струя проходит быстро, то в момент соприкосновения с пламенем последняя будет очень горячей, а затем быстро охлаждаться до температуры менее 1200 degrees. In фактически образовавшийся газ переместился непосредственно в так называемый норвежский нитрат-Ca (NOj) j.
It использовался как ценное минеральное удобрение. 41) на фиг. 1 показана конструкция печи для «сжигания воздуха». IX-25.Рисунок: а-подкладка (внутренняя подкладка). Б-электромагниты, в-электроды. G-это потребление. L-выход ионизированного газа. В процессе технологического процесса выход NO составляет около 2 об.% , Но это не играет особой роли из-за отсутствия стоимости сырья-воздуха. Гораздо большим недостатком дугового метода является очень высокое энергопотребление, поэтому в настоящее время этот метод не используется.
В то же время ведутся работы по изучению новых возможностей проведения «воздушного горения» (с использованием тепла в регенеративных и ядерных реакторах).в то же время, если удается достичь достаточно благоприятных технико-экономических показателей, то рассматриваемый метод вновь входит в промышленную практику.
42) «горение воздуха» служит редким примером химических процессов, происходящих в плазме, то есть в газовой фазе, причем ионы и электроны играют важную роль components. In земные условия, это «4-е состояние материи», возникающее в результате ионизации атомов, не характерно, но наиболее распространено в масштабах Вселенной(поскольку звезды и межзвездный газ состоят из плазмы).
Плазма с температурой выше нескольких десятков тысяч градусов обычно называется»холодной»(в отличие от»горячей«, ей соответствует более нескольких сотен тысяч градусов).Такая холодная плазма, которая чаще всего создается с помощью электрической дуги со специальной горелкой («плазменный трон»), в соответствующем температурном режиме-5000-15 000°к-реакция протекает не только очень быстро, но и в необычном направлении. Последнее в основном касается высоких эндотермических процессов (это тоже синтез NO).
43) образование частичной плазмы происходит при сгорании топлива, и чем больше ее становится, тем выше температура горения. Если при этом продукты сгорания охлаждаются достаточно быстро, то они могут содержать NO. In в частности, с каждым километром пробега было установлено, что легковые автомобили выделяют вместе с выхлопными газами около 10 г оксида азота. Типичное содержание no в поверхностном воздухе составляет менее 0,005 мг / м.В результате фотохимической реакции (по общей схеме NO-f Oj » = NOt +О и O-f-Oj = 03) при увеличении содержания NO в воздухе накапливаются NOj и озон. Эти газы становятся основой»смога«.
Это ядовитая Зумайя, которая иногда нависает в районах с интенсивным движением транспорта. 44) до разработки синтетического метода азотная кислота была получена взаимодействием природного Нитрата и концентрированной серной кислоты в реакции, которая протекает легко при нагревании: как видно из Формулы: NaNOa + ll / SO « NaHSO »+ HNQ *использовался только водород lbSO».Это связано с тем, что.
При высоких температурах, необходимых для введения 2-го водорода в реакцию, полученный HNOj сильно разлагается и устройство используется для его получения Рига IX Y > лежащая схема: (для «» сжигания boj- Дух.」 Он изнашивается quickly. In кроме того, вместо низкой температуры плавления NaIiSO в этих условиях мы получаем высокую температуру плавления Na2SO4, которую очень трудно удалить из реакционного пространства. 45) молекула азотной кислоты полярна (q = 2.16).
Микроволновая спектроскопия (111§ 6, add.9) Согласно, он плоский и имеет структуру, показанную на рисунке. 1Х-26.Энергия связи O-N между гидроксильной и Нитрогруппой составляет 52 ккал / моль. (В кристаллах NaNOj) ионы NOJ представляют собой плоские равносторонние треугольники с азотом в центре (</(N0)= 1.22 A).Константа вынужденной связи jc (no) 10.4 электронное сродство радикалов noj оценивается в 90 ккал / моль. 46) с безводной азотной кислотой происходит следующее равновесие:3HNOj ^ Zi NaO * + N07 + N2 2°s H30 * ’+ 2N0 ″+ NOJ.
Разбавленный водой Эти равновесия смещаются влево и переходят к нормальной ионизации: Н20+ + HNO3 ^ tH30* + N0″.Однако даже при нормальном концентрированном HNOj кажется, что он содержит как n2o5, так и катионный Нитронный Ил (нитрононий) NO в небольших количествах. Если линейная структура (0 = N = 0J) и ядерное расстояние равно/ /(N0)= 1.15 A, то рассматривается следующее распределение электронной плотности:6s-+0.60, 60 = +0.20. 47) hnoj безводный очень хорошо плавит жидкость Nj04 и плавится в определенной степени.
Система HNOj — N204, насыщенная обоими компонентами, разлагается на 2 жидкости layers. At 20°C, он содержит 41% HNOj и 56% N, 04.А другие-93%Nj04 и 7%HNOj. Растворение N204 в безводном HNO3 приводит к увеличению плотности, снижению температуры замерзания (18%раствор замерзает только при −73°С) и резкому повышению окислительной активности. Такие решения используются в реактивной технике. Растворы некоторых органических веществ (таких как нитробензол) в безводном HNOj используются в качестве жидких взрывчатых веществ.
48) hnoj безводный является хорошим растворителем для некоторых солей (в основном нитратов одновалентных металлов) и свободных кислот. Такие растворы обычно обладают высокой проводимостью, что свидетельствует о наличии ионизации по следующей схеме, например: KNO3 + HNOj K * +(H(NOjh))». § 1 добавить.18) расстояние J (OO) −2.45 группа 0-IJ * » — с плоской структурой 0.Двойные нитраты Cs, Rb, K (и некоторые композитные катионы), соответствующие структурному типу M [H (NOj) j], были отделены в твердом состоянии.
49) плотность чистых белых кристаллов безводной азотной кислоты составляет 1,52 г / см1, плавящихся при −41 X. 2. Известны 2 кристаллогидрата, состав которых показан на фиг. 2. 1X-27.As это видно из рисунка 1X-28. 30% раствор HNOj обладает максимальной проводимостью. Охлаждение до-0°C может быть достигнуто путем смешивания предварительно охлажденного концентрированного HNOj со снегом (1: 2 по массе) до −56 ° C. 50) ниже приведены данные, показывающие зависимость плотности и температуры кипения водного раствора от процентного содержания HNOj.
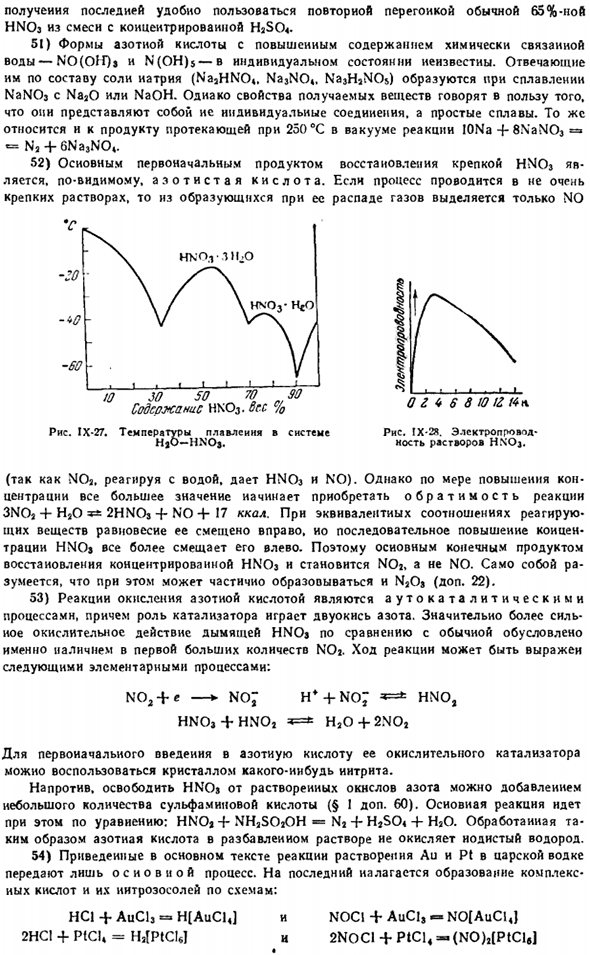
Хной. К….. 100 94.1 86.0 68.4 65.3 47.5 24.8 Платный, г / с * 3 I. SI 1.49 1.47 1.41 1.40 1.Е0 1.15 Температура кипения. С… 86 99 115 121 ′ 119 113 104 Из этих данных видно, что при самой высокой температуре кипения (122°С) имеется раствор, содержащий 68,4% HNOj. Такой раствор в конечном счете получают выпариванием как более разбавленных, так и более концентрированных кислот. Для Узор » Ч \ Сок. Для получения последнего удобно многократно ферментировать обычную 65% HNOj из смеси с концентрированным H2SO4.
51) форма азотной кислоты, содержащая много химических связей воды в отдельных состояниях-NO (OH)*и N (OH) s-неизвестна. Соответствующий состав натриевой соли (NaaHN04.NajN04.N’ajhanos) образуется путем слияния NaNOj и Na2O или NaOH. Но свойства полученных веществ подтверждают тот факт, что они представляют собой отдельные соединения и простые сплавы. То же самое относится и к продукту реакции, протекающей при 250 ° С в вакууме, I0Na-f 8N’anoj «„= Na + 6Na9NO“.
52) основными исходными продуктами восстановления мощного HNOj являются: очевидно, закись азота. Если процесс проводится с не очень сильным раствором, то из газов, образующихся при его распаде, выделяется только N0. −60. 10 JO SO 70 » 90 содержание hnoj. Руда.% Диаграмма IX-27.Темпера. Для экскурсии по Хжо-хной. Система-в-системе (Потому что NOa реагирует с водой, чтобы произвести HNOj и N0).Однако по мере увеличения концентрации обратимость реакции 3N0a + Na0 2HN0j-F NO + 17 ккал начинает возрастать.
Если соотношение реагирующих веществ равно, то их равновесие смещается вправо, но при непрерывном увеличении концентрации HNOj оно смещается все больше влево. Таким образом, основным конечным продуктом восстановления концентрированной HNOj будет NOa. Нет N0.In в этом случае нельзя не упомянуть, что NaOj также может быть частично сформирован (дополнительные 22). 53) реакция окисления азотной кислоты является самокаталитическим процессом, кроме того, диоксид азота играет роль катализатора. Очень сильное окислительное действие дыма HNOj по сравнению с обычным связано с наличием большого количества первого NOa.
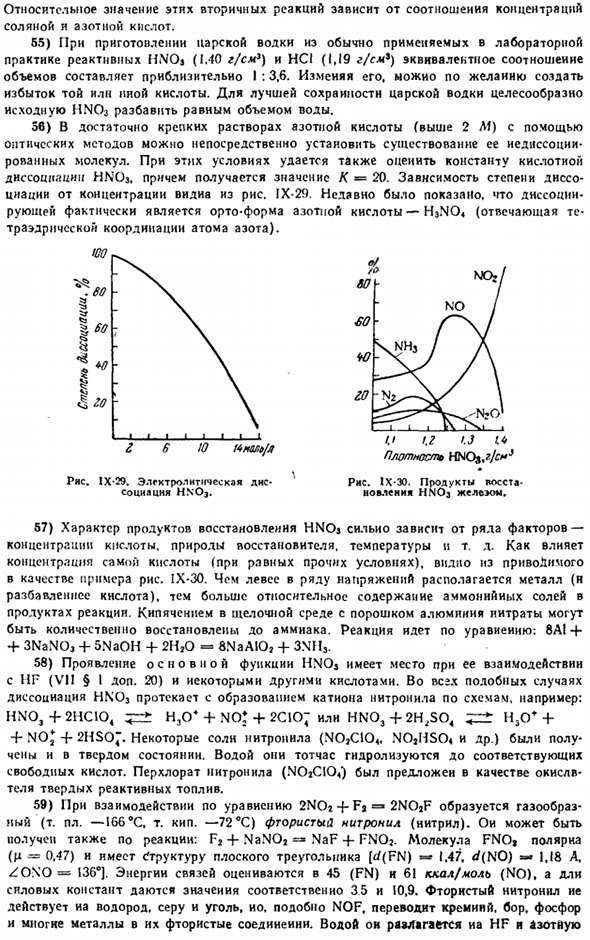
Протекание реакции может быть выражено в следующих основных процессах: О Z » $ 8 Yu F2 Ml. Рис. 1Х-2Д. Электропроводность раствора HNOj. N07 H ’+ NOJ Ноа + е Разработка плана. HNOj + HNOj Для первого введения катализатора окисления в азотную кислоту можно использовать кристаллы нитрита. Альтернативно, добавляя небольшое количество сульфаминовой кислоты, HNOj может быть удален из растворенных оксидов азота(§ 1 add.60).Основная реакция протекает по формуле: HNOj +Nhasoaoha= Na + H * SOA+ NaO. Азотная кислота, которую обрабатывают разбавленным раствором таким образом, не окисляет пентогидроген.
54) реакция растворения Au и Pt в царской водке, указанная в тексте, передает только основной процесс. Последний, согласно схеме, накладывается на образование сложных кислот и их солей itrozole: Хьо + 2N0a nc1 + AuClj = H [AuC14J2HC1-f P1CU = HafPtCUI NOCl + AuCls-NO [AuCl4) 2N0CI + PtCl4 — (NO)a [PtCle] Относительная значимость этих вторичных реакций зависит от соотношения концентраций соляной и азотной кислот. 55) при приготовлении царской водки, обычно используемой в лабораториях с реактивными HNOj (1,40 г / с * 3) и HCI (1,19 г / см*), эквивалентное объемное соотношение составляет приблизительно I: 3.6.
By изменяя его, вы можете создать избыток 1 или другой кислоты путем desire. To лучше сохранить царскую водку, рекомендуется разбавить исходный HN03 равным количеством воды. 5С) достаточно сильный раствор азотной кислоты с использованием оптических методов (более 2 Л1) позволяет непосредственно проверить наличие в ней ионно-диссоциирующих молекул. В этих условиях также можно оценить константу кислотной диссоциации Hnnoj. Скройте значение K * = 20.Зависимость степени диссоциации от концентрации индуса показана на рисунке 1 IX-29.
Недавно было показано, что hjn04 (соответствующий тетраэдрической координации атомов азота), ортотип азотной кислоты, фактически диссоциирован. Рисунок 1X-29. Электролитическая диссоциация HN’OJ. Плотность Уотсом / ч3 Диаграмма IX-30.Гнойные изделия из железа. Nnsh / л 57) характер продукта восстановления сильно зависит от многих факторов, таких как концентрация кислоты, природа восстановителя, температура и т. д.
Концентрацию самой кислоты(при эквивалентных условиях выдержки) можно увидеть на рисунке. IX-30. чем выше металл (N-разбавленная кислота) слева от диапазона напряжений, тем больше относительное содержание солей аммония в продукте реакции. нитраты могут быть количественно восстановлены до аммиака путем кипячения в щелочной среде, содержащей порошок алюминия. реакция протекает по уравнению: 8AI+•4-3Na. NO,+ SNaOH +2Н, 0 = 8NaAIO,+ 3NH.
58) выражение основной функции HNOj выражается в HF (VII§ I add.20) и происходит во время взаимодействия с другими acids. In в таких случаях диссоциация HNOj протекает с образованием нитронильных катионов по следующей схеме: например, HNO,+ 2НСЮ4Н30 * + noj + 2сю-или hno, + 2H, S04^ Н, 0 * + + NOj + 2HSO».Некоторые соли нитронила (такие как NOjClO * NO1HSO4) также были получены в твердом состоянии. Они немедленно гидролизуются водой и становятся соответствующей свободной кислотой. 59) при взаимодействии по формуле 2NOj + Fj = 2NO2F, газ (температура плавления −166 ° С.
Нитронил фтора (нитрил) образуется при температуре кипения (температура кипения—72°С). Oi также может быть получен реакцией. Ф * * * На. Ной = » Наф-Ф Fnnoj.»Молекула FNOt полярна (fi = 0.47) и имеет плоскую треугольную структуру (</(FN) 1..47,</(N0) a-1.18 A. ZONO = 136°).Энергия связи оценивается в 45 (FN) и 61 ккал / моль(N0), а длина постоянной силы задается в 35 и 10,9 соответственно. Нитронилфторид действует на водород, серу и уголь, превращая кремний, бор, фосфор и многие металлы в соединения фтора, а также NOF. Ия расщепляет HF и азот Acid.
In некоторые другие элементы фторида NOjF образуют комплексы, например, бесцветные NOtMoFy и NOjWF. 60) при взаимодействии Na04 и Fa при −30°C в алюминиевом реакторе синтезировали изомеризованный фторированный нитронил и реакцию превращали в ONOF. It представляет собой бесцветный газ, который при хранении более или менее быстро переходит во фторированный итлопираль. Аналогичное производное хлорида N02F (NOaCI) получают действием или реакцией озона и NOC1: HSO3Cl + HNOj H3SO4 + C1.«
Его плоские молекулы характеризуются структурными параметрами d (ClN)* = 1.84, rf (NO) -» = > 1.20 A,^ ONO * = 130°, низкой полярностью (μ0.42)и константами прочности связи 4.2( CI-N) и 9.5(N <= » O).Нитронилхлорид-бесцветный газ (Мп.-145, Мп.-14°С).При хранении медленно разлагаются NO *и C12; щелочной раствор разлагается по схеме NOaCl-f 2NaOlI = NaN02 + NaOCl-f HjO. И дают HNOj и HCI с водой(по-видимому, в результате вторичной реакции HNOa и HOC1).никакого бромида получено не было.
По-видимому, при комнатной температуре он присутствует только в газовой фазе, которая включает в себя как избыток, так и NOj. И Br2. Ититронн фторсульфонат итерезен представляет собой соль, которая одновременно дает 3 кислоты при гидролизе: N0sS03F +2Н20•= HNO,+ H SO < — f HF. 2) nitramide (NHjNOj), который представляет собой Амид производные, соответствующие Галоидные nitronyl (нитрил), является промежуточным продуктом пиролиза аммиачной селитры (Нью-Хэмпшир «Ной- * — Н20-Ф NHaNO«2НаО + Н20).
В свободном состоянии, оно может быть получено только в комплексе косвенным образом. Его молекулы имеют большой дипольный момент (q «3.6) и следующую структуру: d(HN) 1.01,</(NN)» 1.43, d(NO) −1.21 A. ^ HNH = » 115°. ZONO =-130°, угол между плоскостью HjN и NO *52°. Нитрамид представляет собой нестабильное бесцветное кристаллическое вещество (mp75°decomp. it это не так. Легко солубле в воде, алкоголе и ether. In водные растворы, нтрамнд обладают слабо выраженными кислотными свойствами(/ с * 3-10-7).
Но взаимодействие со щелочью не приводит к образованию солей, что приводит к разложению Пирамида на Н20 и Н20.Только 1 из его солей, HgNNOj, была выделена. 63) оксонитротрифторид-ОНФ *получают путем воздействия разряда на смесь NF и 02.Эта бесцветная газовая (mp-160, mp-85°C) почти неполярная(c — = 0.04) молекула имеет слегка искаженную тетраэдрическую структуру с атомами азота вблизи центра и следующими параметрами: d(ON) * 1.16, rf(NF)= 1.43 A,^ ONF «117°,ZFNF = 101°,k(ON)» = 11, 6,#c (Nf4).
Для энергии связи приведены значения 98 (ON) и 44 ккал / моль (NF). дипольный момент, близкий к kul, малый rf (ON), большой k (ON), исключает интерпретацию этой молекулы как FaNO или ONFJF, говоря » формула 0 = * NF$, которая содержит азот при 5 валентностях. В нормальных условиях ОНФ3 стабилен (до 300°С в никелевом контейнере) и практически реагирует со стеклом или водой. Однако это сильный окислитель, который проявляет преимущественно фторирующий эффект (с восстановлением до ОНФ).Например, окислите Cli к C1F и преобразуйте NjOi к N02F.
At в то же время, Sbrили или ASF $ (IO PFS) тип (ONF, X3F J J.) могут образовывать комплексные соединения. Катод ОНФ имеет форму плоского треугольника. Этот катион-ONF3 (атом азота практически изолирован от внешних воздействий). 84) при взаимодействии безводного HNOj и фтора можно получить фторированный нитратный продукт замещения фтористого водорода азотной кислотой. Реакция его образования протекает по формуле: F * — f HNOj = * HF-f-F-FNO.
Это соединение можно также рассматривать как нитронитонит-нитофторит-Ноджоф [<*(оф) 1,42 а]. Азотнокислый фтор-бесцветный газ с характерным удушливым запахом (Мп.-175, mp. −46°C). он постепенно разлагается при хранении и взрывается при контакте с некоторыми органическими веществами (спирт, эфир и т. д.). В воде нитраты фтора очень растворимы и могут гидролизоваться. Относительно медленно. При взаимодействии с разбавленным раствором NaOH реакция протекает четко по формуле: 2FNO * + 2NaOH «in 2NaNO» + FjO + HjO. Взаимодействие с сильным раствором NaOH сопровождается выделением кислорода.
FN03 не взаимодействует с уксусной кислотой, перманганатом, и большинств металлами и производит твердые аддукты в желтом цвете с SbCI $и TiClj. 65) бесцветный CIN03 (mp 107-107°C)+18°C, подобный нитрату фтора, получают по следующей реакции: 2C1?0 + 2X0 ″ = » 2CI.\ ’03 + clj по. Взаимодействие со щелочью сопровождается образованием соответствующих нитратов и гипохлориты. Аналогичное производное брома и йода было также получено(VII§ 4 add.60). 66) черный порох-это тесная смесь серы и угля с KN03.Этот тип смеси, по-видимому, был изобретен около 100 года до нашей эры. e.
In Китай. Их взрывной эффект был истолкован как результат внезапного сочетания противоположных принципов » Ян » и » Инь » (я добавляю§ 1.4).кроме того, сера считалась положительным носителем, в то время как селитра считалась носителем инь. В Гнропе порох стал известен около 1200 года нашей эры. Первый точный рецепт описан в книге огня Марка Грека, составленной до 1250 года, следующим образом: вотрите эти 3 вещества очень мелко в мраморную доску и перемешайте.」 67)так называемый «нормальный» порох (68 KN03. 15 S и 17%
C) приблизительно соответствует составу 2KN03-f JC-f S, но в целом относительное количество компонентов отдельных сортов колеблется. CO, KrCO3, K2SO4, K2S2S2 также частично образуются, но реакция горения черного порошка протекает по общей формуле 2KN03-S 3S-4-S = N2 + 3C02-f-K2S + 147 ккал. Из-за наличия твердых частиц в продуктах сгорания, взрыв черного порошка сопровождается дымом. Напротив, пироксилин не образует твердых продуктов сгорания, поэтому порох, приготовленный на его основе, горит без дыма («бездымный порох」)、
68) большинство взрывчатых веществ получают путем взаимодействия азотной кислоты с определенными органическими соединениями при определенных условиях. Например, начиная с целлюлозы (обычно в виде хлопка), пироксициллин получают по следующей реакции: С6Н / <0 $ +ЗНХОе-3h20-F c6h702 (0N02) 3.It можно разобрать по схеме: 2QH; 0, (0N0.) 3 = 3Na-f-9CO — + — 3C02-f7H20.Потому что этот коллапс протекает экзотермически. Вода также выделяется в газообразной форме. Мгновенное образование большого количества газообразного вещества из небольшого количества твердого пироксиколина вызывает взрывчатое вещество effect.
In в частности, 1 килограмм пироксилина может выполнить работу, эквивалентную 47 миллионам кг в случае взрыва. 69) в силу характера действия взрывчатые вещества подразделяются на инициации. Быстро и медленно. Первый (детонатор типа азида свинца) характеризуется самой высокой скоростью разложения, которая может быть вызвана механическими воздействиями, такими как удар, жало и т. д. Пусковое взрывчатое вещество используется для оснащения взрывателя. Взрывчатые (иначе дробленые) взрывчатые вещества характеризуются низкой скоростью разложения, но они все еще очень высоки.
Например, скорость распространения пироксилинового взрыва составляет 6300 м / ССК. Из-за почти мгновенного разложения таких взрывчатых веществ образуется огромное количество газа, который создает резкое давление на окружающую среду. Бризантные взрывчатые вещества используются не только для различных демонтажных работ, но и для оборудования снарядов, мин, авиабомб и др. Обычно они взрываются только от взрыва. Начиная с того, что происходит в непосредственной близости от места взрыва вещества.
Метательные взрывчатые вещества детонируют только от взрыва, и их разложение характеризуется относительно медленным течением. Например, скорость распространения взрыва черного пороха составляет всего 300-400 м / с. Такие взрывчатые вещества используются при изготовлении винтовок и пистолетов. Скорость разложения метательных взрывчатых веществ относительно невелика, поэтому пуля или снаряд во время взрыва могут каким-то образом покинуть ствол и открыть выход образовавшемуся газу.
Наоборот, если патрон оснащен пироксирином, то ствол в данный момент Стрела будет разорвана. Поэтому производство бездымных взрывчатых веществ на основе пироксина позволит в первую очередь снизить скорость их разложения за счет добавления веществ, которые по своей сути не являются взрывчатыми. 70) ударная волна, возникающая при взрыве, находит множество существующих технических применений.
Например, они уже очень широко используются при штамповке стали parts. An интересное исследование по созданию нового света source. It работает всего за 100 минут 1 секунду, но очень ярко. Принцип их приготовления прост: небольшой контейнер с газами под нормальным давлением(например, Аргон) отделяется от взрывчатого вещества тонкой пленкой, при его взрыве она направляется в его сторону, мембрана разрушается, а плазма создается резким сжатием газа (доп. 42).
Таким образом, уже можно было получить плазму высокой плотности, нагретую до 5 миллионов градусов яркости Солнца (на единицу поверхности) и до 0 миллионов градусов. 71) в дополнение к реакции, указанной в тексте, безводная азотная кислота может быть получена дегидратацией HNOj при P20 $или пропусканием сухого хлора в сухую AgNOj.
Последняя реакция протекает по формуле.2C12 + 4AgNOj = = 4AgCl-f 2NjO $ — f 02. Молекула n2os полярна (C » = 1.39 в растворе CC14) и состоит из 2 групп NOj [«/(NO)= 1.21 A. i£ONO = 134°J, связанных друг с другом атомом кислорода (d (ON)= nog) под углом 95°между плоскостями группы 1.4 GA. Давление паров безводной азотной кислоты (т. е. 32°C) составляет около 300 мм рт. ст. в герметичной трубке при нормальных условиях и плавится при 41°C. 72) теплота образования кристаллического N2O из элемента составляет 10 ккал / моль, а теплота сублимации-13,0 ккал / моль.
Результаты исследования скорости разложения паров безводной азотной кислоты по общей формуле 2NaOs » = 02-f 2Nj04 свидетельствуют о том, что реакция представляет собой бислой и минную молекулу. Это связано с тем, что общая скорость химического превращения определяется его медленной фазой (IV§ 2, 3).
На самом деле при разложении N2Oj, очевидно, происходят следующие элементарные процессы: N20$ * * NOj + NOj(быстрая реакция), N0j-*-N0 + 02(низкая скорость), NOj-f NO N204(высокая скорость). Энергия активации разложения NaOs составляет 24 ккал / моль. При 0°C половина исходного количества распадается через 10 дней, а при 20 ° C-через 10 часов. 73) при взаимодействии N’AO с −80°100%11202 получается очень взрывчатое вещество с запахом BLE отбеливателя.
Соединения, для которых это исследование практически не проводится, известны в составе азотной кислоты HNO. Во время взаимодействия 100% HjOj с обычным концентрированным HNOj, OIA, который Is202202+ HNOj * * Н20-f HN04, частично образуется в растворе путем обратимой реакции. При использовании hnoj выше 70% происходит разложение(со взрывом), а при концентрации HNOj менее 20% происходит полный гидролиз HOONOj.
74) при испарении смеси N204 и избытка жидкого озона получается очень нестабильное белое вещество. Это соответствует формуле NOj, состав которой является самым простым. Поскольку это взаимодействие пероксидов азота с водой протекает медленно по схеме 2NOj +Н20= HNOj + HNOj + 02, то оно, вероятно, соответствует уравнению OaN-O-O-N0.It следует отметить, что имеющиеся данные по экзогенным производным азота достаточно противоречивы.
Смотрите также:
| Азот | Круговорот азота |
| Комплексообразование | Фосфор |

