Оглавление:






Исследование политропного процесса
- Как указывалось в предыдущем пункте, связь между параметрами, характеризующими процесс, может быть определена либо по определенному значению, либо по известному значению политропного показателя N, либо по известному значению удельной теплоемкости. Показатель политропного каната n является наиболее важным во всех расчетах последующих процессов, и его вполне естественно использовать в качестве основы для изучения политропного процесса. изучение процессов с различными значениями n приводит, в частности, к частным случаям политропного процесса. Это особенно заметно в данном исследовании.
Процесс p = C O p 8 I (изобарный процесс).Из уравнения (5.10), если политропный показатель n = 0 ри «= ро» = Р = sop51(5, 20) Поэтому политропный процесс с индексом n = 0 протекает при постоянном давлении. Этот процесс называется iso- Адвокатура. Таким образом, в процессе изменяется только температура газа и его объем, а из уравнения состояния видно, что изменение объема пропорционально изменению температуры Ноль два (5.21%)) Работа газов в изобарном процессе определяется по формуле(5.15) или(5.16).И n = 0 обнаружение Я = п(комплексе O₂-1>、)、 (5.22) I =₽(7 \ — Γ.).
Делением Температуры, которые в момент бремени, равный нулю, погрузили в жидкость с нулевой температурой, мы должны решать задачу с болванкой таким же образом. Людмила Фирмаль
Для рисунка 5.3 газ характеризуется точкой/, процесс может перейти к расширению до точки 2 или сжатию до точки 3. В первом случае, с увеличением объема, газ выполняет работу расширения, которая определяется площадью прямоугольника 12451, и одновременно нагревается it. It нагрюет газ путем поставлять жару от снаружи и выполняет работу расширения. Во 2-м случае газ сжимается, поэтому работа по уплотнению производится снаружи. Но так как эта работа преобразуется в тепло, а газ не только нагревается, но и охлаждается, то он должен быть взят из внутренней энергии тела и удалить из окружающей среды все тепло, эквивалентное работе сжатия. Процесс.) для N-1, из Формулы (5.10) ри- = ро = const1.
Из выражения (5.26) продолжается. (5.25) изобарный процесс, входное количество которого равно изменению энтальпии газа. — o-диаграмма процесс представлен прямой линией.—- л — — — — — — с…….. ….. О начальном состоянии s То есть в этом процессе количество газа изменяется обратно пропорционально давлению(метод Бойля-Марриота). Температура процесса не изменяется, поэтому внутренняя энергия газа также постоянна, 4i = 0.И так оно и есть.、 Первый закон термодинамики этого процесса 5 часов вечера.
Выяснить Нравится L = L или если вся подводимая теплота преобразуется в работу по расширению газа, или наоборот, вся работа, затраченная на сжатие газа, должна отводиться в окружающую среду в виде тепла. Работа газа в этом процессе определяется из уравнения общей работы и учитывает по = КТ = sopz1. / = ^ pj0 = ^/?T-y — =TT1n — ^ — = 7?T1n -^ -. (5.27) Теплоемкость процесса по формуле (5.9) равна Физический смысл этой бесконечности заключается в том, что температура газа не может быть изменена с конечным значением теплоемкости, так как все подводимое тепло полностью преобразуется и выполняет свою работу.
- На диаграмме p-o кривая процесса представлена уравнением po = SOP51, то есть равносторонней гиперболой, координаты которой являются асимптотами. Отсюда и цифра Точка 1 представляет начальное состояние газа, процесс переходит в точку 2, и газ расширяется. Газ выполняет работу, определенную ПЛ. 12451, и к нему следует прибавить теплоту, эквивалентную этой работе. Если процесс продолжается до пункта 3, то газ будет сжат и примет работу, которая будет определена в pl. 13651, и тепло, эквивалентное этой работе, удаляется. Поскольку продукт po увеличивается с увеличением температуры, изотермы удаляются все дальше от источника.
Если показатель политропа n = k, то из уравнения (5.19) следует, что количество подводимого в процессе тепла равно В результате этого политропный процесс протекает менее чем в 5 раз без теплообмена с окружающим пространством. Такой процесс называется теплоизоляцией. Из уравнения первого закона термодинамики dr = O Ди + Л = О.
Однако любое уравнение должно быть справедливо при отсутствии другого, поэтому -постоянная должна быть равна нулю. Людмила Фирмаль
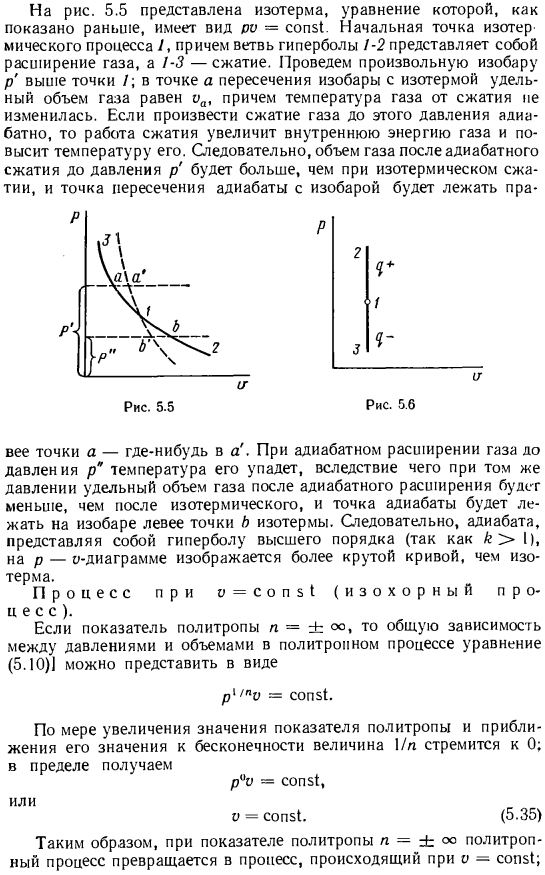
В этом процессе вся работа, проделанная газом, получается за счет уменьшения его внутренней энергии, а вся работа, затраченная на сжатие газа, наоборот, увеличит внутреннюю энергию Официальная: взаимосвязь параметров газа в процессе изоляции Формула работы получена из общей политропной формулы процесс замены n на n = co5 (, Р0 о * = о пр *; Тогда * −1= const1, T, o {-1= 7.0}-*; (5.29))* (5.30) (5.31) (5.32) (5.33) (5.34)) На рис. 5.5 показана изотерма, и уравнение принимает вид do = const1, как описано выше. Начальная точка изотермического процесса/и бифуркация гиперболы 1-2 представляет собой расширение газов, а 1-3-сжатие.
Нарисуйте любую изобару p над точкой/.в точке a на пересечении изобары и изотермы удельный объем газа равен, а температура газа не изменяется от сжатия. Когда газ адиабатически сжимается до этого давления, внутренняя энергия газа увеличивается за счет работы сжатия, что увеличивает temperature. As в результате объем газа после адиабатического сжатия до давления p ’будет больше, чем в случае изотермического сжатия.
Изоповерхность находится справа. Точка а находится где-то. Когда газ адиабатически расширяется до давления Р, его температура снижается, в результате удельный объем газа после адиабатического расширения становится меньше, чем после изотермического, и адиабатическая точка лежит на изобарной линии слева от изотермической точки B. As в результате изоляция, представляющая собой гиперболу более высокого порядка (от k> I), показывает более крутую кривую на диаграмме p-o, чем на изотермах. о=процесс в сопЗI (изоколлих Если индекс политропа равен n =±oo, то общая зависимость между давлением и объемом в процессе политропа, уравнение (5.10)] может быть выражена как: Р ’ 1пО-sop₅ .
Если значение показателя политропа увеличивается, а его значение приближается к бесконечности, то значение 1 / n будет равно 0.В определенных пределах п°о = SOP81、 о = const и(5.35) Итак, если политропный показатель n =±0, то процесс превращается в процесс, который происходит при: Политролоп Такой процесс называется равенством. из уравнения o = CO1131、 (5.36)) В равнобедренном процессе давление газа пропорционально абсолютной температуре. Ло = 0, поэтому газ работает не в этом процессе, а в уравнении первого закона термодинамики 7 = c, (7 \ — Γ.). (5.37)) на диаграмме Р — » (рис.5.6) изолинии выглядят как прямые линии, параллельные основному давлению.
Смотрите также:
| Понятие о теплоемкости | Определение показателя политропы |
| Работа, внутренняя энергия и теплота политропного процесса | Характеристики политропных процессов в зависимости от значения показателя n |

