Оглавление:
Влияние электростатических взаимодействий на поведение ионов в растворе. Ионная сила раствора. Коэффициент активности
Характеристикой электростатического поля в растворе и мерой электростатических взаимодействий ионов является ионная сила раствора I, связанная с концентрацией ионов 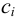 (моль/л) и их зарядами
(моль/л) и их зарядами 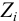 соотношением:
соотношением:
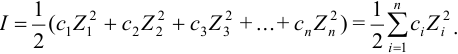
Ионной силой раствора определяется коэффициент активности иона 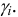 . Измерить величину
. Измерить величину 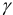 индивидуального иона невозможно, поэтому пользуются экспериментально определяемым средним коэффициентом активности
индивидуального иона невозможно, поэтому пользуются экспериментально определяемым средним коэффициентом активности 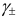 . Для электролита типа
. Для электролита типа 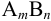 :
:
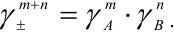
Например, для 0,01 М раствора 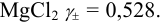 Это означает, что раствор ведет себя так, как будто его концентрация в 0,528 раз меньше, чем 0,01 М. Т. е. коэффициент активности является некоторой мерой отклонения реальной системы от идеальной. В то же время отклонение в проявлении свойств ионов
Это означает, что раствор ведет себя так, как будто его концентрация в 0,528 раз меньше, чем 0,01 М. Т. е. коэффициент активности является некоторой мерой отклонения реальной системы от идеальной. В то же время отклонение в проявлении свойств ионов 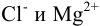 в реакциях от концентраций (0,02 и 0,01 моль/л) будет разным, поскольку
в реакциях от концентраций (0,02 и 0,01 моль/л) будет разным, поскольку 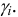 для иона зависит от I раствора, от
для иона зависит от I раствора, от 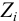 и, строго говоря, от ионного радиуса (пример 2.1). Связь
и, строго говоря, от ионного радиуса (пример 2.1). Связь 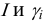 очень сложна, и для разбавленных водных растворов выражается формулами Дебая и Хюккеля (ионы при этом рассматриваются как точечные заряды и различие в их размерах не учитывается):
очень сложна, и для разбавленных водных растворов выражается формулами Дебая и Хюккеля (ионы при этом рассматриваются как точечные заряды и различие в их размерах не учитывается):
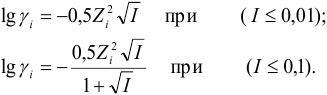
В практических расчетах для оценки коэффициентов активности используют ряд постулатов, упрощающих расчеты:
- Коэффициенты активности ионов равного заряда, независимо от знака и размера, приблизительно равны.
- Растворы, содержащие только нейтральные молекулы, можно считать идеальными
 .
. - Разбавленные растворы электролитов (особенно — слабых!) приближаются к идеальным
 .
.
Поэтому при расчете величины 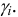 можно пользоваться таблицами, в которых приведены значения
можно пользоваться таблицами, в которых приведены значения 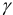 для одно-, двух-, трех-, четырехзарядных ионов независимо от типа иона (например табл. 1 приложения).
для одно-, двух-, трех-, четырехзарядных ионов независимо от типа иона (например табл. 1 приложения).
Коэффициент активности является мерой отклонения реальной системы от идеальной. Он связывает концентрацию иона и его активность 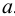 :
:
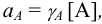
где [А] — равновесная концентрация иона А. Активность имеет размерность концентрации (моль/л).
Следует помнить, что при расчетах любого из четырех видов химических равновесий с применением табличных (термодинамических) констант равновесия получают значения активностей частиц, а не их равновесные концентрации. Расчет равновесных концентраций при I > 0 проводится с учетом у с использованием уравнения (2.11), связывающего различные константы.
Пример 2.1.
Вычислить ионную силу, коэффициенты активности и активность ионов в 0,010 М растворе 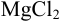 .
.
Решение:
Уравнение диссоциации сильного электролита
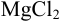 :
:
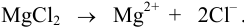
Начальная концентрация (моль/л) с: 0,010
Равновесные концентрации (моль/л) […]: — 0,010 0,020.
По формуле (2.1) вычисляют ионную силу раствора:
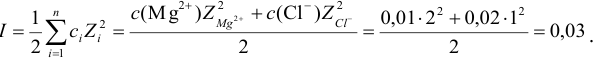
Коэффициенты активности можно найти в табл. 1 приложения: при / = 0,03 для двухзарядного иона 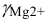 = 0,54; для однозарядного иона
= 0,54; для однозарядного иона 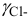 = 0,88. Расчеты по формулам (2.3) при
= 0,88. Расчеты по формулам (2.3) при 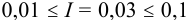 приводят к близким к справочным значениям
приводят к близким к справочным значениям 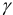 .
.
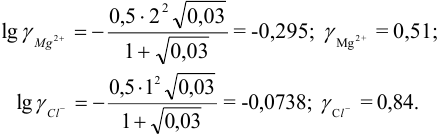
Активности ионов соответственно равны:
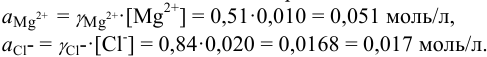
Пример 2.2.
Во сколько раз изменится активность ионов водорода в 0,010М растворе  , если в 1,0 л такого раствора растворить 3,4 г сульфата алюминия?
, если в 1,0 л такого раствора растворить 3,4 г сульфата алюминия?
Решение:
Для 0,010 М раствора  : I= 0,01;
: I= 0,01;
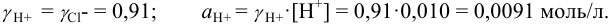
Молярная концентрация раствора 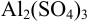 при растворении в
при растворении в 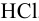 :
:
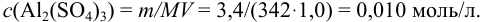
В полученном растворе сильных электролитов устанавливаются равновесия:
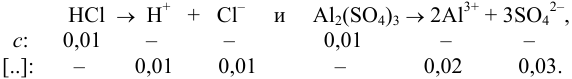
В величину I (формула 2.1) вносят вклад все ионы, находящиеся в растворе:
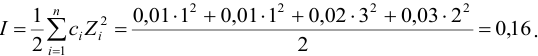
При 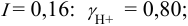
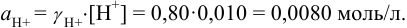
Отношение полученных активностей (0,0091/0,0080) показывает, что при введении в раствор 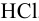 соли
соли 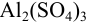 активность ионов водорода уменьшилась всего в 1,14 раз, в то время как ионная сила раствора увеличилась в 16 раз.
активность ионов водорода уменьшилась всего в 1,14 раз, в то время как ионная сила раствора увеличилась в 16 раз.
Пример 2.3.
Вычислить ионную силу и активности ионов в растворе, полученном при сливании по 100 мл 0,050 М раствора 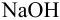 и 0,040 М
и 0,040 М 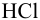 .
.
Решение:
При сливании растворов протекает реакция нейтрализации с образованием достаточно слабого электролита — воды, диссоциацией которой пренебрегаем. Данные указывают на избыток взятой щелочи.
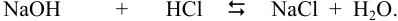
С учетом разбавления 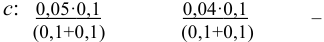
и после расчета 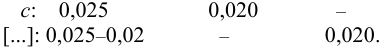
В растворе присутствуют ионы 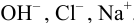 , для которых
, для которых 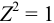 .
.
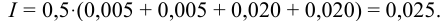
Соответственно 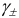 = 0,88 и активности ионов составляют:
= 0,88 и активности ионов составляют:
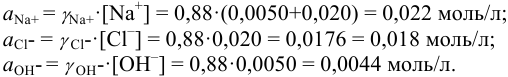
Проверкой решения может быть выполнение принципа электронейтральности раствора в целом:
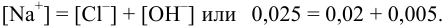
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

